桃PpCBF2基因克隆及其响应低温表达特性研究
2020-09-15宋艳波赵小慧王科杰李耀霞陈双建吴国良
宋艳波 赵小慧 王科杰 李耀霞 陈双建 梅 霞 李 宏 吴国良
(1.山西农业大学 生命科学学院,山西 太谷 030801; 2.山西省吕梁市科技交流中心,山西 吕梁 033000; 3.山西省农业科学院 果树研究所, 山西 太谷 030801; 4.山西农业大学 园艺学院,山西 太谷 030801)
桃(Prunuspersica(L.) Batseh.)原产中国,具有一定的耐寒特性。尽管,近年来全球气候变暖,但是晚春霜冻的发生频率和严重程度并没有降低[1-2],因为气候变暖使植物春季物候期提前,秋季物候期推迟[3-5],造成毁灭性春冻越来越多和更加常见[6]。对桃树调查表明,仲春最高气温升温极快,最低气温升温相对较慢,这种较大温差更容易使嫩芽、嫩叶、花朵和幼果受到霜害[2,7],影响果实的发育进程,造成桃树减产[7-8];严重时造成桃的绝收, 2013年4月中旬的低温和降雪以及2018年盛花期的低温造成山西省大面积的桃树受冻,当年产量近乎为零。因此,研究桃树抗寒机理,培育抗寒品种势在必行。
低温会诱导相关功能基因的表达[9],而植物对低温等逆境的抵抗能力是受多基因共同调控的数量性状。CBF/DREB1(C-repeat binding factor/dehydration-responsive element binding factor)是低温信号转导过程中的一个关键调控因子[10]。研究表明,CBF调控着许多与冷诱导相关功能基因的表达,通过增强该调节因子的作用就能使植物的抗冷性得到显著提高[11]。目前已在多种植物中分离到该基因并进行了相关研究,例如将拟南芥的CBF1转入番茄[12],转基因植株的耐冷性显著提高;将拟南芥CBF3基因导入玉米[13]、OsCBF基因转化水稻[14],转化植株的抗寒、抗旱和抗盐等能力都有所提高;将南极草中的DaCBF7(D.antarcticaC-repeat binding factor 7)转入粳稻(OryzasativaL. japonica variety ‘Dong-Jin’),增强了水稻对寒冷胁迫的耐受性[15]。CBF是一类含有AP2(APETALA2)保守结构域的转录激活因子,在植物中常以多基因家族形式存在,家庭成员编码相关的蛋白质,共享一个同源DNA结合域。Welling等[16]从文库中分离到4个桦树CBF基因;在苹果基因组中,有5个CBF基因[17];Badawi等[18]2007年在小麦中已经发现25个CBF基因,Mohseni等[19]进一步研究表明,在小麦中CBF家族至少包含65个CBF基因;Jung等[20]在Campoli等[21]的研究基础上鉴定了12个新的黑麦CBF基因。在草本[22-23]和木本植物[24-26]冷响应和冷适应中CBF的功能都已经被证明。但CBF基因的表达模式在不同组织中是不同的[27]。Xiao等[28-30]从葡萄中克隆得到对逆境胁迫响应的4个CBF:VvCBF1、VvCBF2、VvCBF3和VvCBF4,发现其中前3个基因在幼嫩组织中表达强度比成熟组织中高,而VvCBF4基因在成熟的老叶和花芽中也表达。低温(0 ℃)不能诱导葡萄果肉和果皮中VvcCBF1或VvcCBF4表达[31]。CBF基因家族的不同成员在低温诱导下有着不同的表达模式,说明不同成员对低温胁迫响应不同。已有研究证明番茄LeCBF1在低温下快速转录积累,24 h后降低到常温下水平,番茄LeCBF4基因在低温下也表现与LeCBF1类似的表达模式[32]。但是,与LeCBF1和LeCBF4相比,LeCBF2和LeCBF3对低温都没有响应。在拟南芥中超表达AtCBF1和AtCBF3均可显著提高对低温的抵抗能力,并且研究显示CBF1和CBF3的调控路径与CBF2不同,在冷适应条件下二者的表达顺序均先于CBF2,说明各成员可能具有不同的功能活性[33],成员间通过协同调控诱导植物冷驯化的形成[33-34]。研究表明,桃树中有6个CBF成员,并且在果实冷藏中PpCBF1,PpCBF5和PpCBF6的表达受低温诱导,而其他基因保持相对不变[35]。
综上所述,CBF转录因子与植物抗寒性密切相关,但是由于桃的遗传背景复杂、品种繁多,对于其转录因子CBF的序列与功能研究鲜有报道。本研究选取生产中主栽的17个桃品种,通过PCR与RT-PCR技术从中分离克隆PpCBF2基因,并分析该基因在品种间序列差异和表达特性,旨在探讨不同桃品种间抗寒性差异的分子机制,以期为抗寒性育种提供相关基因资源和调控信息。
1 材料与方法
1.1 试验材料
4 ℃处理毛桃(Prunuspersica)幼苗12 h,选取叶片,迅速投于液氮中;选择长势一致的‘早红霞’(P.persicavar.nectarina‘Zaohongxia’)和‘大久保’ (P.persica(L.) Batsch ‘Okubo’) 一年生嫁接苗(砧木是山桃(Pdavidiana.(Carr.)Franch)各3株进行4 ℃低温处理,于0.0、0.5、1.0、6.0、12.0、24.0和48.0 h采摘叶片,并迅速投入液氮,存于-80 ℃。选取‘Okubo’,‘端玉’,‘金秋’,‘寒露’,‘81715’,‘三台肉桃’,‘早金’,‘9618’,‘B6832’,‘秀峰’,‘Italia3’,‘NJN76’,‘锦霞’,‘丹墨’,‘Zaohongxia’,‘白芒蟠桃’和‘早露蟠桃’的叶片,放于冰盒中带回实验室,4 ℃处理1~2 d后进行基因组DNA提取。以上材料均来源于山西省农业科学院果树研究所桃资源圃。
1.2 试验方法
1.2.1DNA、总RNA 提取及cDNA合成
总RNA提取是用RNA快速提取试剂盒(华越洋生物有限公司,北京)根据说明书进行,DNA提取是参照宋艳波等[36]改良CTAB法对桃叶片基因组进行提取。反转录根据PrimeScript反转录试剂盒(TaKaRa生物有限公司,大连,中国)提供程序进行。10 μL反应体系:2.0 μL 5×Prime Scipt®缓冲液,1.0 μL总RNA模板,7.0 μL无RNA酶的水。反应程序: 37 ℃ 15 min,85 ℃ 5 s,然后产物储存在-20 ℃。
1.2.2引物设计与合成
以梨树CBF基因(AEG64738)的氨基酸序列为信息探针,搜索GenBank数据库中的桃树EST数据,并根据高度同源的EST序列体外拼接桃树的CBF基因,进而根据拼接序列采用Premier 5.0引物设计软件(Premier Biosoft International,帕洛阿尔托,加利福尼亚州,美国)设计CBF特异引物对PpCBFf0/PpCBFr0(GTTTCTAACTACAAAATCCACCTTTCC/GAAGTACAAAATTTAACAATTTCTCACAAC),根据Li等[35]报道设计荧光定量表达引物PpCBFf1/PpCBFr1(GCGTCAGAAAGCAAGTCAGC/CTCGGTGTAAAGAGGTGGAGACA),预测产物长度126 bp。引物由上海生工生物工程股份有限公司合成。
1.2.3常规RT-PCR
15 μL反应体系:正反向引物(10 μmol/L)各0.6 μL,cDNA或DNA模板0.8 μL,ddH2O 5.5 μL,2× Es Taq Master Mix (含染料)(中科瑞泰生物科技有限公司,北京,中国) 7.5 μL。反应条件:94 ℃ 4 min;94 ℃ 40 s,56.5 ℃ 45 s,72 ℃ 60 s,34个循环;72 ℃ 10 min,琼脂糖凝胶电泳检测。
1.2.4序列测定及质粒提取
按照pEASY®-T3 克隆试剂盒(北京全式金生物技术有限公司,北京,中国)说明,将回收的DNA片段连接至pEASY-T3克隆载体,25 ℃ 恒温10 min,使回收产物与T3载体充分连接。37 ℃ 过夜培养12~16 h。将扩增片段与pEASY-T3载体的连接产物转入Trans1-T1抗性噬菌体的化学感受态细胞(北京全式金生物技术有限公司,北京,中国),并由北京华大中生基因有限公司测序。序列分析采用Clustal W及Boxshade联配,以及在线NCBI数据库(www. ncbi.nlm.nih.Gov),二级结构分析采用在线软件(http:∥www.expasy.org/cgi-bin/prosite/),疏水性/亲水性分析利用在线的 ProtScale 软件(http:∥www.expasy.org/cgibin/ protscale.pl)进行,采用Clustal X (version 1.81) 推导氨基酸序列,系统进化树用MEGA(version 7.0)邻近法默认参数获得。
1.2.5实时荧光定量 PCR
qRT-PCR是采用Bio-Ra1d实时热循环系统(赫拉克勒斯,加利福尼亚州,美国)和SYBR-Green试剂盒对基因特异性引物和看家基因引物进行实时聚合酶链式反应,分析基因的表达。扩增反应:95 ℃ 预变性10 s,95 ℃变性5 s(40个循环),55 ℃退火10 s,在第二阶段72 ℃延伸15 s,最后55~95 ℃ 确定扩增产物的熔解曲线。所有反应3个重复。计算2-ΔΔCt[37]获得基因相对表达。
1.3 统计分析
数据的平均值、标准误差和显著性分析采用SPSS 19.0 (IBM有限公司,纽约,美国)进行。数据生成图形是采用SigmaPlot 12.5 (Systat软件公司, 英国)。结果用平均值±标准误差 (mean±SE)表示,P<0.05为显著性。
2 结果与分析
2.1 PpCBF基因的克隆及序列分析
以毛桃的基因组DNA和cDNA为模板,经过PCR和RT-PCR扩增均获得894 bp的片段,两者序列一致,表明桃树PpCBF不含内含子。分析显示(图1)其包含121 bp的5′端非编码序列,83 bp的3′端非编码序列,以及690 bp的开放阅读框,编码229个氨基酸,分子量约为24.976 98 ku,等电点为5.058,属于酸性蛋白。该序列提交到GenBank,登录号为KC885952。序列比对表明该基因为PpCBF2。利用生物信息学软件(http:∥www.expasy.org/cgi-bin/prosite/)对推导的氨基酸序列分析,PpCBF2含有CBF家族的AP2/EREBP功能域(V67-A124),表明该蛋白属于CBF家族。信号肽预测 (Signal P 4.0) 显示,PpCBF2不含信号肽,表明该蛋白无需跨膜运输。此外,该蛋白还存在2个蛋白激酶C磷酸化位点(31~33,76~78),1个酰胺化位点(55~58),1个cAMP和cGMP依赖的蛋白激酶磷酸化位点(73~76),2个N-豆蔻酰化位点(12~17,34~39)以及5个酪蛋白激酶II磷酸化位点(25~28,40~43,144~147,175~178,210~213),2个GLYCOSYLATIONN-糖基化位点(29~32,38~41),表明在PpCBF2的生物合成过程中需要多种翻译后加工修饰作用才能成为具有天然功能的成熟肽。

下划线部分为AP2/EREBP功能域。 The underlined part is AP2/EREBP domain.图1 桃PpCBF2 cDNA的核苷酸序列及其推导的氨基酸序列Fig.1 Nucleotide sequence in cDNA and deduced amino acid sequence of peach PpCBF2
2.2 不同桃品种PpCBF基因的克隆与序列分析
由表1可知,13个品种桃PpCBF2基因发生23处碱基改变,其中8处是A和G转换(5处A转换为G),13处T与C的转换(只有1处是C变为T);2处发生G颠换为T。供试品种PpCBF2基因编码的氨基酸数目相同,均为229个,相似性介于98.3%~100%。由表2可知,有9个品种的氨基酸残基发生突变,其中‘白芒蟠桃’第1个N-豆蔻酰化位点中的C变成了R、‘81715’第1个酪蛋白激酶II磷酸化位点中的S变成了P、‘大久保’第5个酪蛋白激酶II磷酸化位点中的D变成了G,而‘Italia 3’、‘寒露’和‘B6832’ 的突变发生在AP2/EREBP功能域。由表3可知,它们虽然都属于亲水性蛋白,但发生氨基酸残基突变后蛋白的亲水性发生不同程度的变化,亲水性平均数为-0.485~-0.430。对这些蛋白的二级结构预测表明, 毛桃(Prunuspersica)的CBF蛋白由 26.20% 的α-螺旋、16.59%的延伸链、3.93%的β-转角和53.28%的无规则卷曲组成,其他品种与之相比所含成分比例均略有差异,由此可以看出,不同品种间的二级结构在空间上发生了一定的变异。
2.3 不同桃品种PpCBF2基因推导蛋白的系统进化分析
由图2可知,在供试品种中,除‘Okubo’外,其他品种PpCBF2基因先聚为一类,再与‘Okubo’聚类,之后与苹果等其他蛋白聚类。可见,桃不同品种中该基因进化较为保守,但还是会有变化,比如‘Okubo’,因此该品种的PpCBF2基因在抗冷性方面的不同值得进一步研究。

表1 不同品种桃CBF基因碱基变异Table 1 Base mutation of CBF gene in different peach varieties

表2 不同桃品种CBF基因的氨基酸残基突变位点统计表Table 2 Amino acid residues mutations of CBF gene in different peach varieties
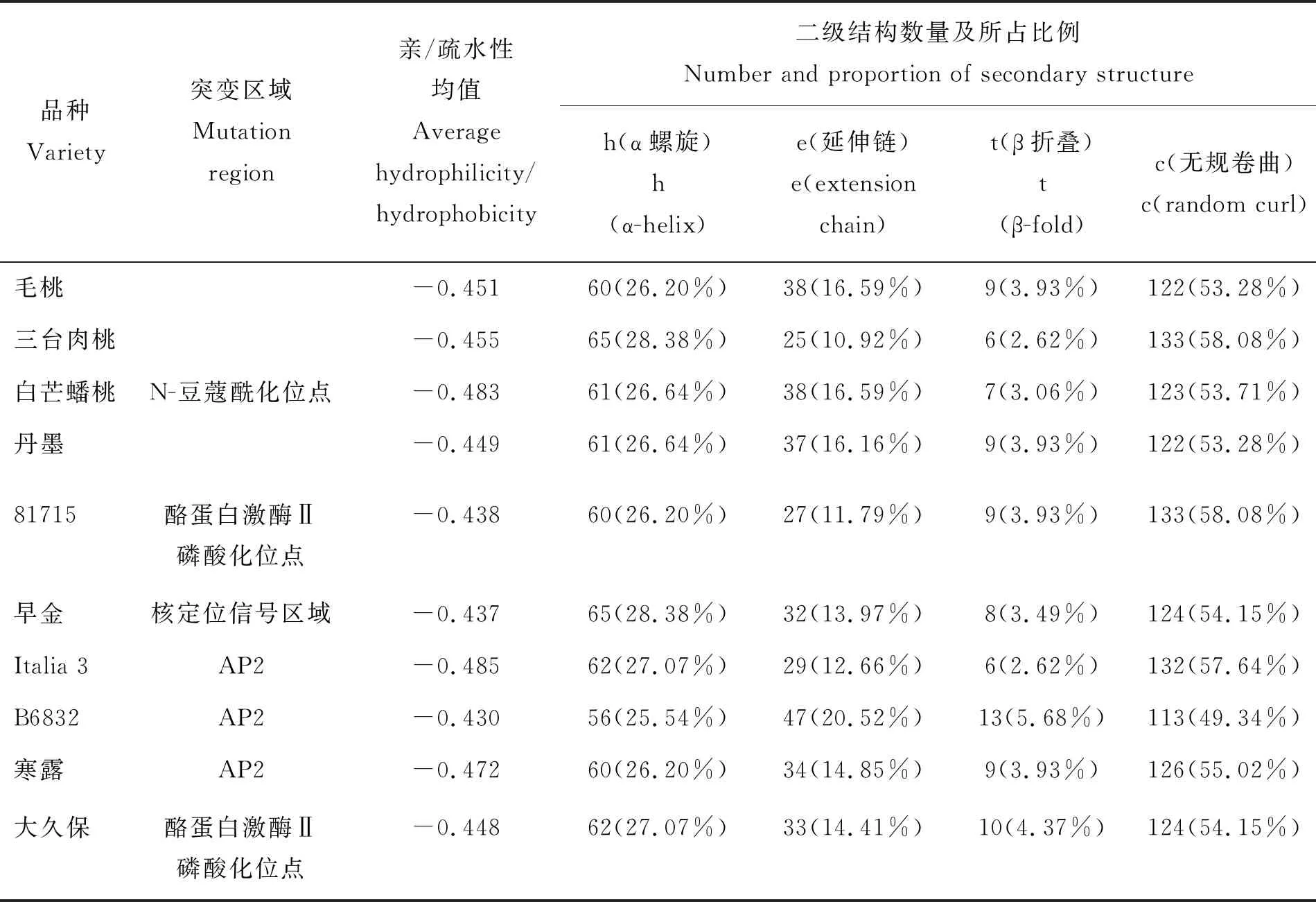
表3 发生突变的PpCBF2蛋白亲水性和二级结构变化Table 3 Changes in hydrophilicity and secondary structure of mutated PpCBF2 protein
2.4 ‘早红霞’(‘Zaohongxia’)和‘大久保’(‘Okubo’)PpCBF2基因在低温下表达
由表4可知, ‘早红霞’(‘Zaohongia’)的CBF2在冷处理0.5 h表达显著增加,在6.0 h表达量达到最高值,12~48 h缓慢下降,最大达10.91倍,差异极显著(P<0.01);‘大久保’(‘Okubo’)的CBF2在冷处理0.5 h虽未检测到表达量显著增加,但 1.0 h 时表达量达到最大,达6.24倍,差异极显著(P<0.01)。两品种的CBF2基因均被4 ℃低温强烈诱导,且表达趋势相同,但‘大久保’(‘Okubo’)的CBF2在低温诱导的相同时间下均没有‘早红霞’(‘Zaohongxia’)的表达量高,品种之间表达差异极显著(P<0.01)。
3 讨 论
低温胁迫是影响作物品质和产量的主要环境胁迫。在冷调节信号通路中,CBF被认为是应对冷应激的主调节因子[38]。Champ等[39]研究发现,CBF1基因上调表达的时间和表达量的不同导致了枳(Poncirustrifoliata)和葡萄柚(Citrusparadisi)抗寒性的不同。翟瑞宁[40]对抗寒性不同的2个木薯品种研究表明,CBF1基因序列差异导致蛋白结构不完整是其抗寒性弱的原因。桃树不同品种抗寒性也存在差异[41],为了探求这种差异的分子基础,研究分析了毛桃和17个品种桃的PpCBF2基因序列,发现它们均含有由57 个氨基酸组成的 AP2 结合域,表明其属于AP2/ERF家族基因[42];在 AP2结构域上下游分别含有PKKP/RAGRx KFxETRHP(51~66位)和 DSAWR(125~129位)两段特殊的高保守序列,分别称为核定位序列(nuclear localization signal,简称NLS)和CBF信号基序,是区别CBF 转录因子与AP2/ERF家族其他成员的特征短肽序列[43],说明PpCBF2是典型的CBF转录因子。聚类分析显示所有供试品种均聚合为一类,说明该基因在不同品种中具有相似功能。

遗传距离 Genetic distance 图2 拟南芥、杨树、番茄、苹果、葡萄和桃PpCBF2蛋白的系统发育分析Fig.2 Phylogenetic analysis of the CBF proteins of Arabidopsis, poplar, tomato, apple, grape and peach (PtCBF2 (ACR39134), PtCBF3 (ACR39133), MdCBF1 (HM992942),VrCBF4 (AY706986), LeCBF3 (AAS77819),AtCBF4 (At5g51990))

表4 PpCBF2基因在‘早红霞’和‘大久保’低温处理0~48 h的表达Table 4 Expression of PpCBF2 in ‘Zaohongxia’ and ‘Okubo’ from 0-48 h after low temperature treatment
所有供试品种PpCBF2基因编码的氨基酸数目相同,相似性介于98.3%~100.0%,与前人研究的CBF在植物中高度保守的结论一致[44]。其中,有9个品种氨基酸残基发生了突变,涉及AP2结构域内的是‘Italia 3’(81位的C变为Y)、‘B6832’(95位G变为V)和‘Hanlu’(121位L变为S),‘早金’在51~66位的核定位信号区域中发生突变(65位E变为G),这两个区域对CBF的DNA结合特异性和转录活性至关重要[45-46],AP2结构域发生单个突变通常可以改变植物体的形态[45];核定位序列中的缺失或突变会阻碍CBF1诱导其靶基因表达的能力,影响CBF1与CRT/DRE元素结合[43]。蛋白质的翻译后修饰影响蛋白质的活性和基因表达[47],‘白芒蟠桃’在第一个N-豆蔻酰化位点(14位的C变为R)内发生,‘81715’(25位S变为P)和‘大久保’(213位D变为G)分别在第一个和第五个酪蛋白激酶Ⅱ磷酸化位点发生突变。磷酸化位点在植物CBF/DREB1转录因子中大量存在,但其确切的磷酸化作用报道较少,Parinita等[47]研究发现御谷(Pennisetumglaucum)PgDREB2A蛋白在体外磷酸化位点是苏氨酸残基,且磷酸化后负调控其对DNA的结合活性。这些位点的变化还改变了蛋白的亲水性,或增强或减弱,这种特性也可能与不同品种抗寒性差异有关[40]。但是彭婷[48]对梅花的研究认为,导致梅花品种抗寒性差异的决定因素并不是CBFa基因编码区序列上的差异,而是CBF基因表达调控上的差异。
Karimi等[49]研究发现,4 ℃处理对葡萄不同品种的4个CBF转录因子均在冷胁迫初期呈上升趋势,随后下降,且寒冷地区的品种4个转录因子表达水平更高。PpCBF2在‘大久保’和‘早红霞’2个不同品种中表达趋势与葡萄中一致,‘早红霞’的CBF2表达量始终高于‘大久保’,但仅仅由此并不能说明哪个品种耐寒性更好。在拟南芥中CBF2缺失会使其在冷驯化前后对低温的耐受性增加,认为CBF2负调控CBF1和CBF3的表达,CBF1和CBF3的水平增加使得植株抗性增强[34]。Li 等[35]分析桃果实在采后冷贮藏中CBF基因对低温胁迫的响应不一致,PpCBF1,PpCBF5和PpCBF6的转录被低温诱导,而PpCBF2,PpCBF3和PpCBF4相对保持不变。对葡萄的研究同样发现,不同CBF家族成员在不同组织中对低温响应模式不同[28-30],这可能与不同家族成员功能差异有关。因此,对CBF家族各成员在桃树中的功能和互作机制进一步研究是全面分析不同品种抗性差异的基础。
4 结 论
基因克隆获得毛桃和17个品种桃的PpCBF2基因序列;发现一些品种在该基因的重要结构位点发生突变,突变后蛋白质的亲水性和二级结构都有所改变;‘早红霞’和‘大久保’两品种的PpCBF2基因均受低温诱导,且表达规律相似,但表达差异极显著。
