U0126纳米药物载体的制备及其用于肺动脉高压治疗*
2020-09-10徐仓宝张亚萍
李 科,徐仓宝,张亚萍,张 彦
(1.西安医学院 陕西省缺血性心血管疾病重点实验室,陕西 西安 710021;2.西安医学院 药学院,陕西 西安 710021)
肺动脉高压(Pulmonary arterial hypertension,PAH)是一种恶性进展性疾病,愈后较差。据统计,全球约有1亿的肺动脉高压患者,可发生于任何年龄,女性的患病率约为男性的2倍。尽管目前内皮素(endothelin,ET)受体拮抗剂、磷酸二酯酶-5(phosphodiesterase-5,PDE-5)抑制剂、前列环素(prostacyclin 2,PGI2)及其类似物等已用于PAH临床治疗,但PAH 患者的1a病死率仍高达15%, 在美国,原发性PAH患者的5a存活率低于35%[1-4]。肺血管过度收缩是PAH的一个重要特点,病理状态下血管收缩因子内皮素-1(endothlin-1,ET-1)的分泌量大大增多,会引发肺血管收缩异常[5]。而ET-1需通过内皮素受体(endothlin receptor)发挥作用,其中的B型内皮素受体(endothelintype B receptor,ETB)存在于血管平滑肌细胞中,介导血管平滑肌细胞收缩和增殖,在正常状态下仅有少量表达,对ETB受体激动剂刺激无收缩反应或仅有轻微的血管收缩。而在病理状态下,细胞外调节蛋白激酶1和2(Extracellular signal-regulated kinases 1 and 2,ERK1/2)信号转导通路介导的转录和翻译机制被激活,使ETB受体表达增高,导致血管平滑肌细胞收缩增强,动脉血管平滑肌呈现高反应性,通过抑制该通路可以有效逆转动脉血管病理收缩[6-7]。针对ERK1/2及相关通路的抑制剂有很多,其中有一部分被用于抗血管平滑肌收缩方面的研究,其中效果比较突出的是化合物PD98059[8]。徐仓宝等后续研究发现U0126具有更为显著的抗血管收缩能力[9-10]。该化合物对目标蛋白的亲和力比PD98059强100倍,且对其他众多激酶的抑制作用非常弱[11],是非常具有潜力的抗PAH治疗分子。然而,U0126水溶性极差,且大剂量使用后会造成严重的脏器毒性,直接使用U0126存在一定局限性,所以需要通过新的手段和方式来推进该化合物的应用。
纳米药物载体为解决上述问题带来了新契机,已有很多纳米药物载体用于心血管治疗的研究,国际上,Lanza团队在该领域研究相对较早,1998年发表了利用氟碳纳米载体对心血管进行治疗的研究论文[12]。在中国,也有众多学者利用各种纳米药物载体进行心血管疾病治疗的研究,其中包括动脉粥样硬化斑块、心律不齐及心肌缺血等多个方向[13-15]。因此纳米载药系统为U0126体内干预PAH提供了强有力的支持。作者首先制备一种阳离子两亲性淀粉,以其为包材构建U0126纳米载药系统,依靠其小的粒径、阳离子表面完成组织和细胞的摄取,达到快速递送和有效干预的作用,研究结果将为PAH的治疗提供新方法及新思路。
1 实验部分
1.1 原料、试剂与仪器
可溶性淀粉:来源为玉米,天津市风船化学试剂有限公司。
肉豆蔻酸(MA)、二甲基亚砜(DMSO):上海阿拉丁生化科技股份有限公司;2,3-环氧丙基三甲基氯化铵(GTAC)、N,N′-二环己基碳二亚胺(DCC)、4-二甲氨基吡啶(DMAP)、香豆素-6:西格玛奥德里奇(上海)贸易有限公司;氢氧化钠、冰醋酸、无水乙醇、乙醚:国药集团化学试剂有限公司;DMEM培养基:美国Hyclone公司;CCK-8kit、Sarafotoxin 6c(S6c):上海碧云天生物技术有限公司;抗-ETB抗体、抗β-actin抗体:Cell Signaling Technology Co.,Ltd;人脐静脉内皮细胞(HUVECs)、人胚肺成纤维细胞(IMR90)、小鼠脂肪细胞(3T3-L1):来源均为美国标准生物品收藏中心(ATCC)细胞库;SD大鼠:雄性,250 g,西安交通大学实验动物中心。
核磁共振波谱仪:Advance 400MHz,德国Bruker公司;酶标仪:ELx800,美国BioTek公司;马尔文粒度仪:Nano-ZS90,英国Malvern公司;场发射透射电子显微镜(TEM):H-600,日本Hitachi公司;高效液相色谱仪:LC-20A,日本Shimadzu公司;倒置荧光显微镜:Eclipse Ti-S,日本Nikon公司;微血管张力仪:630MA,丹麦DMT公司;电泳设备:164-5050,美国Bio-Rad公司。
1.2 阳离子双亲淀粉包材的合成及表征
将50 g可溶性淀粉105 ℃干燥2 h后倒入100 mL DMSO中,t=60 ℃,转速为200 r/min搅拌至溶解,依次加入4.56 g MA,3.8 g DCC和1.02 g DMAP,待全部溶解后密封瓶口,以室温搅拌反应48 h。反应完毕后除去白色沉淀,利用V(乙醇)∶V(乙醚)=1∶1洗脱液收集沉淀,干燥后溶于20 mL纯水中,再逐步加入1 mLc(NaOH)=1 mol/L溶液和5.2 mL GTAC,密封容器后,t=60 ℃,n=100 r/min,反应4 h,使用冰醋酸调节溶液至pH=7.0,利用乙醇/乙醚洗脱液获取沉淀,并清洗3次,干燥后溶于30 mL纯水中,装入截留分子质量为10 kDa的透析袋内透析24 h,期间换水3次,冷冻干燥去除溶液中的水分获得阳离子双亲淀粉包材。
将制备的包材溶于d6-DMSO中,除杂后装入核磁管内,利用核磁共振波谱仪对样品的核磁共振氢谱进行分析。以可溶性淀粉、MA和GTAC为对照品。细胞毒性主要通过CCK-8法进行检测,将HUVECs、IMR90和3T3-L1细胞按照8 000个细胞/孔的密度种于96孔板上,在φ(CO2)=5%,t=37 ℃下培养24 h,加入不同浓度的阳离子双亲性包材,再继续培养至对照孔细胞密度超过90%,向所有孔内加入V(CCK-8)∶V(培养基)=1∶10的显色培养液,孵育2 h,利用酶标仪测定各个孔在450 nm波长的吸光值,并计算细胞存活率。
1.3 U0126纳米药物载体的构建及表征
精确称取10 mg U0126和40 mg阳离子双亲淀粉包材,混溶于5 mL DMSO中,超声助溶后将混合DMSO溶液逐滴加入到12 mL水中,滴加过程中水溶液持续搅拌,n=1 500 r/min,滴加完成后继续搅拌10 min即可获得U0126纳米药物载体分散液。将制备的U0126纳米药物载体分散液通过截留分子质量为10 kDa的透析袋透析24 h以去除溶剂和可溶性杂质,期间换水3次。
利用马尔文粒度仪对U0126纳米药物载体的粒径及Zeta电势进行分析。将U0126纳米药物载体分散液滴在超薄碳膜铜网上,静置15 min,吸去表面液体,待铜网干燥后,进行TEM观察。量取20 mL U0126纳米药物载体分散液,通过冷冻干燥除去水分,加入DMSO溶解残渣中的U0126,利用HPLC检测浓度,计算包裹率及载药量。
将2 mL U0126纳米药物载体分散液加入到4 mL磷酸盐缓冲液(PBS)中,t=4 ℃,连续7 d检测粒径变化,以评估其在PBS中的稳定性;将2 mL U0126纳米药物载体分散液加入到4 mL细胞培养基中,t=4 ℃,连续7 d检测粒径变化,以评估其胎牛血清中的稳定性;将2 mL U0126纳米药物载体分散液加入到4 mL胎牛血清中,t=37 ℃连续8 h检测粒径变化,以评估其在胎牛血清中的稳定性。体外释放实验首先取36 mL U0126纳米药物载体分散液,以每份3 mL的量分别装入12个截留分子质量为10 kDa的透析袋中进行透析,t=37 ℃,每个时间点取一个透析袋,将袋内的液体吸出,n=8 000 r/min,离心获取沉淀,加入DMSO溶解沉淀中的U0126,利用HPLC检测浓度,计算释放量,最终绘制释放曲线,以相同操作检测U0126 DMSO溶液作为对照。
1.4 体外培养肺动脉血管模型的构建
将大鼠进行安乐死,在解剖镜下小心取出肺动脉,剥离周围组织,利用V(Triton X-100)∶V(PBS)=1∶1 000内皮洗脱液吹洗血管内腔10 s以去除内皮细胞。将血管组织置于含584 mg/LL-谷氨酰胺的DMEM低糖培养基中,在φ(CO2)=5%、t=37 ℃环境下培养24 h,获得体外肺动脉血管内皮损伤模型。正常肺动脉血管组织直接摘取新鲜血管即可。所得的各种血管组织根据实验需求剪成相应的长度。
1.5 体外递送及抗收缩效果检测
利用荧光染料香豆素-6标记纳米药物载体,用于递送效果检测。将去内皮血管组织和正常肺动脉血管组织模型分别灌入荧光标记的纳米药物载体分散液,两头结扎后置于DMEM低糖培养基中,在φ(CO2)=5%、t=37 ℃环境下孵育4 h,用PBS清洗血管3次,用OCT胶包埋,t=-80 ℃冷冻24 h。利用冰冻切片机将血管组织切成厚度为5 μm的切片,利用倒置荧光显微镜进行观察,根据荧光强度判断纳米药物载体进入组织的效果。
抗收缩效果所用的模型为内皮损伤血管组织模型,将处理好的血管剪成长度为2~3 mm的小段,分别置于培养基、含游离U0126的培养基和含U0126纳米药物载体的培养基中进行孵育,2个处理组中c(U0126)均为 10 μmol/L,孵育条件为φ(CO2)=5%,t=37 ℃,pH=7.4,孵育时间24 h,再取1组正常血管作为对照组。将所有组织固定在微血管张力仪上,平衡1.5 h,平衡张力为2 mN,再利用KCl刺激收缩,以判定血管组织可用性,之后加入c(S6c)=10-11~10-7mol/L的激动剂来测定血管张力,并绘制收缩曲线。将与抗收缩实验中同样处理的血管组织进行研磨,提取总蛋白,定量后进行SDS-聚丙烯酰胺凝胶(PAGE)电泳,再将蛋白转至聚偏二氟乙烯膜上,依次孵育抗ETB抗体和标记二抗,进行显色,通过β-actin内参比对,检测ETB的表达情况。
2 结果与讨论
2.1 阳离子双亲淀粉包材的制备及表征
纳米药物载体的诸多功能都需要通过材料来实现,因此包材的性能始终是最为重要环节之一。目前多种材料都被用于纳米载体的制备。作为药物载体材料,生物安全性始终是最为基本的要求。生物大分子具有良好的生物相容性和降解性,被广泛用于纳米材料的制备中。淀粉是世界上最丰富的多糖类物质之一[16],除了作为食品外也被广泛用于医药领域,其中作为纳米药物载体材料的报道非常多[17-21]。但是直接使用淀粉也存在很大的问题,首先该种物质在体内易于被降解,难以达到长循环的效果;其次,由于淀粉是大分子物质,分子量和结构上的差异导致其很难直接构建成较为均一的纳米颗粒。所以,作者针对U0126的特性及后续给药环境,基于淀粉设计合成了一种兼具阳离子性和双亲性的纳米包材。双亲性可以使包材在水环境中通过自组装的方式直接包裹疏水性分子U0126,阳离子性可以使其对抗体内降解从而达到长循环的效果。
通过核磁共振氢谱可以清晰看到阳离子双亲淀粉材料的各个特征峰,结果见图1。

δ图1 阳离子双亲淀粉材料的核磁共振氢谱结果
由图1可知,其中2.51和3.43处的高峰为溶剂d6-DMSO和残余水分的特征峰。a区域为肉豆蔻酸的特征峰,分别为脂肪链末端的甲基氢、脂肪链中部的亚甲基氢和紧邻羰基的亚甲基氢;b处3.12为GTAC的特征峰;4.02~6为淀粉的特征峰。结果表明,肉豆蔻酸与淀粉成功接枝,实现淀粉的双亲性;GTAC成功地使包材阳离子化,一方面使后续制备的纳米载体具有正电性表面,另外使得其亲水端具有更好的水合性。结果与其他文献报道一致[22-23]。
为了保证材料的安全性,通过CCK-8法检测了所制备包材在3种细胞系上的细胞毒性,结果见图2。

ρ/(μg·mL-1)图2 阳离子双亲淀粉材料的细胞毒性实验结果
由图2可知,阳离子双亲淀粉对HUVECs、IMR90及3T3-L1细胞都没有表现出很明显的毒性,在所有设置的浓度下相对细胞存活率都超过90%,证明该材料具有很好的生物安全性。
2.2 U0126纳米药物载体的构建
U0126是ERK1/2的高效抑制剂,但是其水溶性差导致生物利用度低,而高剂量使用又会造成其他脏器的毒性,因此作者通过纳米载体技术来克服该药物存在的不足。阳离子双亲淀粉包材的设计和合成是基于U0126的结构和作用环境完成的。U0126是一个疏水性化合物,其纳米药物载体制备主要通过包材与药物通过疏水作用力进行自组装构建。所构建的U0126药物载体属于纳米胶束, TEM观察结果见图3。

图3 U0126纳米药物载体的TEM观察结果
由图3可知,U0126纳米药物载体呈球状,具有核壳结构,均符合纳米胶束的结构特征。
动态光散射法测得的粒径分布结果见图4。

D/nm图4 U0126纳米药物载体的粒径分布图
由图4可知,其平均粒径为(113±6.9)nm,与TEM观察结果相符。
对所制备的纳米药物载体表面电性进行检测后发现,其表面电势为(23.4±2.8)mV,具有明显的正电性,结果见图5。

U/mV图5 U0126纳米药物载体的Zeta电势结果
由图5可知,U0126纳米药物载体构建成功。
2.3 U0126纳米药物载体的性能表征
利用HPLC测量并计算纳米药物载体中U0126浓度,纳米药物载体的包裹率为(93.8±2.8)%,载药量为(17.4±4.6)%。表明U0126纳米药物载体包载性能良好,可将非水溶性化合物U0126有效分散在水溶液中,大大提高了其生物利用度。
稳定性是纳米载体应用的基础。作者通过将U0126纳米药物载体分散到不同液体环境中,并连续检测其粒径,通过粒径变化评估其稳定性。U0126纳米药物载体在PBS中7 d的粒径变化趋势见图6。
由图6可知,粒径变化小于10%,稳定性良好。

t/d图6 U0126纳米药物载体在PBS中的稳定性
U0126纳米药物载体后续的递送和抗收缩实验需要在培养基中完成,检测其在完全培养基内的稳定性,结果见图7。

t/d图7 U0126纳米药物载体在培养基中的稳定性
由图7可知,7 d内纳米载体的粒径变化很小,表现出非常好的稳定性。然而从结果中发现,在培养基中U0126纳米药物载体的粒径比在PBS中略大,其原因可能是纳米颗粒表面带正电,吸附了培养基中的蛋白质导致的。
U0126纳米药物载体的体内最终作用环境应该是血液中,因此为了保证其具有体内可用性,将制备获得的纳米载体分散在血清中,进一步进行粒径检测,结果见图8。

t/h图8 U0126纳米药物载体在血清中的稳定性
由图8可知,在生理环境下U0126纳米药物载体表现出了非常好的稳定性,8 h内粒径变化非常小。此外,该实验中纳米载体的粒径进一步增大,其原因同样来自于表面吸附的蛋白质,血清中的游离蛋白多于培养基中,故而其吸附层的厚度将会更大,该吸附层在体内可以保持纳米载体的稳定性,另外还能防止其被清理,更加提高了所携带药物的生物利用度。
通过透析法检测U0126纳米药物载体的体外释放性能,0~72 h共设置12个时间点。由于U0126为非水溶性,因此需要检测透析袋内沉淀中的U0126含量,并计算绘制释放曲线,结果见图9。

t/h图9 U0126纳米药物载体体外释放实验结果
由图9可知,游离U0126在最初的1 h内即沉淀了90%,4 h后即达到平衡,不存在稳定释放现象。相比之下,U0126纳米药物载体则可稳步缓慢地释放携带的药物,直至72 h仍有60%的药物包封于载体内部。由此可知,纳米药物载体给U0126提供了一个稳定的疏水内核,使得整个释放过程稳定而持久,表明其在体内使用过程中可以使血中的药物一直维持在一个较高的水平,达到缓释的效果。
2.4 U0126纳米药物载体的递送性能
U0126纳米药物载体的递送通过在血管组织内的积累来进行观察。为此首先用具有绿色荧光的香豆素-6标记了纳米载体,然后建立体外肺动脉血管培养模型,该模型进行了内皮消解,以模拟内皮损伤状态。将荧光标记的纳米药物载体注入新鲜的正常血管和培养的模型血管内部,共孵育后进行冰冻切片,通过荧光显微镜观察,结果见图10。
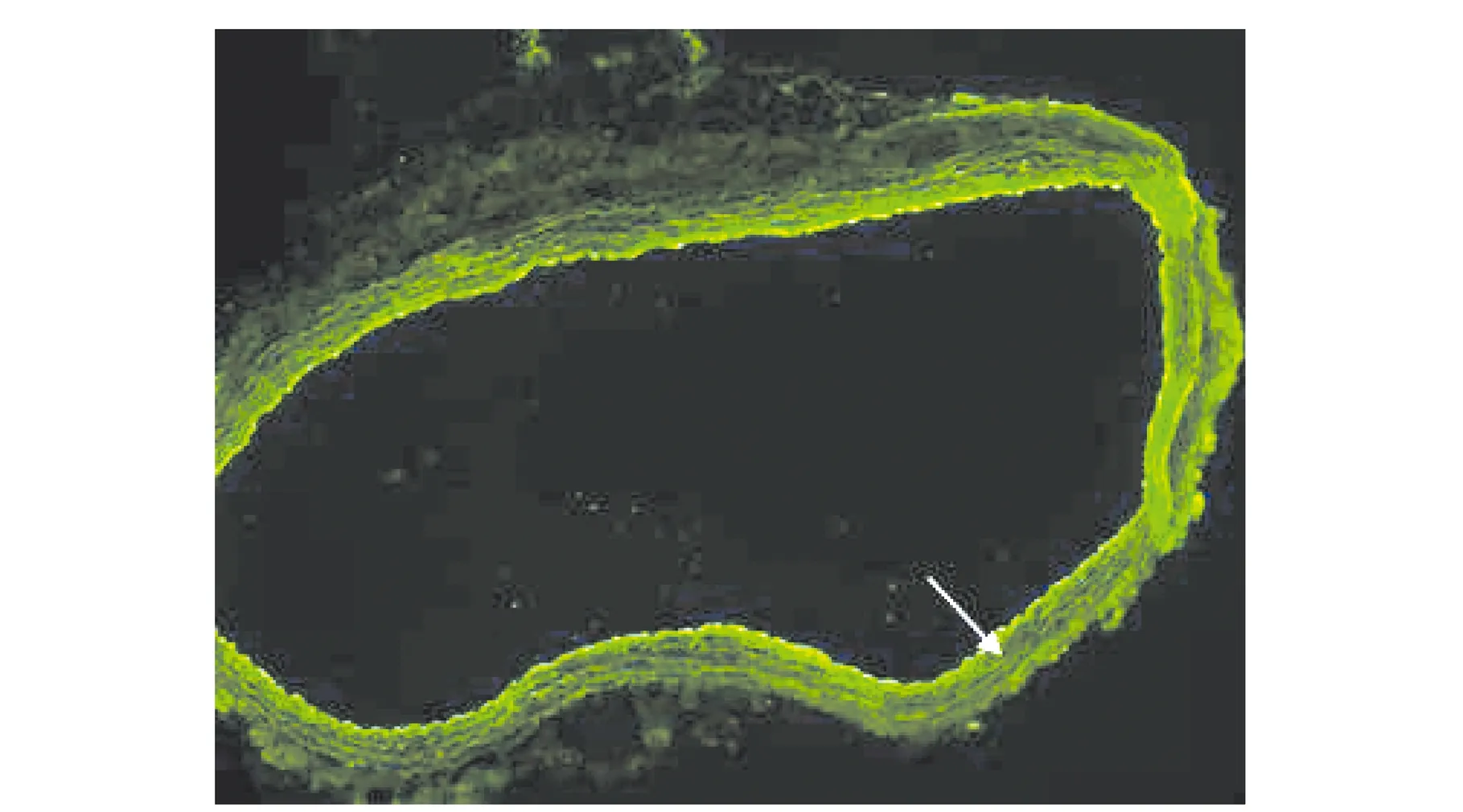
图10 U0126纳米药物载体在正常血管内的积累
由图10可知,内层内皮细胞结构完整,可以看到除了内皮层以外,血管壁内部荧光信号较低,部分区域只能看到弹力纤维的自发荧光。该结果说明,纳米药物载体无法快速的穿过内皮细胞进入血管壁组织深处。
内皮损伤模型血管的成像结果见图11。

图11 U0126纳米药物载体在模拟内皮损伤血管内的积累
由图11可知,血管内侧荧光信号不连贯,表明内皮层被破坏,部分区域为缺损状态。血管壁内平滑肌层的荧光信号显著增高,荧光信号积累程度远高于正常血管组织,大部分区域都超过了弹力纤维的自发荧光。该结果表明,U0126纳米药物载体可有效进入受损的血管壁,并在其内部大量积累。
2.5 U0126纳米药物载体的抗收缩效果
通过微血管张力仪来检测U0126纳米药物载体在体外肺动脉血管培养模型上的抗收缩效果,该技术已广泛应用于血管收缩和舒张方面的研究[24-25]。U0126纳米药物载体、游离U0126与肺动脉血管内皮损伤模型共孵育后,通过微血管张力仪检测其在不同浓度ETB受体激动剂S6c作用下的收缩效果,并绘制出K+收缩率曲线,结果见图12。

log c图12 体外抗收缩效果
由图12可知,未加任何干预的去内皮血管收缩性最强,约为K+收缩效果的50%,U0126可明显降低血管的收缩,其收缩效率约为K+的20%,而U0126纳米药物载体干预组的收缩率则更小,与游离U0126具有显著性差异。该结果表明纳米药物载体可更为有效地使药物进入受损的血管平滑肌细胞层,进而起到抑制收缩的效果。
正常血管平滑肌细胞的ETB受体均表达较少,而在病理状态下,ERK1/2信号通路介导合成新的ETB受体,导致血管平滑肌细胞收缩增强[6-7]。U0126通过抑制ERK1/2通路进而逆转ETB受体在平滑肌细胞中的过表达,以起到治疗效果。为进一步证明抗收缩效果是源自U0126对ETB受体高表达的抑制,通过western blotting检测了各组中ETB受体的表达情况,结果见图13。

图13 ETB受体蛋白在不同处理组织中的表达水平
由图13可知,正常血管中ETB受体表达量非常少,而非处理组的肺动脉血管损伤模型血管中ETB受体表达量显著增高。而经过游离U0126和U0126 纳米药物载体处理的血管中ETB受体表达量均有下降,值得注意的是U0126纳米药物载体组显著低于游离U0126,该结果与前面收缩实验结果相吻合,充分证明了U0126纳米药物载体能更好抑制ETB受体表达,从而起到抗血管收缩的效果。
3 结 论
作者将纳米药物载体技术应用于肺动脉高压治疗研究中,并取得了有效的结果。通过对可溶性淀粉接枝肉豆蔻酸使其获得双亲性,再利用GTAC对接枝淀粉进行阳离子化,最终获得了一种安全低毒的阳离子双亲淀粉包材,该包材通过疏水自组装法可有效包封非水溶性化合物U0126,获得的纳米药物载体具有良好的包载能力,可靠的稳定性及缓释功能,极大地提高U0126的生物利用度。在体外肺动脉血管培养模型中检测发现U0126纳米药物载体可显著积累至损伤的动脉血管壁内部,而在正常血管中积累较少,能大大提高药物的抗收缩效果,通过抗收缩机制的研究最终进一步确定了该纳米药物载体是通过抑制ERK1/2通路来逆转ETB受体过表达来实现抗血管收缩效果,为开发PAH治疗的新方法提供了科学依据。
