白酒和黄酒中生物胺的高效液相色谱分析法
2020-09-03刘慧琳唐佳琪
刘慧琳 赵 源 张 瑛 唐佳琪 王 静
(北京食品营养与人类健康高精尖创新中心 北京市食品添加剂工程技术研究中心北京工商大学 北京100048)
黄酒属于酿造酒,酒度一般为15°左右,在世界三大酿造酒(黄酒、葡萄酒和啤酒)中占有重要的一席。 它是以稻米、黍米、黑米、玉米、小麦等为原料,经过蒸料,拌以麦曲、米曲或酒药,进行糖化和发酵酿制而成。 黄酒含有丰富的营养,有“液体蛋糕”之称,它含有众多生物活性成分,如酚类物质和谷胱甘肽等,能够对人体起到清除自由基,延缓衰老,抑制肿瘤等的生理作用。白酒是中国的国酒, 有着2 000 多年的历史, 是一种酒精含量在38%~65%之间的澄清、 透明的发酵酒精饮料,通常由高粱或玉米、大米、小麦、豌豆、小米和高粱混合制成。白酒是一种著名的蒸馏酒,其生产工艺不同于其它蒸馏酒, 它结合了两种独特的发酵和蒸馏过程,即在发酵过程中,淀粉转化为糖与糖转化为酒精两个过程是同时进行的。 白酒中含有丰富的风味成分,包括有机酸、酯、内酯、酚类、杂环、萜类和芳香族化合物。此外,白酒还含有氨基酸和多肽等对人体有益的潜在功能成分[1]。
酒中富含氨基酸, 而氨基酸是生物胺的前体物[2]。 发酵过程复杂且难以控制,易产生潜在有害物质——生物胺[3]。生物胺(Biogenic amine,BA)是在酒和发酵食品中经常检测到的一类具有生物活性、低分子质量的含氮化合物,对人体有不利影响[4-6]。 氨基酸含量被认为是葡萄酒酿造过程中生物胺形成的主要原因[7]。食品中常见的生物胺主要有:组胺、色胺等杂环胺,酪胺、苯乙胺等芳香族胺,腐胺、尸胺、精胺、亚精胺等脂肪族胺。其中,组胺和酪胺是食品中对人体影响最大的两种生物胺,分别由组氨酸和酪氨酸脱羧形成[8-9]。 适度摄入生物胺对人体健康起到促进作用, 而摄入过量生物胺在人体蓄积会引起许多不适症状,如头疼、呕吐等[10]。 过量摄入酪胺还会引起边缘血管收缩,导致机体心律变快、呼吸增强,同时降低体内去甲肾上腺素水平含量[11]。超过100 mg 会引起偏头痛,超过1 080 mg 会引起严重中毒[12]。 组胺的过量摄入会增加肾上腺素和去甲肾上腺素的释放, 并刺激运动神经和感觉神经,引起过敏和高血压[13]。 组胺是葡萄酒中常见的一种生物胺, 不同国家对其限定标准各不相同,其中以德国标准最为严格,规定不得高于2 mg/L[14]。 欧盟规定食品中组胺含量不得超过100 mg/kg[11], 酪胺含量不得超过100~800 mg/kg[15]。
目前,酒中生物胺含量的检测方法有多种,如毛细管电泳法(Capillary electrophoresis,CE)[16]、高效液相色谱法 (High performance liquid chromatography,HPLC)[17]、生物传感器法(Biosensor method)[18]、薄层色谱法(Thin layer chromatography,TLC)[19]等。 其中HPLC 法实际应用最为广泛。HPLC 仪能够同时分析多个目标物,分析速度快且准确性高,因而在生物胺的检测中应用最多。由于生物胺没有共轭特征结构, 在紫外检测器上响应较弱,所以对其进行柱前衍生,使其产生紫外和荧光吸收。 常用的衍生试剂主要有邻苯二醛(OPA)、丹磺酰氯(Dns-Cl)、二硝基苯甲酰氯(DABS-Cl)、苯甲酰氯(Benzoyl chloride)。 丹磺酰氯是最为常用的衍生试剂,其衍生物相对稳定,在避光条件下可稳定存放12~14 h[20-21]。 试验中通过丹磺酰氯-柱前衍生-HPLC 法对黄酒与白酒中生物胺进行检测与比较。
1 材料与方法
1.1 材料与试剂
山西代县黄酒与内蒙草原王白酒系列均来自于当地企业;9 种生物胺标准品(纯度均>98%):色胺(CAS 号:61-54-1)、β-苯乙胺(CAS 号:64-04-0)、腐胺(CAS 号:110-60-1)、尸胺(CAS 号:462-94-2)、 盐酸吡哆胺 (CAS 号:524-36-7)、 组胺(CAS 号:51-45-6)、酪胺(CAS 号:51-67-2)、亚精胺(CAS 号:124-20-9)、精胺(CAS 号:71-44-3),上海源叶生物科技有限公司;丹磺酰氯(CAS号:605-65-2),上海麦克林生化科技有限公司;饱和碳酸氢钠、氯化钠、甲酸、正丁醇,西陇化工股份有限公司;乙酸铵,北京迈瑞达科技有限公司;乙腈(色谱纯),赛默飞世尔科技有限公司;丙酮(分析纯)、三氯甲烷(分析纯),北京化工厂;乙醚(分析纯),国药集团化学试剂有限公司。
1.2 仪器、设备
LC-20AT HPLC 仪,日本岛津公司;MX-F 涡旋振荡器, 大龙兴创实验仪器有限公司;UGC-24M 氮吹仪, 北京优晟联合科技有限公司;VELOCITY 18R 大容量冷冻离心机, 澳大利亚Dynamica 公司;实验室pH 计,奥豪斯仪器(上海)有限公司;恒温水浴锅,山东甄城华鲁电热仪器有限公司;Water Pro 超纯水系统, 美国Labconco 公司;ME104/02 电子分析天平,梅特勒-托利多仪器(上海)有限公司;0.22 μm 滤膜针头滤器,天津市津腾实验设备有限公司。
1.3 方法
1.3.1 标准溶液的配制 准确称取标准品,以0.1 mol/L 稀盐酸为溶剂,配制质量浓度为1 000 mg/L的生物胺单体标准储备溶液。 准确量取不同体积的储备液,稀释,配制成终质量浓度分别为50.00,25.00,5.00,1.00,0.50,0.25,0.20,0.10,0.05 mg/L 的梯度标准溶液。 以上所配溶液于4 ℃冰箱避光存放,保存期为2 周。
1.3.2 样品的萃取与衍生 量取酒样10.00 mL,向其中加入适量氯化钠至饱和。 准确量取上层试样5.00 mL,置于15 mL 离心管中,逐滴加入4~7滴5 mol/L 氢氧化钠溶液,将溶液pH 值调至11.5~12.0 范围。 加入正丁醇-三氯甲烷(体积比1 ∶1)混合溶液5.0 mL, 充分均匀混合后4 000 r/min 离心10 min。 吸取并保留上层有机相,重复操作两次,合并提取液。 取3.0 mL 提取液, 加入0.2 mL 1 mol/L 盐酸, 充分混合后吸取2 mL 溶液, 在40℃条件下氮气吹干,然后加入1.0 mL 0.1 mol/L 盐酸,充分溶解提取物,待衍生。
将上述提取液(1 mL)置于15 mL 塑料离心管中,依次加入1 mL 饱和碳酸氢钠溶液、100 μL 氢氧化钠溶液 (1 mol/L)、1 mL 丹磺酰氯衍生试剂(10 mg/mL 丙酮为溶剂),涡旋振荡60 s 后置于60℃水浴环境中衍生,15 min 后取出, 加入100 μL谷氨酸钠溶液(50 mg/mL 饱和碳酸氢钠为溶剂)终止衍生。 将上述混合物振荡混匀后,在60 ℃条件下继续反应15 min,取出冷却至室温,向其中加入1 mL 超纯水,旋涡振荡1 min 后混匀,置于40℃低温水浴环境下氮吹除去有机溶剂(约1 mL),加入0.5 g 氯化钠, 待溶解后继续加入5 mL 有机溶剂乙醚,振荡2 min 后静置分层。 将上层有机层转移至15 mL 玻璃试管中,水相(下层)再次萃取。将两次萃取液合并后氮气吹干, 加入复溶液乙腈1 mL,完全溶解后经0.22 μm 针头滤器过滤,冷藏待测。
1.3.3 色谱条件 采用赛默飞Hypersil GOLD C18色谱柱(250 mm×4.6 mm, 5 μm)分离,紫外检测波长254 nm,进样体积20 μL,柱温35 ℃,流动相A 为0.01 mol/L 乙酸铵溶液(含0.1%乙酸)-乙腈(9 ∶1,V/V),流动相B 为乙腈-0.01 mol/L 乙酸铵溶液(9∶1,V/V),流速0.8 mL/min。 见表1 梯度洗脱程序1。

表1 梯度洗脱程序Table 1 Gradient elution program
2 结果与分析
2.1 优化的衍生试剂含量
选择丹磺酰氯作为衍生剂, 其添加量优化结果见图1。 在丹磺酰氯添加量5~10 mg/mL 范围,随着添加量的增加,各生物胺的峰面积增加;当丹磺酰氯添加量大于等于10 mg/mL 时,各生物胺峰面积不再随其添加量的增加而增加, 基本保持不变,表明所衍生的生物胺达到饱和状态。 选取10 mg/mL 的丹磺酰氯溶液作为本试验的衍生试剂。

图1 Dns-Cl 添加量的优化Fig.1 Optimization of the content of Dns-Cl
2.2 优化的色谱条件
比较Thermo Hypersil GOLD C18 柱 (柱长250 mm,柱内径4.6 mm,柱填料粒径5 μm)与岛津Inertsil ODS-4 C18 柱(柱长150 mm,柱内径4.6 mm,柱填料粒径5 μm)对各生物胺的分离效果。 经250 mm 色谱柱分离后,9 种生物胺在37 min 内彼此分离且峰形对称。 经150 mm 色谱柱分离后,37 min 内色谱图中只有8 种生物胺的流出峰,无法在37 min 内分离9 种生物胺。
2.3 优化的洗脱条件
流动相A 与B 的比例见表1。 通过不断调整流动相A 与B 的含量,得到最优洗脱程序方案2。采用方案2 对9 种生物胺混标溶液进行洗脱分离,各生物胺流出峰彼此分离效果较好。
2.4 优化的试验方案
比较萃取处理对生物胺含量检测的影响。 方案1 直接对生物胺衍生, 而方案2 在对生物胺衍生之前进行萃取富集处理。选取尸胺、盐酸吡哆胺与β-苯乙胺3 种生物胺,比较萃取处理对生物胺检测效果的影响,结果见表2。 分析可知,对生物胺萃取处理后再衍生,生物胺损失程度减小,在样品复杂的基质中对生物胺的检测效果更佳, 这说明对样品进行萃取、净化的重要性。
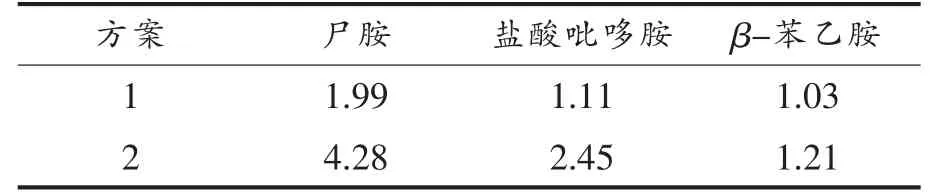
表2 试验方案的优化(mg/L)Table 2 Optimization of the test plan (mg/L)
2.5 线性关系与检出限
按照所建立的方法, 将配制好的梯度系列标准溶液(50.00,25.00,5.00,1.00,0.50,0.25,0.20,0.10,0.05 mg/L)进行线性试验。 对标准溶液浓度(X)对其峰面积(Y)进行回归方程线性拟合,通过R2进行相关性评价。 9 种生物胺的检出限(LOD)与定量限(LOQ)通过3 倍信噪比(S/N=3)与10 倍信噪比(S/N=10)计算,结果见表3。 优化的色谱条件程序洗脱后, 混标中各生物胺色谱峰图如图1所示, 各生物胺加标黄酒样品中的色谱峰图如图2 所示。
由表3 可知,9 种生物胺在0.5~50 mg/L 质量浓度范围,该方法具有良好的线性关系,相关系数R2均大于0.998。 检出限范围0.07~0.22 mg/L,定量限范围0.07~0.73 mg/L。分析图1 与图2 后发现37 min 洗脱与分离后,9 种混合生物胺色谱峰先后流出,被成功分离。
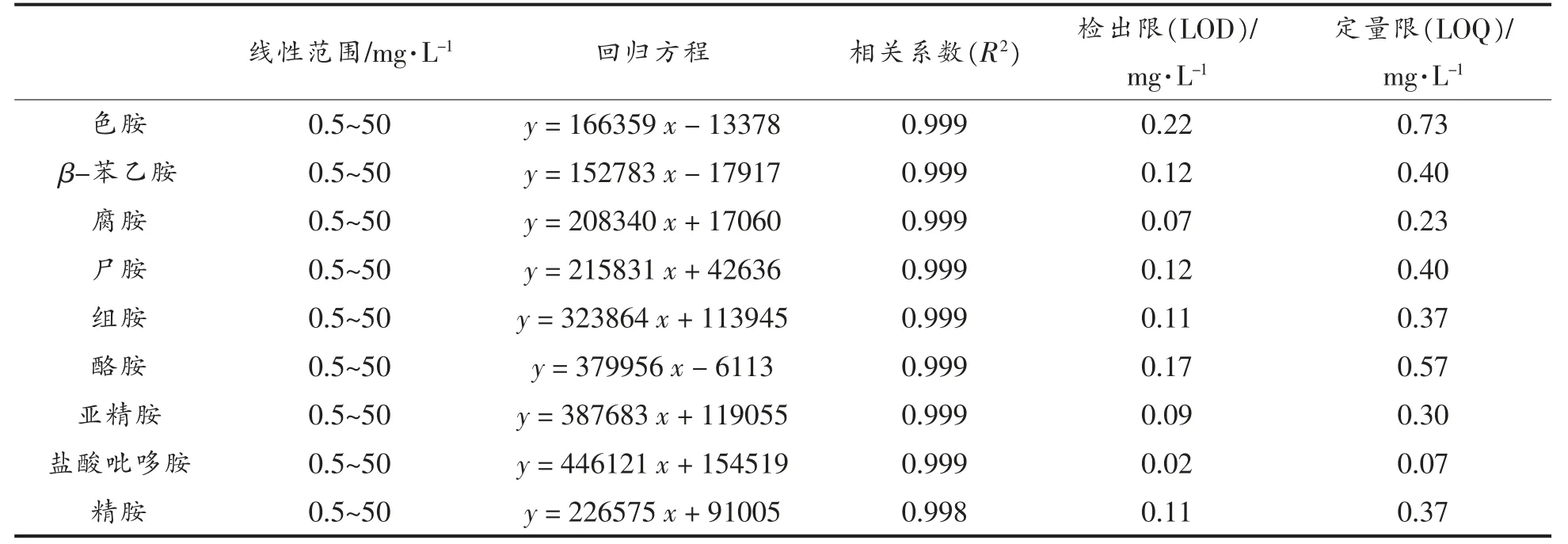
表3 9 种生物胺的线性范围、回归方程、相关系数、检出限与定量限Table 3 The linear range, regression equations, and correlation coefficient, LOD and LOQ of 9 biogenic amines

图2 9 种生物胺标准品的液相色谱图(10.0 mg/L)Fig.2 HPLC chromatogram of 9 kinds of biogenic amine standards(10.0 mg/L)
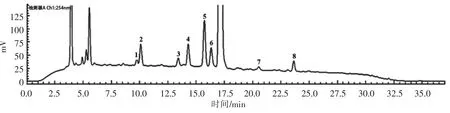
图3 黄酒样品中生物胺的色谱图Fig.3 HPLC chromatogram of biogenic amines in Chinese yellow wine sample
2.6 加标回收
选取3 种生物胺做加标回收试验, 向黄酒样品中加入3 种浓度水平的混合标准溶液, 加标量分别为1.0,5.0,10.0 mg/L,其浓度均在线性范围。用所建立的方法进行前处理与测定, 各加标水平样品平行测定3 份,结果见表4。 3 种生物胺加标回收率在83.30%~114.70%之间, 相对标准偏差(RSD)均低于4.56%,说明该方法对生物胺的检测结果较为准确,重复性好。

表4 中国黄酒中3 种生物胺的加标回收率Table 4 Recoveries of three kinds of biogenic amines spiked in Chinese yellow wine sample
2.7 实际样品分析
用所建立的方法分析黄酒与白酒中生物胺含量,结果见表5 和表6。由表5 可知,黄酒中含有8种生物胺,总含量为29.39 mg/L,各生物胺含量均有差异。 色胺与尸胺为该黄酒样品中的主要生物胺,含量分别为(18.06 ± 0.012)mg/L 与(4.28 ±0.059)mg/L,β-苯乙胺含量为(1.21±0.021)mg/L,腐胺含量为(2.15±0.002)mg/L,盐酸吡哆胺含量为(2.45±0.028)mg/L,组胺含量为(0.40±0.049)mg/L,酪胺含量为(0.75 ± 0.003)mg/L,亚精胺含量为(0.09±0.003)mg/L,精胺未检出。 白酒检测结果见表6。 白酒中生物胺总含量在3.83~7.94 mg/L 之间,其中组胺在4 种白酒中被检出,精胺只在一种白酒中检出, 其余7 种生物胺在5 种白酒中均被检出。 比较黄酒与白酒中各生物胺含量可以发现,黄酒中的生物胺总含量高于白酒。这与之前研究报道[20-21]一致。 虽然二者均采用酿造工艺,但是后期工艺不同,黄酒无需蒸馏处理,而白酒需蒸馏处理, 蒸馏后酒体中生物胺含量大大减少。 另外, 催化氨基酸脱羧转变成生物胺的脱羧酶, 在pH 4.04~4.33 的黄酒酿造过程中被诱导合成,导致黄酒中生物胺含量相对较多。

表6 白酒中生物胺含量Table 6 Biogenic amine contents in Baijiu
3 结论
采用HPLC-紫外检测法,丹磺酰氯柱前衍生梯度分离洗脱黄酒与白酒中的生物胺, 在37 min内实现了两种酒体中9 种生物胺的分离。 比较分析黄酒与白酒中生物胺含量, 结果该方法准确性好,可快速检测9 种生物胺含量。
