pH对百子莲体胚诱导期生理特性的影响
2020-08-30岳建华李文杨
岳建华,董 艳,李文杨,李 蒙,张 琰,*
(1.信阳农林学院 园艺学院,河南 信阳 464100; 2.信阳市大别山区园艺植物遗传改良重点实验室,河南 信阳 464100; 3.信阳农林学院 林学院,河南 信阳 464100)
百子莲(Agapanthuspraecox)又称蓝百合,百子莲科(Agapanthaceae)百子莲属(Agapanthus)多年生草本花卉,原产南非,可作鲜切花、盆花、花境和园林地被应用[1]。百子莲观赏价值高,抗逆性强,目前在上海已大量应用,我国中部地区也在逐步推广。但由于其生长缓慢,播种、分株等繁殖方式难以满足产业化生产需求。体细胞胚胎发生是一种高效的离体再生途径,培养基的激素[2]、碳源[3]、pH[4]等通过影响离体培养条件下外植体的激素代谢、糖代谢、胁迫信号等来调节细胞分裂、生长与分化,影响体胚诱导和发育[4-6]。目前,培养基激素、碳源的研究报道较多,毒莠定(picloram,PIC)特异性调控单子叶植物离体细胞胚性启动[7],已被证实为调控百子莲体胚发生的关键激素类物质[8-10];质量体积分数2%~3%的蔗糖可为体胚发生提供合适的能量和渗透压,维持细胞膜的稳定性[2],可应用于百子莲体胚诱导[8]。目前,一般将诱导百子莲体胚发生的培养基pH在灭菌前调至5.6~5.8[8,11]。
激素、糖代谢和胁迫信号在植物体胚发生过程中发挥关键作用[12-13]。PIC对百子莲愈伤组织、胚性愈伤组织诱导和胚性能力的保持均有重要影响[9],可显著影响吲哚乙酸(indole acetic acid,IAA)含量[10],而IAA通过影响细胞极性建立胚性[5]。赤霉素(gibberellin,GA)、脱落酸(abscisic acid,ABA)、细胞分裂素(cytokinin,CTK)等显著调控体胚发生效果[2,14-15],油菜素甾醇(brassinosteroid,BR)、乙烯(ethylene)、茉莉酸(jasmonate,JA)等对体胚发生进程也具有重要影响[16]。不同植物、不同离体培养阶段对碳源的需求不同,糖组分显著影响体胚发生效率[17]。例如挪威云杉(Piceaabies)体胚发生过程中,在体胚成熟、干燥阶段对蔗糖的需求量极大,在体胚成熟发育中期对淀粉含量需求较高[17]。植物体胚发生过程中的胁迫信号主要通过活性氧(reactive oxygen species,ROS)表达,包括羟自由基(·OH)和过氧化氢(H2O2)等[6,18]。合理强度的ROS可促进细胞脱分化和体胚形成[6],提高H2O2含量可促进体胚发生[19]。植物细胞中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和过氧化物酶(peroxidase,POD)可清除ROS,维持胞内生理平衡[5-6,18]。抗氧化酶活性直接影响植物细胞脱分化和再分化的相关生理过程,例如宁夏枸杞(Lyciumbarbarum)SOD活性上升,可促进胚性细胞的分化和早期胚胎发育[19]。
植物离体培养过程中,pH通过维持植物细胞生理代谢所需的弱酸性环境,影响激素含量、糖积累、ROS积累和抗氧化酶活性,以上因素对体胚发生的调控非常重要[5,18,20],但pH对以上生理特性的调控效果却鲜有报道,在百子莲的研究中尚属空白。本文拟研究不同pH处理下百子莲体胚诱导效果,并初步揭示不同pH下百子莲体胚内源激素、糖类、活性氧和保护酶类的变化规律及其对体胚诱导效率的影响,丰富植物体胚发生理论。
1 材料与方法
1.1 试材
百子莲购自南京市彩虹花卉公司,栽植于信阳农林学院校内实验基地。2017年5~6月,选取5年生植株未开裂的小花苞,切取小花梗作为外植体进行愈伤组织诱导,诱导方法参照文献[21]。愈伤组织每月继代1次,7~9个月后,得到单细胞起源的胚性愈伤组织,继代6个月后用于试验研究。选取状态一致、生长旺盛、颜色鲜黄、结构疏松的胚性愈伤组织进行体胚幼胚(young somatic embryo,YSE)诱导,以YSE为试材进行体胚成熟胚(mature somatic embryo,MSE)诱导。
1.2 培养基配制与接种
在YSE、MSE诱导阶段,将培养基pH分别调至5.6、5.8、6.0、6.2。幼胚诱导培养基为MS+30.0 g·L-1蔗糖+7.0 g·L-1琼脂,成熟胚发育培养基为MS+20.0 g·L-1蔗糖+6.0 g·L-1琼脂。培养基配置方法:称取MS干粉(Phytotech Lab M519)4.43 g·L-1,超纯水溶解后加蔗糖,充分混匀,1 mol·L-1NaOH溶液调至目标pH,加琼脂,121 ℃高压灭菌25 min,冷却至60 ℃左右于超净工作台内分装至90 mm × 16 mm玻璃培养皿,每皿倒25 mL左右,冷却至室温后接种。
1.3 培养条件
每皿培养基接种1.0 g材料,分为大小基本相同的9份,按3×3分布方式摆放至平板培养基中,每处理接种5皿,设3次重复。培养室温度(25±2)℃,相对湿度65%左右,暗培养7 d后,转至光周期14 h/10 h(L/D)下培养,光量子通量密度为50 μmoL·m-2·s-1。
1.4 观察与计数
培养30 d后,统计体胚数量。YSE诱导阶段,统计形态完整、尺寸大于1 mm的不透明状胚胎数量。诱导的YSE转接至MSE诱导培养基,30 d后统计数量,该阶段统计具有明显胚芽和胚根结构、形态学上端为绿色、整体长度大于5 mm的胚数量。
1.5 生理指标测定
采用酶联免疫吸附法(ELISA)测定激素、糖类、活性氧与保护酶等生理指标,委托上海酶联生物科技有限公司参照Pradko等[22]的方法进行测定。方法如下:称取1.0 g鲜样,加2 mL样品提取液,冰浴匀浆,转入10 mL试管;4 ℃提取上清液,过C-18固相萃取柱;转入5 mL离心管,真空冷冻干燥,样品稀释液定容;加标样和待测样,取标样稀释为梯度浓度(含0 ng·mL-1),将标样和待测样加入96孔酶标板,每孔50 μL,待测样设3次生物学重复;加一抗,将酶标板置入湿盒内,37 ℃ 30 min后洗板,洗涤4次;加二抗,放入湿盒内,置于37 ℃ 30 min;洗板后加底物显色,每孔加50 μL 2 mol·L-1硫酸终止反应;用酶标仪测定标样和样品490 nm处的吸光度D490,根据标准曲线计算样品含量或酶活性。
1.6 数据分析
用Excel 2016、GraphPad Prism 5、Adobe Photoshop进行数据整理和作图,用IBM SPSS Statistics 20进行显著性检验(LSD法,P<0.05)。
2 结果与分析
2.1 pH对体胚诱导效果的影响
由图1可知,pH对百子莲体胚诱导效果有显著影响。不同pH处理下YSE诱导数量具有显著差异,培养基pH 6.0利于YSE诱导,诱导数量约为每皿46个,比pH 5.6、pH 5.8和pH 6.2分别增加21.05%、17.20%和138.96%,差异显著(P<0.05)(图1-A)。如图1-B所示,随着pH(5.6~6.2)的升高,MSE数量逐渐增加。pH 6.2处理下,MSE数量可达每皿75个,比pH 5.6、pH 5.8和pH 6.0分别增加135.79%、40.88%和36.59%。综上,YSE诱导和MSE诱导阶段,较佳的pH分别为6.0和6.2。
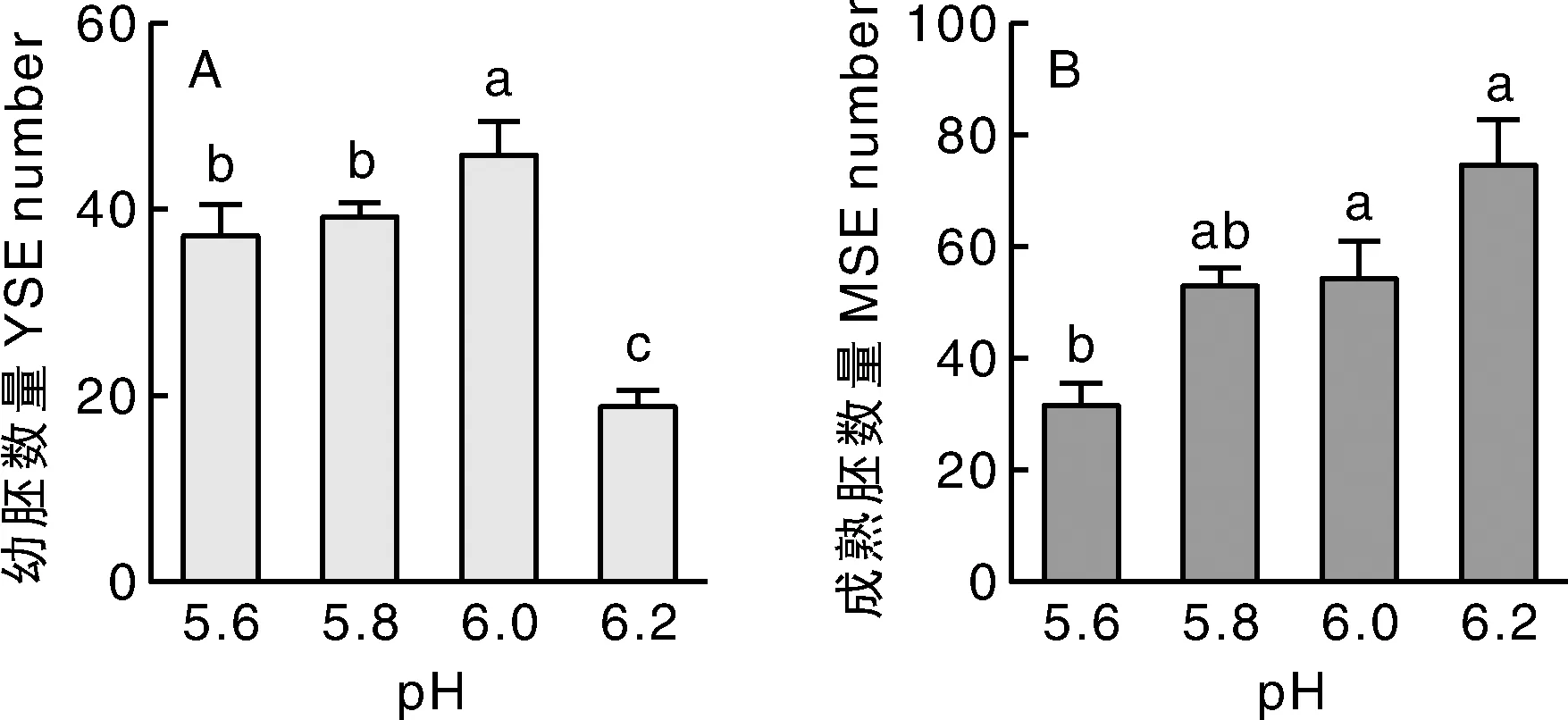
n=3,柱上无相同小写字母表示差异显著(P<0.05)。下同。n=3. Data on the bars marked without the same lowercase letter indicated significant differences at P<0.05. The same as below.图1 pH对体胚诱导效果的影响Fig.1 Effects of pH on somatic embryo induction
2.2 pH对体胚诱导内源激素的影响
体胚诱导阶段,pH对激素含量具有显著影响(图2)。与MSE阶段相比,不同pH处理下YSE诱导阶段内源IAA含量相对较高,且在pH 6.0处理下达到最高,比pH 6.2处理增加25.31%,差异显著(P<0.05)(图2-A)。结合态IAA(binding IAA)含量受pH的影响较大,且与体胚诱导数量变化趋势不一致(图2-B)。IAA氧化酶活性与成熟胚数量变化规律一致,YSE阶段在pH 6.0处理下IAA氧化酶活性较强,MSE阶段在pH 6.2处理下IAA氧化酶活性较强(图2-C)。GA含量在体胚诱导过程中变化显著,尤其是GA4含量。YSE阶段在pH 5.8处理中GA4含量较高;成熟胚阶段在pH 6.2处理中GA4含量最高,分别比pH 5.6、pH 5.8和pH 6.0增加26.44%、18.63%和28.39%,差异显著(P<0.05)。YSE阶段的GA1含量显著高于MSE阶段,YSE阶段在pH 6.0处理中GA1、GA3含量最低,MSE阶段在pH 6.2处理中GA1、GA3含量相对较低(图2-E、F)。YSE阶段在pH 5.8处理下BR含量显著低于其他处理,MSE阶段在pH 5.8和pH 6.0处理下BR含量显著低于其他处理。相同pH处理下YSE阶段的CTK含量普遍高于MSE阶段,pH 5.6处理下YSE阶段和MSE阶段的CTK含量高于其他处理,其他处理间差异不显著(P>0.05)。YSE阶段和MSE阶段不同处理的乙烯含量差异均不显著(P>0.05),表明百子莲体胚中乙烯含量受pH影响较小。ABA含量受pH的影响较大,YSE阶段和MSE阶段分别在pH 6.0和pH 6.2处理中含量最高,且与体胚发生效率较为一致。YSE阶段和MSE阶段的JA含量均在pH 6.0处理中最低(图2-L)。
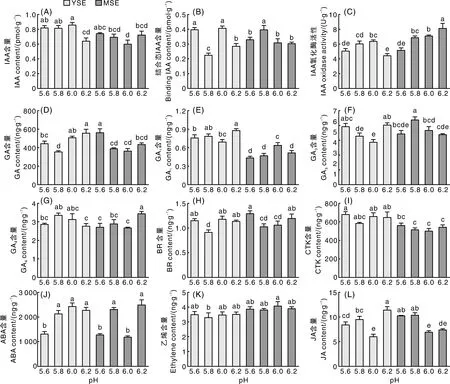
图2 pH对体胚诱导期内源激素的影响Fig.2 Effects of pH on endogenous hormone in somatic embryo induction stage
2.3 pH对体胚诱导糖代谢的影响
图3-A所示,YSE阶段pH 6.0处理的淀粉含量比pH 5.6和pH 5.8处理分别显著(P<0.05)增加26.48%和16.57%,pH 6.0处理的总糖含量也较高,比pH 5.6、pH 5.8和pH 6.2处理分别显著增加26.37%、25.95%和27.20%(P<0.05),而MSE阶段,总糖含量随pH升高而降低(图3-B)。pH对蔗糖含量的影响显著,YSE阶段pH 6.0处理的蔗糖含量显著高于其他处理,比pH 5.6、pH 5.8和pH 6.2处理分别显著增加22.36%、41.57%和17.19%(P<0.05);MSE阶段蔗糖含量随pH升高而升高,pH 6.2处理的蔗糖含量最高,比pH 5.6和pH 5.8分别显著增加36.78%和29.12%(P<0.05)(图3-C)。YSE阶段,葡萄糖和麦芽糖含量在不同pH处理中的变化趋势一致,在pH 5.8和6.0处理中葡萄糖和麦芽糖含量均显著高于其他处理(P<0.05)(图3-D、E)。YSE阶段pH对果糖含量的影响较小,pH 6.2处理的果糖含量显著(P<0.05)高于pH 5.6处理,其他处理间差异均不显著(P>0.05);MSE阶段,pH 5.8处理的果糖含量显著(P<0.05)高于pH 5.6和6.0处理,与pH 6.2处理的果糖含量差异不显著(P>0.05)(图3-F)。
2.4 pH对体胚诱导氧化胁迫的影响
体胚诱导阶段,ROS积累受到pH影响显著,YSE诱导阶段pH 6.0和MSE诱导阶段pH 6.2处理下,ROS强度在各处理中处于中等水平(图4-A)。在YSE阶段,pH 5.8和6.0处理的羟自由基(·OH)积累较多,显著高于pH 5.6和6.2处理;成熟胚诱导阶段,pH 5.6处理的·OH含量最高,显著(P<0.05)高于其他处理,pH 6.2处理的·OH含量最低(图4-B)。在YSE诱导阶段,pH 6.0处理的H2O2含量显著(P<0.05)低于其他处理,其他处理间差异不显著(P>0.05);在成熟胚诱导阶段,pH 6.2处理下H2O2含量最高,比pH 5.6、pH 5.8和pH 6.0处理分别增加27.85%、30.83%和35.65%(图4-C)。不同pH环境下,POD、CAT和SOD活性在YSE、MSE阶段呈现出不同的趋势。YSE诱导阶段,不同pH处理的POD活性差异不显著(P>0.05);MSE阶段,pH 6.2处理的POD活性最低,显著(P<0.05)低于pH 5.6和6.0处理(图4-D)。YSE诱导阶段pH 6.0处理下,CAT、SOD活性较低,MSE阶段pH 5.6和6.2处理下CAT、SOD活性相对较高(图4-E、F)。
2.5 不同pH处理下各指标的相关性
为分析pH对体胚发生效果的影响,并揭示体胚诱导的生理变化规律,将pH、体胚诱导数量、生理指标进行相关性分析,结果见表1与表2,表中仅显示与体胚诱导数量相关性较强(Pearson相关系数>0.650)的生理指标。幼胚诱导阶段,pH与其他指标的相关性均未达到显著水平。YSE的诱导数量与IAA含量呈极显著正相关,与GA1、JA含量和POD活性均呈显著负相关;IAA含量与GA1含量和POD活性呈显著负相关;GA1含量与JA含量和POD活性呈极显著正相关,与H2O2含量呈显著正相关;JA含量与H2O2含量和POD活性呈显著正相关。幼胚诱导阶段的相关性分析表明,内源IAA含量可能是促进YSE数量的关键因子。
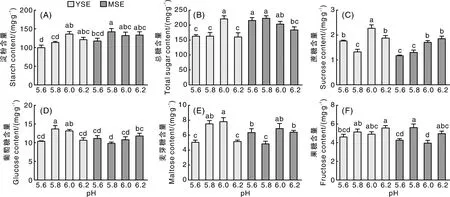
图3 pH对体胚诱导期糖代谢的影响Fig.3 Effects of pH on carbohydrate metabolism in somatic embryo induction stage
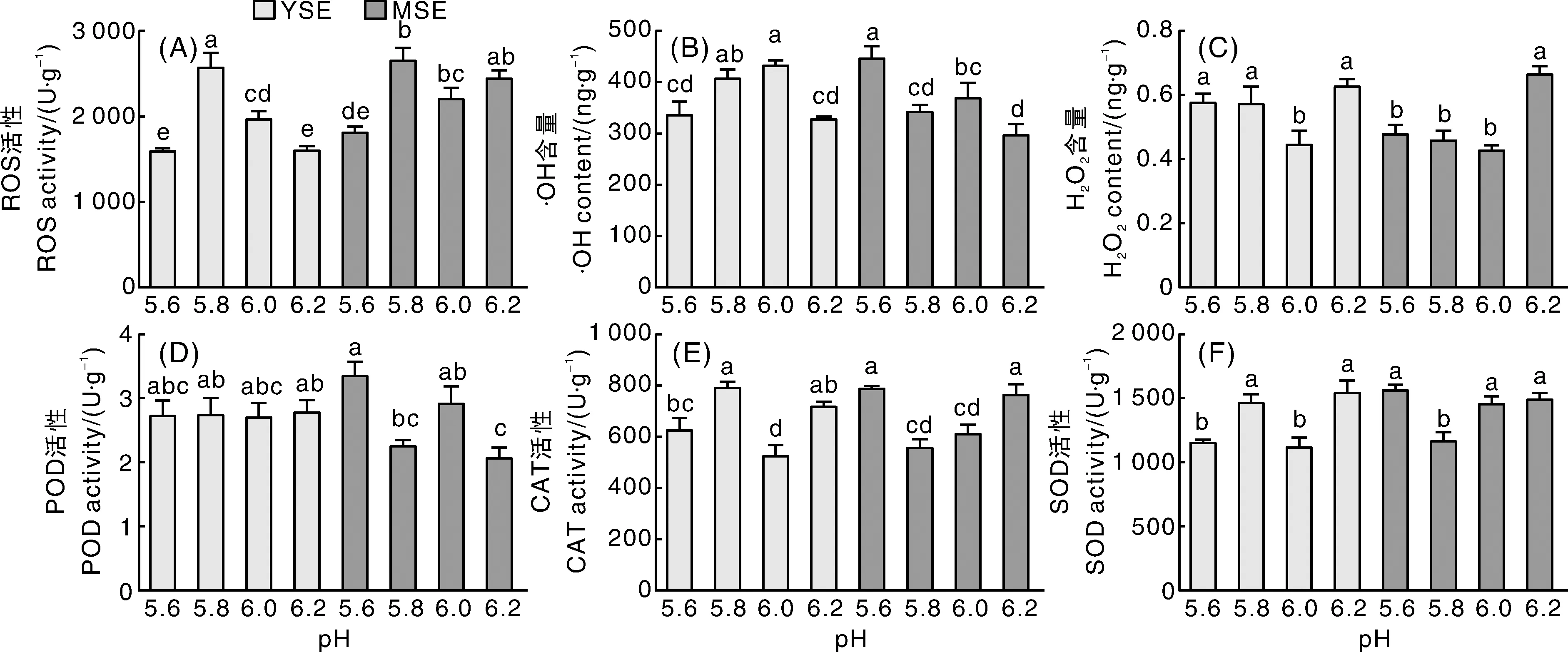
图4 pH对体胚诱导期活性氧积累与保护酶活性的影响Fig.4 Effects of pH on ROS accumulation and activity of protective enzymes in somatic embryo induction stage
成熟胚诱导阶段,pH与成熟胚诱导数量、IAA氧化酶活性、蔗糖含量呈显著正相关;成熟胚诱导数量与IAA氧化酶活性呈极显著正相关,与羟自由基含量呈显著负相关;IAA氧化酶活性也与羟自由基含量呈显著负相关;GA4与H2O2含量呈显著正相关;羟自由基含量与POD活性呈显著正相关。GA4含量、蔗糖含量与MSE数量的相关性虽没有达到显著水平,但相关系数较高,推测GA4和蔗糖对MSE诱导较为重要。
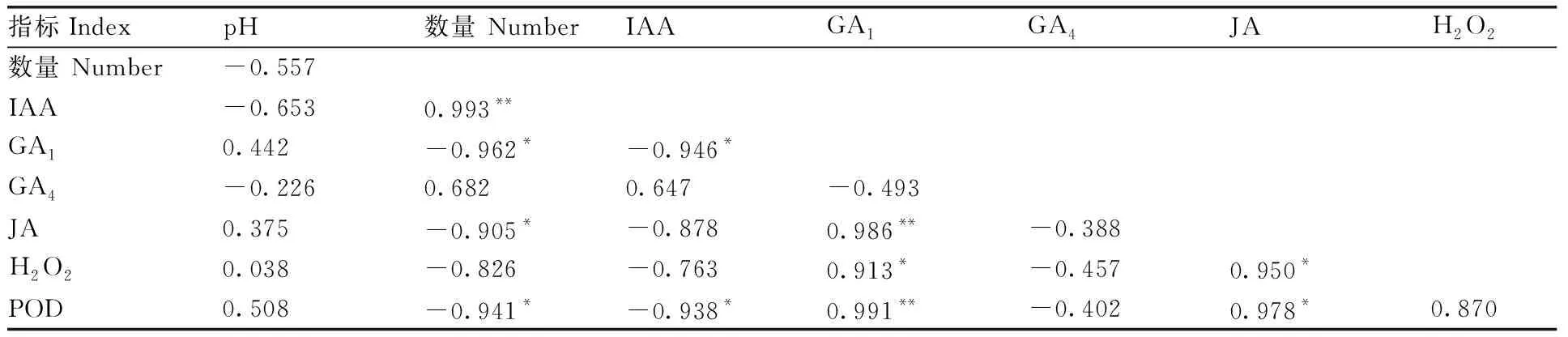
表1 幼胚诱导阶段体胚数量与生理指标的相关性分析
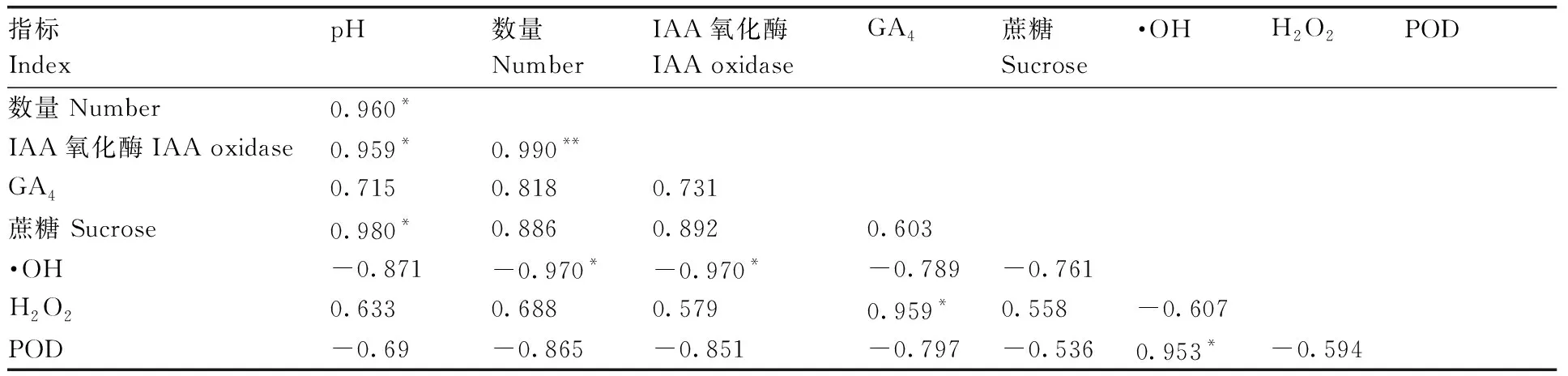
表2 成熟胚诱导阶段体胚数量与生理指标的相关性分析
3 结论与讨论
本研究表明,pH对百子莲体胚发生过程中激素信号、糖代谢和氧化胁迫的发生强度有影响,进而影响体胚发生效果。百子莲在YSE诱导和MSE诱导阶段较佳的pH分别为6.0和6.2。IAA、GA4、蔗糖含量对体胚诱导、成熟具有重要作用,中等强度的氧化胁迫利于体胚发生。今后可从形态学、细胞学、生理学、分子生物学等角度进一步揭示不同pH环境下重要生理指标对百子莲体胚发生的调节机制。
体胚发生各阶段对培养基pH需求不同,胞内pH变化可显著影响细胞分裂、分化与生长[4]。百子莲体胚发生培养基pH一般为5.6~5.8[11],而本研究表明,百子莲YSE和MSE诱导阶段的较佳pH分别为6.0和6.2。体胚诱导早期,部分植物需要偏酸性的培养环境,随体胚发育成熟,相对偏碱性培养条件利于胚和幼苗生长,从离体细胞到体胚成熟,百子莲对培养基pH的需求呈现出逐渐增高的趋势,与胡萝卜(DaucuscarotaL.)[20]、朝鲜山芹(Ostericumkoreanum)[23]离体再生的研究结果一致。通常培养基pH会随着培养时间延长逐渐降低,尤其是以琼脂作为支撑物[24],以百子莲pH 5.8的培养基为例,培养30 d时培养基pH约为3.8~3.9,偏酸环境造成的胁迫对体胚发育不利,细微的pH变化对生长素等激素发挥作用也有影响[25]。
生长素是调控植物发育的重要激素[26],内源IAA是唯一具有极性运输特性的植物激素[25],极性运输的能量依赖于胞内外pH梯度产生的质子动力,环境pH可影响IAA的极性运输[26-27],IAA的运输受到自身信号反馈[27]和pH的共同作用[25]。Dindas等[28]报道,胞外pH可通过调节拟南芥(Arabidopsisthaliana)根尖细胞H+和IAA-平衡改变细胞膜的极性,内源IAA信号转导受到pH梯度的显著影响。培养基pH可通过调节离体细胞对生长素的摄取能力而影响培养效果[29]。本研究中,IAA含量及其代谢受到培养基pH的显著影响,适宜的pH通过调节内源IAA合成与信号转导促进体胚诱导数量,在体胚发生中起到关键调控作用[5]。PIC是外源生长素类物质,通过调控内源IAA的合成与信号转导调节体胚发生进程[10,30],在水仙(Narcissuspseudonarcissus)[31]、郁金香(Tulipagesneriana)[7]和百子莲[11]中具有高度的特异性。在体胚诱导阶段,培养基去除PIC后会导致内源IAA含量增加,IAA通过调控细胞极性结构影响体胚诱导数量[30]。
GA在植物发育中具有重要功能,不具备极性运输特性,GA和IAA信号存在互作,GA信号可影响IAA合成与信号转导[32]。在小毛彩雀(Chaenorrhinumminus)种子萌发试验中,pH能够影响GAs生物合成和功能发挥[33]。GA对体胚发生的效果因物种而异,多数研究表明,GA对体胚诱导不利[14-15],例如GA3不利于紫花苜蓿(Medicagosativa)[34]、天竺葵(Pelargonium×hortorumBailey)体胚发生[14],而GA1、GA4利于胡萝卜体胚同步化[15]。GA1和GA4是植物主要活性内源GAs,百子莲中主要为GA4,在花芽、株高发育中均具有重要功能[32,35],相对于GA1,GA4含量与百子莲体胚发生效果一致,具有正向调节功能。在体胚发育后期,GA4可通过调控细胞分裂和伸长促进体胚成熟与幼苗形态建成[15],本研究中YSE诱导和MSE诱导阶段GA4与体胚数量均具有较强的相关性。
碳源可维持细胞渗透压、提供细胞骨架、参与能量代谢与信号转导,同时维持细胞膜完整性,是影响植物体胚发生的重要因素[17],其种类和水平在体胚的诱导和发育成苗过程中有重要作用[3,17]。细胞内源糖代谢不仅依赖外源供给,还受胞内糖组分利用规律的影响[17,36],而pH显著影响植物糖代谢[37],pH可通过影响真核细胞中磷酸化作用,改变淀粉等糖类代谢、蛋白质积累,从而影响体胚发生过程[5,20,38]。淀粉积累通常可作为体胚发生中的重要事件[36,39],IAA等激素在蔗糖和淀粉的转换中起重要调控作用,IAA、GA对淀粉的积累和蔗糖代谢具有显著调节作用[2,40-41]。在甘蔗(Saccharumspp.)、康乃馨(Dianthuscaryophyllus)、土豆蔻(Kelussiaodoratissima)、橡胶(Heveabrasiliensis)体胚诱导过程中,由于胞内糖代谢的变化,碳源的种类和浓度对体胚发生效果均有显著影响[3,36,42-43]。本研究中,体胚发育阶段蔗糖含量与MSE数量相关性较高,而淀粉、麦芽糖含量较高时,百子莲YSE诱导数量也达到较高水平。
胁迫信号和激素、糖代谢之间存在复杂的平衡关系[18]。离体培养中适宜的pH导致适度胁迫的发生,有利于IAA极性运输和胞内pH梯度建立,最终建立细胞全能性[5,17],而生长素对非生物胁迫具有重要的调节效果[27]。培养基蔗糖渗透压、pH和胁迫条件对细胞发育过程具有重要贡献[4,17]。最近研究证实,ROS可通过活性羰基(reactive carbonyl species,RCS)影响生长素信号转导调控植物发育,与生长素具有协同作用[44]。高浓度的H2O2会诱发逆境响应激素的积累,比如ABA、乙烯等,对体胚发育成熟具有促进作用[18]。体胚发生过程中,POD活性显著增加,参与细胞防御反应,细胞全能性一旦建立,胁迫程度也相应减弱,细胞膜完整性得以有效保持,利于提高体胚发生质量[36]。本研究中YSE和MSE阶段对逆境响应和对pH变化的耐受能力存在差异,H2O2含量、POD活性与体胚发生效果相关性较强,表明适宜的pH能有效调节胁迫强度与保护酶活性的平衡,利于植物细胞代谢与器官发育[45]。
