基于PI3K/AKT信号通路探讨苦参碱对人皮肤鳞状细胞癌A431细胞的作用研究
2020-08-28方晓琳李海舰赵秋婵李莉娟宋少华
方晓琳,李海舰,赵秋婵,李莉娟,宋少华
(广东省第二人民医院检验医学部,广东 广州 510317)
人皮肤鳞状细胞癌(human skin squamous cellcarcinoma,SCC)是主要发生于人体皮肤的鳞状上皮组织,是我国常见的皮肤恶性肿瘤之一。其发病率较高,在皮肤恶性肿瘤中占第2位,流行病学研究表明大约20%人当中可能发生皮肤癌,并且其发病率每年呈逐渐增高的趋势,其已成为世界性的影响公众健康的问题[1]。目前其病因尚未阐明,研究表明[2]其可能与慢性炎症、化学致癌剂、人乳头瘤病毒感染等密切相关。临床上治疗SCC的方式主要以手术切除为主,辅助以放射治疗和化学药物治疗,但以上治疗方式对人体皮肤损伤甚大,此外,患者依从性和预后也较差[3],因此寻找高效、低毒副作用的防治SCC新药具有重要的临床意义。
苦参为豆科植物苦参的干燥根,其味苦,性寒,现代药理学研究表明[4-5]其具有抗肿瘤、抗菌、强心、抗炎等多种药理作用。苦参碱(matrine,MT)是苦参中主要的活性成分,已有较多研究表明[6-10]其在体外对胰腺癌、肺癌、结肠癌、乳腺癌和前列腺癌等多种肿瘤细胞均具有较好的杀伤作用。林星镇[11]研究发现苦参碱对人口腔鳞状细胞癌Tca8113细胞具有明显的体外增殖抑制作用,以及通过上调FAS蛋白、Caspase-3表达,激活细胞内核酸内切酶,诱导肿瘤细胞凋亡,综上提示苦参碱可能对SCC具有较好的治疗作用。本研究旨在探讨苦参碱对SCC细胞增殖、凋亡和PI3K/AKT信号通路的影响,初步阐明其作用机制,为苦参碱防治SCC的临床应用提供部分实验依据。
1 材料与仪器
1.1 药物与试剂
苦参碱(南京凯基生物科技发展有限公司,质量分数>97%);人皮肤鳞状细胞癌A431细胞株(天津奥尔生物科技有限公司);CCK-8、PBS缓冲液、DMEM细胞培养液、胎牛血清、DMSO、0.25%胰酶消化液(美国Gibco公司);BCA 蛋白定量试剂盒(南京生航生物技术有限公司);AKT抗体、HRP标记二抗(英国Abcam公司);肿瘤坏死因子α(TNF-α)和白介素1α(IL-1α)ELISA检测试剂盒(上海铭博生物科技有限公司)。
1.2 主要仪器
BG-sub MIDI电泳仪、Applied Biosystems PCR仪、CO2培养箱(Thermo Fisher Scientific公司);Sunrise-Basci酶标仪(奥地利Tecan公司)。
2 方法
2.1 人皮肤鳞状细胞癌A431细胞培养
采用DMEM培养基[含10%(φ)胎牛血清和0.5%抗生素]于5%(φ)CO2、37 ℃细胞培养箱中常规传代培养人皮肤鳞状细胞癌A431细胞。具体操作步骤如下:使用PBS缓冲液清洗细胞3遍,0.25%胰酶消化液1 mL消化细胞,倒置显微镜下观察,待细胞变圆后加入2 mL培养基终止消化,接着转移至无菌Ep管中并离心(1 000 r/min ,5 min),弃去旧培养液,加入新鲜培养液重悬细胞,常规传代培养。
2.2 CCK-8 法检测人皮肤鳞状细胞癌A431细胞增殖抑制率
0.25%胰酶消化液消化处于对数生长期的人皮肤鳞状细胞癌A431细胞,将对数期人皮肤鳞状细胞癌A431细胞接种于96孔板,每孔为1×104个细胞,于含有5% CO2的37 ℃细胞培养箱培养24 h后,分别加入苦参碱梯度浓度处理,使其终浓度分别为10、20、40、80 nmol/L,其中以0 nmol/L设定为空白对照组,每组6个复孔。继续培养24、48、72、96 h 后,每孔加入100 μL含10 μL的CCK8试剂的DMEM 培养液,孵育4 h,在酶标仪450 nm 波长处检测细胞吸光度A值,并计算各组细胞增殖抑制率。增殖抑制率=[1-A(λ) 药物处理组/A(λ)空白对照组]×100%。
2.3 ELISA法检测A431细胞TNF-α和IL-1α的水平
将对数生长期的A431细胞接种到24孔培养皿中,每孔细胞为1×104个,于细胞培养箱中培养24 h,然后加入终浓度为10、20、40、80 nmol/L的苦参碱,以0 nmol/L设定为空白对照组,每组6个重复孔,继续培养48 h后,收集细胞培养液上清,严格按照ELISA酶联免疫吸附试剂盒操作说明书,测定细胞培养液上清TNF-α和IL-1α的水平。
2.4 real-time qPCR法检测人皮肤鳞状细胞癌A431细胞Bax和Bcl-2基因表达
将终浓度为10、20、40、80 nmol/L的苦参碱处理人皮肤鳞状细胞癌A431细胞48 h后,PBS缓冲液冲洗5次后,按Trizol法提取细胞总RNA,RT-PCR法并合成cDNA。使用PCR仪检测Bax和Bcl-2基因的表达水平。其引物序列分别为Bax:F-5′-CGAATTGGCGATGAACTGGA-3′,R-5′-CAAACATGT CAGCTGCCACAC-3′;Bcl-2:F-5′-GACTGAGTACCT GAACCGGCATC-3′,R-5′-CTGAGCAGCGTCTTCAGAG ACA-3′;GAPDH:F-5′-GCACAGTCAAGGCTGAGA ATG-3′,R-5′-ATGGTGGTGAAGACGCCAGTA-3′。
2.5 Western blot法检测人皮肤鳞状细胞癌A431细胞AKT蛋白表达
将终浓度为10、20、40、80 nmol/L的苦参碱处理人皮肤鳞状细胞癌A431细胞48 h后,提取并检测细胞总蛋白。按照每孔50 μg上样,常规经SDS-PAGE分离、转膜、封闭后,加入AKT一抗4 ℃冰箱过夜。PBS洗膜5次,加HRP标记的二抗稀释液,室温孵育2 h,PBS洗膜5次,ECL试剂化学发光、显影。Image J软件对图像进行灰度分析,以GAPDH为参照。目的蛋白表达水平=目的条带灰度值/GAPDH条带灰度值。
2.6 苦参碱与AKT对接验证
从ProteinDatabase(https://www.rcsb.org/)数据库AKT蛋白晶体结构,选择其具有配体的蛋白复合物,以保证其对接的精度。然后分别于pubchem(https://pubchem.ncbi.nlm.nih.gov/)下载苦参碱的结构。AKT与苦参碱均使用AutodockTools 1.5.6转化为PDBQT格式后采用Autodock vina 1.1.2进行分子对接。最后,选取Vina分值最低的构象用PyMOL 2.4进行作图分析。
3 结果
3.1 苦参碱对人皮肤鳞状细胞癌A431细胞增殖抑制率的影响
不同浓度(10、20、40、80 nmol/L)苦参碱,不同时间(24、48、72、96 h)作用于A431细胞后,其增殖抑制率随着苦参碱浓度的升高和处理时间的延长而升高,呈浓度和时间依赖性,见图1。

图1 苦参碱对人皮肤鳞状细胞癌A431细胞增殖抑制率的影响Figure 1 Effects of matrine on the proliferation inhibition rate of A431 cells
3.2 苦参碱对人皮肤鳞状细胞癌A431细胞TNF-α和IL-1α水平的影响
与空白对照组比较,不同浓度苦参碱组的TNF-α和IL-1α水平明显降低(P<0.05,或P<0.01),呈浓度依赖性,见图2。

1.空白对照组; 2. 10 nmol/L苦参碱组; 3. 20 nmol/L苦参碱组; 4. 40 nmol/L苦参碱组; 5. 80 nmol/L苦参碱组;与空白对照组比较:*P<0.05,**P<0.01。
3.3 苦参碱对人皮肤鳞状细胞癌A431细胞Bax和Bcl-2 mRNA表达的影响
与空白对照组比较,不同浓度苦参碱组BaxmRNA 表达显著升高(P<0.05),而Bcl-2 mRNA表达量显著降低(P<0.05),呈浓度依赖性,见表1。
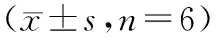
表1 苦参碱对人皮肤鳞状细胞癌A431细胞Bax和Bcl-2 mRNA表达的影响Table 1 Effects of matrine on the expression of Bax and Bcl-2 mRNA in A431 cells
3.4 苦参碱对人皮肤鳞状细胞癌A431细胞AKT蛋白表达的影响
与空白对照组比较,不同浓度苦参碱组AKT蛋白表达水平明显降低(P<0.05) ,作用呈浓度依赖性,见图3。
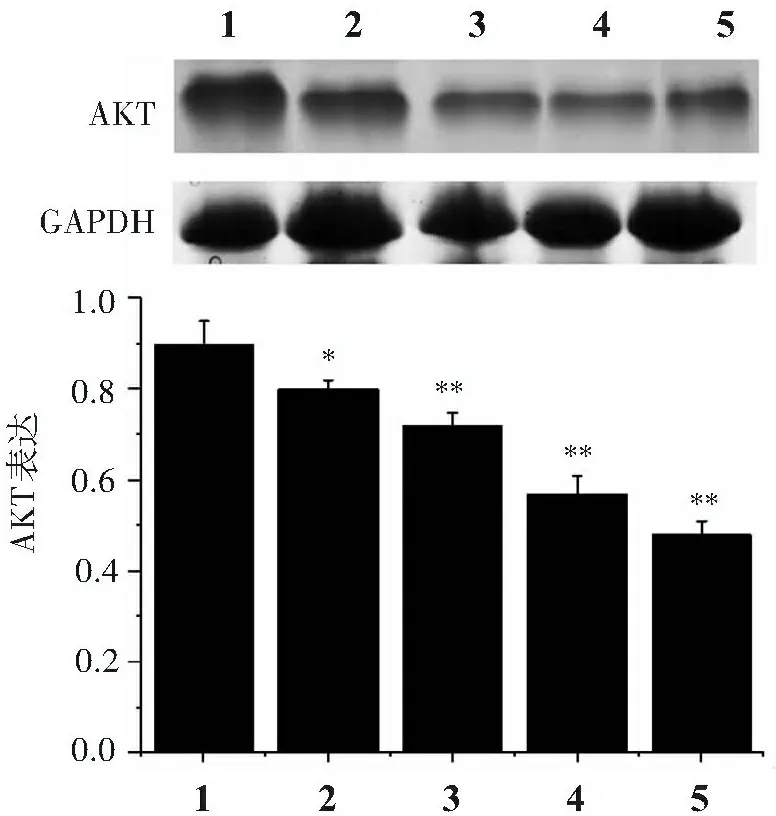
1.空白对照组; 2. 10 nmol/L苦参碱组; 3. 20 nmol/L苦参碱组; 4. 40 nmol/L苦参碱组; 5. 80 nmol/L苦参碱组; 与空白对照组比较:*P<0.05,**P<0.01。
3.5 苦参碱与AKT对接验证
使用AutoDock Vina(1.1.2 版本)将苦参碱对接蛋白AKT的活性口袋,Vina 得分(Vina score)是用Vina 程序以相应的口袋参数对受体和配体进行分子对接所得到复合物的得分,分值越低则代表受体和配体亲和力越高。对接结果显示,苦参碱与AKT靶点亲和力Vina 得分为-8.4 kcal/mol,结果可见,苦参碱与蛋白AKT具有较好的结合活性。见图4。

A.苦参碱模式图; B. AKT模式图; C.苦参碱与AKT对接模式图。
4 讨论
SCC是由多种致病因素(如紫外线照射、皮肤感染、遗传等) 共同作用所产生的一种恶性肿瘤[12]。其发病机制目前尚不十分明确,临床治疗上也无特效的治疗措施,因此探索SCC的发生机制和寻找安全有效的治疗药物是目前亟待解决的问题。
恶性增殖与分化异常是肿瘤细胞的两个基本生物学特征,其中抑制肿瘤细胞的恶性增殖是评价抗肿瘤药物疗效较为直接的观察指标之一[13]。本研究发现苦参碱对人皮肤鳞状细胞癌A431细胞的增殖具有明显的抑制作用,在10~80 nmol/L浓度范围内,随着苦参碱浓度的升高和处理时间的延长,人皮肤鳞状细胞癌A431细胞增殖抑制率也随之升高,呈浓度和时间依赖性。TNF-α是一种由单核巨噬细胞产生的参与机体多种炎症免疫过程的重要促炎症因子。TNF-α与肿瘤发生发展密切相关,有研究表明[14]在肿瘤微环境中如TNF-α长期高浓度表达可导致肿瘤进一步恶化。IL-1α作为一种内源性热源参与机体炎性过程,近年来研究发现,IL-1α与肿瘤发生发展也密切相关,特别是在肿瘤的发生和转移中具有重要生物学作用[15]。本研究发现苦参碱可明显降低TNF-α和IL-1α的水平,提示苦参碱可通过抗炎途径,降低促炎症因子水平,从而抑制人皮肤鳞状细胞癌A431细胞的增殖。
促凋亡基因Bax和抗凋亡基因Bcl-2是线粒体凋亡途径过程中最为重要的调节因子[16]。Bax主要通过升高线粒体膜通透性和促进细胞色素C的释放而起到诱导细胞凋亡作用,而Bcl-2主要通过减少线粒体细胞色素C的释放而发挥抗细胞凋亡作用[17]。本研究发现苦参碱可显著升高人皮肤鳞状细胞癌A431细胞的BaxmRNA 的表达水平 (P<0.05),而显著降低Bcl-2 mRNA的表达水平(P<0.05),且呈浓度依赖性,提示了苦参碱可能通过影响线粒体凋亡途径,上调Bax基因表达,下调Bcl-2基因表达,从而激活Caspase-3的活性,最终引起人皮肤鳞状细胞癌A431细胞的凋亡。
PI3K/AKT信号通路是近年来发现的一条关于细胞内与癌症发生发展密切相关的重要信号途径,其参与了癌症细胞的增殖、存活、侵袭迁移、新生血管形成及抑制细胞凋亡等过程[18]。有研究表明,抑制PI3K/AKT信号通路可抑制垂体腺瘤细胞的增殖和侵袭能力[19]。越来越多的实验研究证实[20],通过阻断PI3K/AKT信号通路的传导可能是治疗人皮肤鳞状细胞癌的有效手段之一。本研究发现苦参碱可以明显降低人皮肤鳞状细胞癌A431细胞的AKT蛋白表达水平,且呈浓度依赖性。此外,通过分子对接发现苦参碱对AKT具有较好的结合活性,综上提示苦参碱可能通过抑制PI3K/AKT信号通路,从而促进人皮肤鳞状细胞癌A431细胞的凋亡,本研究不足之处在于只探讨了苦参碱对PI3K/AKT信号通路中的AKT蛋白表达的作用,是否对通路其他关键蛋白起调控作用以及可否同时作用于其他癌症信号通路起协同作用,还需进一步的深入研究。
综上所述,苦参碱具有抑制人皮肤鳞状细胞癌A431细胞增殖和诱导凋亡作用,其作用机制可能与抑制PI3K/AKT信号通路的激活有关。
