顺铂前药接枝修饰硫代DNA及其自组装靶向纳米药物研究
2020-08-26任玉双郭园园刘学怡
任玉双,郭园园,刘学怡,宋 杰,张 川
(1.上海交通大学化学化工学院,上海交通大学变革性分子前沿科学中心,金属基复合材料国家重点实验室;2.电子信息与电气工程学院,上海200240)
全球范围内癌症发病率逐年增高,严重威胁人类健康,尤其乳腺癌已经成为全球女性发病率和致死率最高的癌症之一[1~3].广谱性抗癌药顺铂广泛用于包括乳腺癌在内的实体瘤的治疗中[4].然而小分子顺铂药物具有溶解性差,体内半衰期短,选择性差以及剂量毒副作用等缺点,严重限制了其治疗的有效性[5~8].近几十年来,研究人员一直致力于研发疗效好且副作用小的新型铂类药物以用于治疗乳腺癌等癌症[9~11].但二价顺铂复合物固有的易与血液中含硫物质结合失活和无靶向性等缺点,使其在生物利用度和安全性方面仍面临着巨大的挑战[12,13].
在铂类药物发展过程中,四价顺铂类[Pt(Ⅳ)]前药复合物具有毒性低和药理学良好的特征,展现了很好的应用前景.八面体Pt(Ⅳ)前药在血浆中具有更好的药代动力学特性和稳定性,且进入癌细胞便会在细胞内源性还原剂作用下激活,释放出活性的二价顺铂类药物以抑制肿瘤生长[14,15].八面体Pt(Ⅳ)前药在Pt配位中心有2个可调节的轴向配体,通过设计调整轴向配体基团可以精确调节复合物的动力学稳定性、氧化还原电势、亲脂性和生物活性等性质[16].此外,轴向位置还可设计靶向性功能分子或连接性功能分子将其负载到纳米输送载体上[17~19],以增加药物对肿瘤细胞的特异性识别,促进细胞摄取[20,21].Pt(Ⅳ)前药连接肿瘤靶向分子以形成靶向药物,可以提高药物疗效并减少副作用.乳腺癌等大多数腺癌细胞表面都会过度表达MUC-1 蛋白,因此MUC-1 蛋白可作为抗癌药物递送的有效靶标,在此基础上研发出了可以特异性结合MUC-1蛋白的靶向分子MUC-1适配体[22].MUC-1适配体是一段含有25个碱基序列的核苷酸,已广泛应用于肿瘤靶向药物策略研究[23,24].将Pt(Ⅳ)前药与MUC-1适配体结合,则可构建出具有主动靶向功能的新型药物递送系统并用于肿瘤治疗.
纳米药物递送体系常用的载体包括脂质体[25~27]、聚合物胶束[28]及无机纳米材料等[29].然而,大多数纳米药物载体生物相容性并不理想,可能引发强烈的副作用,如线粒体损伤、血小板聚集、炎症和氧化应激等[30~32].因此,构建具有良好生物相容性以及更高效的靶向药物系统递送顺铂类药物,对提高药物生物利用率,增强药物的抗肿瘤效果以及降低其系统毒副作用具有重要意义.DNA自组装纳米材料具有良好的生物相容性,可以实现药物的修饰负载和高效靶向递送,在药物递送领域显示了巨大的潜力[33~40].DNA材料具有低免疫原性,生物可降解且组装结构精确可控,在生理环境下具有良好的稳定性,其纳米结构能够很好地促进细胞摄取[33].基于DNA纳米结构的药物输送体系负载药物的方式包括DNA双链插入法[34]、核酸杂交法[35,36]及化学反应结合法[37~40]等.目前,大多数DNA药物化学偶联方法依赖于其端基氨基或硫醇修饰来反应接枝药物,该方法的载药率低、合成繁琐及成本高.最近,我们[41,42]发展了一种基于硫代核酸骨架上的硫代磷酸酯(PS)基团接枝小分子药物的新型载药方法,其硫代核酸可通过固相合成方法直接制备,简单方便,而且其硫代核酸骨架上硫代修饰位点和数量可调,可同时实现药物分子接枝位点和数量的精确调控,提高药物载药率.
本文设计合成了含MUC-1适配体序列并接枝了Pt(Ⅳ)前药的两亲性核酸-顺铂前药缀合物,并通过自组装进一步构建了新型含铂DNA纳米药物递送系统.在细胞以及动物层面对其靶向递送特性和抗肿瘤效果进行了评价.
1 实验部分
1.1 试剂与仪器
顺铂(cis-Platin,分析纯)购自大连美伦生物技术有限公司;过氧化氢(H2O2,质量分数30%,分析纯)购自国药集团化学试剂有限公司;噻唑蓝(MTT)、碘代乙酸酐和苯甲酸酐(分析纯)及Alexa fluor®488/Annexin V细胞凋亡检测试剂盒购自美国Sigma-Aldrich公司;二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)和二氯甲烷均为分析纯,购自上海泰坦科技有限公司;所有硫代DNA均购自上海百易基因科技有限公司;所有寡核苷酸的序列列于表S1(见本文支持信息).
MERCURY plus 400型核磁共振波谱仪(NMR,美国Varian公司);Evolution 300型紫外-可见分光光度计(UV-Vis,美国ThermoFisher 公司);ZS90 型纳米粒度及Zeta电位分析仪(DLS,英国Malvern 公司);BD LSRFortessa 型流式细胞仪(FCM,美国BD公司);TCS SP8 STED 3X型活细胞超高分辨率多光子激光共聚焦显微镜(CLSM,德国Leica 公司);Synergy H4 型酶标仪(美国BioTek 公司);Tecnai G2 Spirit Biotwin型透射电子显微镜(TEM,美国FEI 公司).
1.2 MUC-1/Pt-SNA纳米药物的合成
1.2.1 Pt(Ⅳ)前药cis,cis,trans-[Pt(NH3)2Cl2(CO2C6H5)(CO2CH2I)](简称 Pt-Bz-CH2I,3)的合成 如Scheme 1和图S1(见本文支持信息)所示,参照文献[43]方法合成了氧化顺铂(1),并合成cis,cis,trans-[Pt(NH3)2Cl2(CO2C6H5)OH](简称 Pt-Bz,2).首先将 100 mg(300 μmol)的氧化顺铂与 30 mL 的超干DMSO 搅拌混悬均匀,再缓慢加入74.6 mg(330 μmol)的苯甲酸酐,室温下避光反应过夜.将反应液通过硅藻土过滤以除去未反应的氧化顺铂,收集滤液直接真空冻干.分别用DMF(1×5 mL)和丙酮(3×5 mL)洗涤冻干后的产物,并经真空干燥得到白色粉末产物2,产率为60.2%.由图S2(见本文支持信息)可见,化合物2的1H NMR(400 MHz,DMSO-d6),δ:7.87(d,2H,arom H),7.48(t,1H,arom H),7.38(t,2H,arom H),6.04(m,6H,NH3).Pt-Bz 的ESI-MS 结果如图S3(见本文支持信息)所示,[M+H]+为436.9760,与C7H12Cl2N2O3Pt理论分子量436.9873一致.
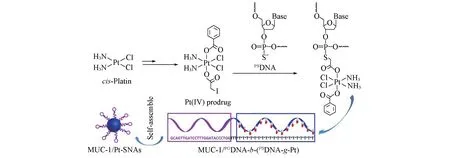
Scheme 1 Schematic illustrations of MUC-1/PODNA-b-(PSDNA-g-Pt) conjugate synthesis and the self-assembly of MUC-1/Pt-SNAs
参照文献[44]方法合成Pt(Ⅳ)前药化合物(Pt-Bz-CH2I,3).首先将100 mg(228 μmol)的化合物2与10 mL的超干DMF混悬均匀,在冰浴环境下缓慢加入403.4 mg(1140 μmol)的碘代乙酸酐,继续避光反应12 h.将反应后的溶液过滤,并冻干滤液,分别用二氯甲烷(1×2 mL)和乙醚(5×10 mL)洗涤冻干产物,干燥得到灰色固体产物Pt-Bz-CH2I,产率71.4%.由图S4(见本文支持信息)可见,Pt-Bz-CH2I 的1H NMR(400 MHz,DMSO-d6),δ:7.87(d,2H,arom H),7.51(t,1H,arom H),7.43(t,2H,arom H),6.64(m,6H,NH3),3.82(s,2H,—CH2I).Pt-Bz-CH2I 的ESI-MS 结果如图S5(见本文支持信息)所示,[M+H]+为606.9022,与C9H14Cl2IN2O4Pt的理论分子量606.9101一致.
1.2.2 DNA接枝Pt(Ⅳ)前药缀合物MUC-1/PODNA-b-(PSDNA-g-Pt)的合成 将Pt-Bz-CH2I溶解在超干DMF中,然后添加DMF溶解的硫代DNA(MUC-1-POT2-PST20-T)溶液,反应物的投料比(即Pt-Bz-CH2I与DNA中PS基团个数比)为30∶1,反应液中DNA的浓度为60 OD/mL,将混合物在55 ℃下避光震荡反应36 h.将反应后的产物装进截留分子量为5000的透析袋并置于DMSO中透析2 d,每4 h换一批新鲜DMSO,以除掉未反应的Pt(Ⅳ)前药.取出透析袋内的溶液真空干燥,得到两亲性核酸-顺铂前药缀合物MUC-1/PODNA-b-(PSDNA-g-Pt).
1.2.3 MUC-1/Pt-SNAs的自组装 将合成的MUC-1/PODNA-b-(PSDNA-g-Pt)溶解在0.3 mL DMSO中,加下0.3 mL水并充分混合均匀,经超纯水透析1 d以除去DMSO,最终自组装形成类似球形核酸(SNA)的纳米药物MUC-1/Pt-SNAs(Scheme 1).通过20%变性聚丙烯酰胺凝胶电泳(Poly-acrylamide gel electrophoresis,PAGE)和1.5%琼脂糖凝胶电泳表征MUC-1/Pt-SNAs的合成组装.
1.3 MUC-1/Pt-SNA纳米药物体外靶向效果和抗肿瘤效果测试
1.3.1 MUC-1/Pt-SNAs纳米药物的细胞摄取行为 实验选用过表达MUC-1蛋白的人乳腺癌MCF-7细胞(MUC-1+)和阴性对照组肝癌HepG 2细胞(MUC-1-),探究了MUC-1/Pt-SNAs纳米药物的靶向效果.所有细胞均在DMEM培养基中培养.
通过流式细胞仪表征MCF-7(MUC-1+)和HepG 2(MUC-1-)细胞对MUC-1/Pt-SNA 纳米药物的摄取行为.将MCF-7 和HepG 2 细胞分别以每孔5×104个细胞的密度接种在24 孔板中,细胞贴壁后换用Opti 培养基,分别向细胞中添加荧光分子Cy5 标记的free Cy5-MUC-1 DNA 和Cy5-MUC-1/Pt-SNA 样品(Cy5浓度为0.2 μmol/L).孵育不同时间后进行流式细胞仪分析.
通过共聚焦激光扫描显微镜表征Cy5-MUC-1/Pt-SNAs的细胞摄取.将MCF-7和HepG 2细胞分别以每孔5×104个细胞的密度接种到底部放置了干净的小盖玻片的24孔板中,分别向细胞中添加荧光分子Cy5 标记的 free Cy5-MUC-1 DNA 和Cy5-MUC-1/Pt-SNA 样品(Cy5 浓度为0.2 μmol/L).孵育一定时间后,用Hoechst 33342将细胞核染色,用于共聚焦激光扫描显微镜观察.
1.3.2 MUC-1/Pt-SNAs纳米药物的细胞毒性 将MCF-7和HepG 2细胞分别以每孔5×103个细胞的密度接种在96孔板中,分别加入不同浓度梯度的MUC-1/Pt-SNAs、Pt(Ⅳ)前药和顺铂药物,培养72 h后,通过MTT 试剂评价细胞活性.每个实验浓度条件下做5个平行样品.
1.3.3 MUC-1/Pt-SNAs 纳米药物的细胞凋亡 首先将MCF-7细胞以每孔3×104个细胞的密度均匀接种于24 孔板中,分别加入含等量铂浓度(60 μmol/L)的MUC-1/Pt-SNAs、Pt(Ⅳ)前药和顺铂药物,孵育72 h 后,采用细胞凋亡试剂盒(分别用Alexa fluor®488 annexin V 和PI 染色)测定MCF-7 肿瘤细胞凋亡情况.
1.4 MUC-1/Pt-SNA纳米药物动物体内抗肿瘤效果分析
给每只35 d 左右大的Balb/c 雌性裸鼠皮下注射0.2 mL 含4×106个MCF-7 细胞的细胞悬液,构建MCF-7皮下肿瘤模型.待肿瘤体积增长到50 mm3左右时,将荷瘤裸鼠按照每组3只随机分成3组,分别注射磷酸盐缓冲溶液(PBS)、顺铂药物以及MUC-1/Pt-SNAs药物(其中顺铂含量均为4 mg/kg),每隔3 d给药,共计给药5次.每次给药时分别对裸鼠拍照,并记录每组裸鼠的体重以及皮下肿瘤的长(L,mm)和宽(W,mm).肿瘤体积(V,mm3)的计算公式为V=1/2×L×W2.给药15 d 后,处死裸鼠,解剖取出心、肝、脾、肺、肾和肿瘤,进行组织病理学和免疫荧光分析.
2 结果与讨论
2.1 含铂DNA纳米药物的设计
以48 个碱基的硫代嵌段DNA MUC-1-POT2-PST20-T 为载体,将其5′端设计为普通磷酸酯键(Phosphodiester,PO)且具有靶向功能的MUC-1适配体序列(MUC-1/PODNA),中间引入2个普通T碱基作为间隔序列(POT2),同时将其3′端设计为20 个硫代磷酸酯基团(PSDNA)修饰的纯T 碱基(PST20-T),用于接枝Pt(Ⅳ)前药,最终形成两亲性核酸-顺铂前药缀合物MUC-1/PODNA-b-(PSDNA-g-Pt).该缀合物在水溶液中可进一步自组装形成类似于球形核酸的纳米药物MUC-1/Pt-SNAs.由于核酸适配体的引入,组装的球形核酸纳米药物可实现主动靶向功能,
2.2 MUC-1/Pt-SNAs纳米药物的表征
将硫代DNA 接枝Pt(Ⅳ)前药后,得到缀合物MUC-1/PODNA-b-(PSDNA-g-Pt).产物经纯化后,分别通过ICP测出其中Pt(Ⅳ)前药的含量,以及通过紫外分光光度仪测量其中硫代DNA的含量,可以得出药物中Pt(Ⅳ)前药的接枝率和载药率.为避开Pt(Ⅳ)前药影响,采用端基修饰了荧光分子Cy5的DNA(Cy5-MUC-1-POT2-PST20-T)(表S1,见本文支持信息)以及其缀合物Cy5-MUC-1/PODNA-b-(PSDNA-g-Pt)在654 nm 处的紫外吸收强度来定量DNA.如图S6(见本文支持信息)所示,计算出缀合物Cy5-MUC-1/PODNA-b-(PSDNA-g-Pt)中的Pt(Ⅳ)前药和嵌段DNA的摩尔比(即药物接枝比)约为20,和此嵌段DNA上设计20 个硫代磷酸酯基团反应位点相对应,由此计算得到其载药率约为39.6%.结果表明,MUC-1-POT2-PST20-T载药体系能够通过其硫代DNA骨架上硫代磷酸酯基团高效接枝载送顺铂前药,从而提高了顺铂药物的载药率.
如图1(A)所示,对比DNA反应前后的20%变性聚丙烯酰胺凝胶电泳(PAGE)结果可见,硫代DNA接枝Pt(Ⅳ)前药反应后产物堵在胶孔中,说明缀合物MUC-1/PODNA-b-(PSDNA-g-Pt)结合成功.由于DNA具有高度亲水性,而Pt(Ⅳ)前药具有疏水性,因此在硫代DNA片段上大量接枝Pt(Ⅳ)前药形成了两亲性核酸-顺铂前药缀合物MUC-1/PODNA-b-(PSDNA-g-Pt),并可以亲疏水自组装成球形核酸纳米药物MUC-1/Pt-SNAs.通过临界胶束浓度(Critical micelle concentration,CMC)可评价其自组装能力.采用包载荧光探针尼罗红方法测定MUC-1/PODNA-b-(PSDNA-g-Pt)的临界胶束浓度.如图2(A)所示,尼罗红荧光强度随MUC-1/PODNA-b-(PSDNA-g-Pt)水溶液浓度的变化而变化,其拐点处浓度为0.23 μmol/L,即为MUC-1/Pt-SNA纳米药物的CMC.结果表明MUC-1/Pt-SNAs纳米药物具有较低的CMC,能够很容易在水中亲疏水自组装,并初步体现了MUC-1/Pt-SNAs具有较高的组装稳定性.

Fig.1 Characterizations of MUC-1/PODNA-b-(PSDNA-g-Pt)and its self-assembled MUC-1/Pt-SNAs
MUC-1/Pt-SNAs 组装结果如图1(B)所示,MUC-1/Pt-SNA 样品浸入1.5%的琼脂糖凝胶中,并显示为清晰的均一条带,表明其纳米结构粒径分布相对较窄.如图2(B)所示,动态光散射(Dynamic light scattering,DLS)测定的 MUC-1/Pt-SNAs 的流体力学直径(Ds)约为 148.3 nm,多分散指数(PDI)为0.218.MUC-1/Pt-SNAs在透射电子显微镜成像下显示为球形形态,形貌比较均匀[图1(C)],平均粒径在139.3 nm左右.该结果说明硫代DNA接枝修饰Pt(Ⅳ)前药后可以成功自组装成类似SNA的纳米药物MUC-1/Pt-SNAs.
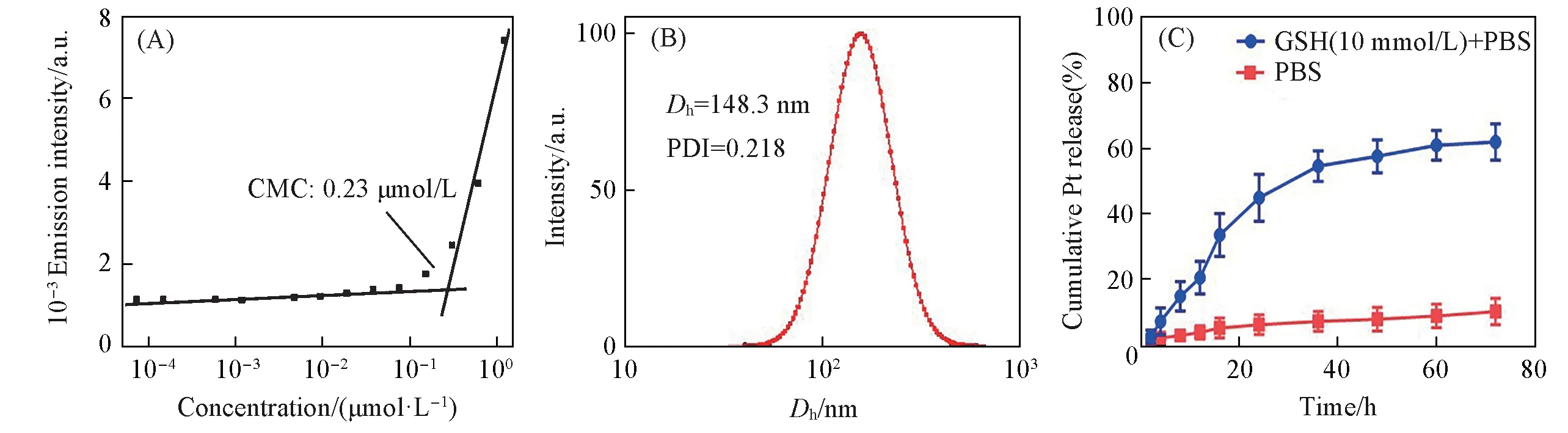
Fig.2 Characterizations of MUC-1/Pt-SNAs
2.3 MUC-1/Pt-SNAs的稳定性及药物释放特征
通过DLS表征了MUC-1/Pt-SNAs载药系统在不同模拟生理pH环境下的稳定性.如图S7(见本文支持信息)所示,在不同的pH缓冲液中恒温37 ℃孵育2 h后,MUC-1/Pt-SNAs的粒径尺寸及分布无明显变化,从而证明了MUC-1/Pt-SNAs在不同模拟生理pH环境下具有稳定性.
此外,在非还原条件(1×PBS,pH=7.4,37 ℃)和还原条件[含10 mmol/L 谷胱甘肽(GSH)的PBS 溶液,37 ℃]下评估了MUC-1/Pt-SNAs 的药物释放行为.如图2(C)所示,MUC-1/Pt-SNAs 在非还原条件PBS 溶液中比较稳定,即使在72 h 后也只释放出了约11.1%的铂类药物.由于还原剂GSH 的存在,Pt(Ⅳ)前药被还原为二价顺铂药物释放出来.所以,相比之下,MUC-1/Pt-SNAs在含10 mmol/L GSH的还原条件中72 h后释放了高达62.2%的铂类药物.上述结果说明MUC-1/Pt-SNAs载药体系能在正常非还原性环境中稳定存在,降低了顺铂药物对正常组织的毒副作用;但当其到达富含还原性物质的肿瘤组织后,其所接枝负载的顺铂前药能够快速被还原释放出活性顺铂,抑制肿瘤增殖,提高顺铂药物生物利用率.
2.4 MUC-1/Pt-SNAs的细胞摄取行为
为了解决小分子顺铂药物选择性低,全身毒副作用大等问题,构建了含有主动靶向功能MUC-1适配体的MUC-1/Pt-SNAs 球形核酸纳米载药体系.并采用荧光分子Cy5 标记的Cy5-MUC-1/Pt-SNAs 评估该纳米载药体系体外肿瘤靶向能力.如图S8(A)和(B)(见本文支持信息)所示,20%变性PAGE凝胶电泳和1.5%琼脂糖凝胶电泳结果证明了Cy5-MUC-1/Pt-SNAs合成组装成功.
通过流式细胞仪(FCM)分别测量MUC-1蛋白过表达的人乳腺癌MCF-7细胞(MUC-1+)和对照组肝癌HepG 2细胞(MUC-1-)对Cy5-MUC-1/Pt-SNAs的摄取效率,探究MUC-1/Pt-SNAs纳米药物的细胞靶向效果.由图3 可见,分别与Cy5-MUC-1/Pt-SNAs 孵育0.5,1,2,4 和6 h 后,MCF-7 和HepG 2 细胞内的纳米药物荧光信号逐渐增强,表明细胞对Cy5-MUC-1/Pt-SNAs 纳米药物的摄取量随时间的延长而增大.由图4(A)和(B)可见,在同种细胞内(如MCF-7细胞),Cy5-MUC-1/Pt-SNAs纳米药物的细胞摄取量是free Cy5-MUC-1 DNA的10倍左右,差异显著,表明了Cy5-MUC-1/Pt-SNAs球形核酸纳米药物能有效促进细胞摄取.由图4(C)可见,与Cy5-MUC-1/Pt-SNAs孵育相同时间(2 h)后,MCF-7细胞(MUC-1+)中Cy5-MUC-1/Pt-SNAs 的细胞摄取量为对照组HepG2 细胞(MUC-1-)的2.1 倍左右,差异显著,表明了Cy5-MUC-1/Pt-SNAs具有选择性靶向MCF-7细胞(MUC-1+)的能力.
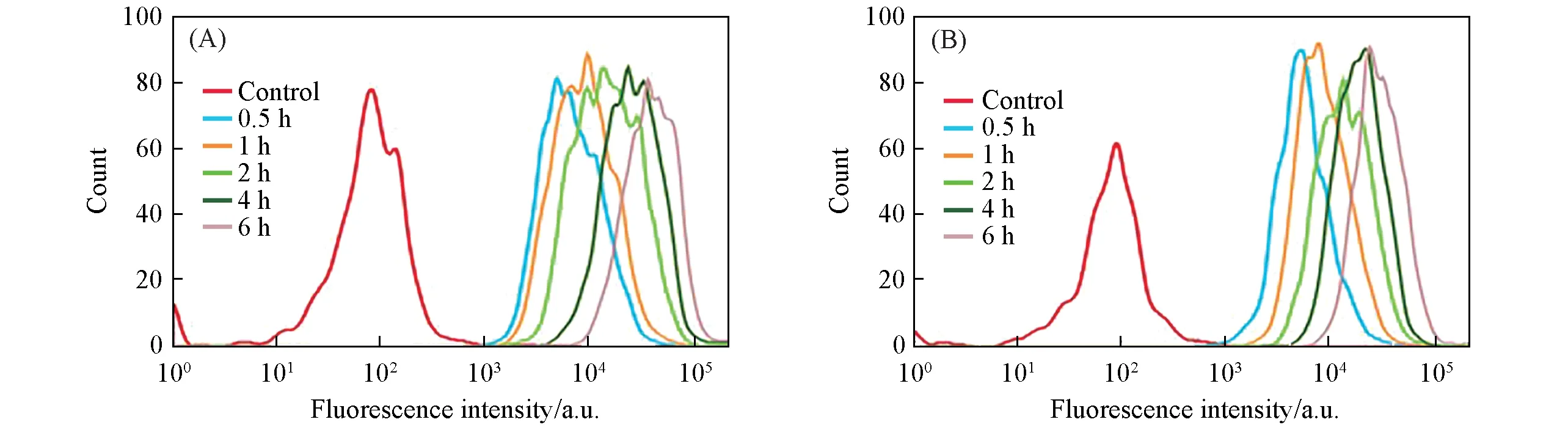
Fig.3 Flow cytometric results of Cy5-MUC-1-Pt-SNAs incubated with MCF-7(A) and HepG 2(B)cells for different time intervals
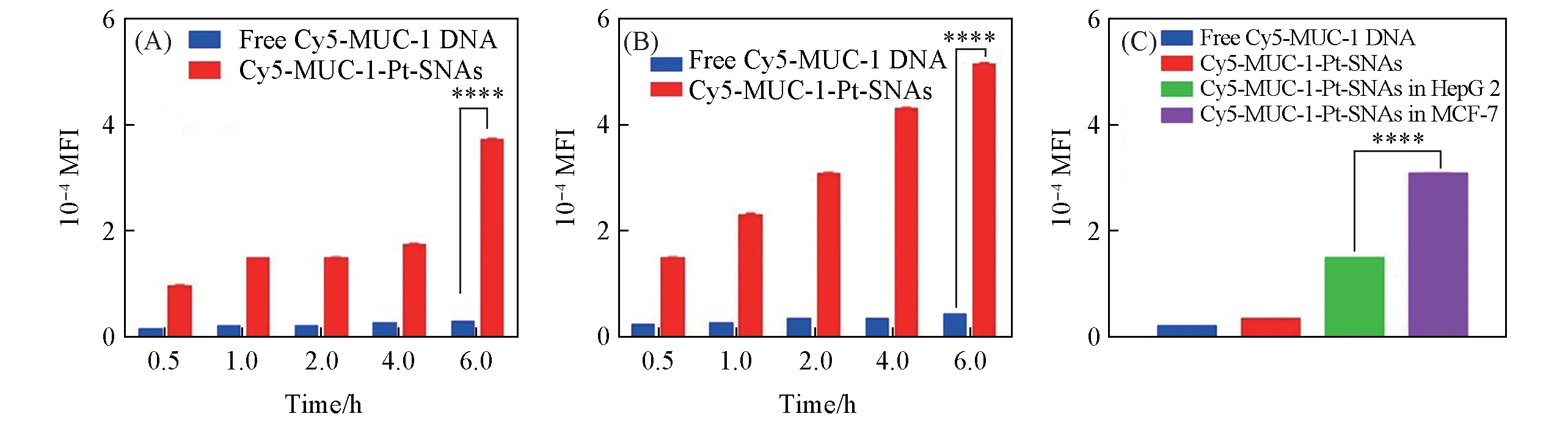
Fig.4 Cellular uptake behaviors of MUC-1-Pt-SNAs
激光共聚焦显微镜成像(CLSM)实验得到了相同的结果,其中细胞核呈现蓝色荧光,Cy5标记的药物呈现红色荧光.如图5(B)所示,与MUC-1/Pt-SNAs 纳米药物孵育4 h后的MCF-7细胞中红色荧光比与free Cy5-MUC-1 DNA 孵育4 h 后更强.如图5(A)和(B)所示,与MUC-1/Pt-SNAs 孵育相同时间后,MCF-7细胞(MUC-1+)中显示出比HepG 2细胞(MUC-1-)更强的红色荧光.以上结果表明所构建的Cy5-MUC-1/Pt-SNAs球形核酸纳米药物体系,具有基于球形核酸纳米结构和基于MUC-1适配体的主动靶向相结合促进细胞摄取的效果.
2.5 MUC-1/Pt-SNAs体外肿瘤治疗效果
采用细胞毒性MTT 方法对MUC-1/Pt-SNAs 的体外抗肿瘤效果进行评价.MCF-7 和HepG 2 肿瘤细胞分别与不同浓度的顺铂药物、Pt(Ⅳ)前药和MUC-1/Pt-SNAs药物孵育72 h后,分析细胞存活率.如图S9(A)和(B)(见本文支持信息)所示,在MCF-7细胞中,MUC-1/Pt-SNAs与顺铂药物的细胞活性趋势相似,MUC-1/Pt-SNAs 的IC50值为4.8 μmol/L,低于顺铂药物的相应值;在HepG 2 细胞中,MUC-1/Pt-SNAs的IC50值为7.8 μmol/L,同样低于顺铂药物的相应值;且MUC-1/Pt-SNAs在HepG 2(MUC-1-)肿瘤细胞中的IC50值为在MCF-7(MUC-1+)肿瘤细胞中的1.6倍.该结果体现出MUC-1/Pt-SNAs具有比顺铂药物更好的抑制肿瘤增殖效果,并且具有选择性抑制MUC-1 蛋白过表达的MCF-7 肿瘤细胞增殖的能力.
使用Annexin V-FITC细胞凋亡试剂盒进一步验证了MUC-1/Pt-SNAs诱导MCF-7细胞凋亡以及抑制肿瘤生长的效果.如图6所示,MCF-7细胞分别与顺铂药物、Pt(Ⅳ)前药和MUC-1/Pt-SNAs(铂药物浓度均为60 μmol/L)孵育72 h后,其凋亡率分别为78.0%,83.3%和85.4%,其中MUC-1/Pt-SNAs组细胞凋亡率比顺铂药物组增加了7.4%.以上结果证明MUC-1/Pt-SNAs 和顺铂药物都是通过诱导细胞凋亡的方式抑制肿瘤细胞增殖,且MUC-1/Pt-SNAs具有更好的抑制肿瘤生长效果.
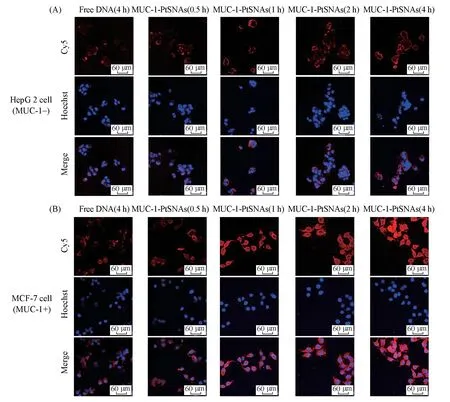
Fig.5 CLSM images of the HepG 2(A)and MCF-7(B)cells after being treated with free Cy5-MUC-1 DNA and Cy5-MUC-1-Pt-SNAs for different time intervals
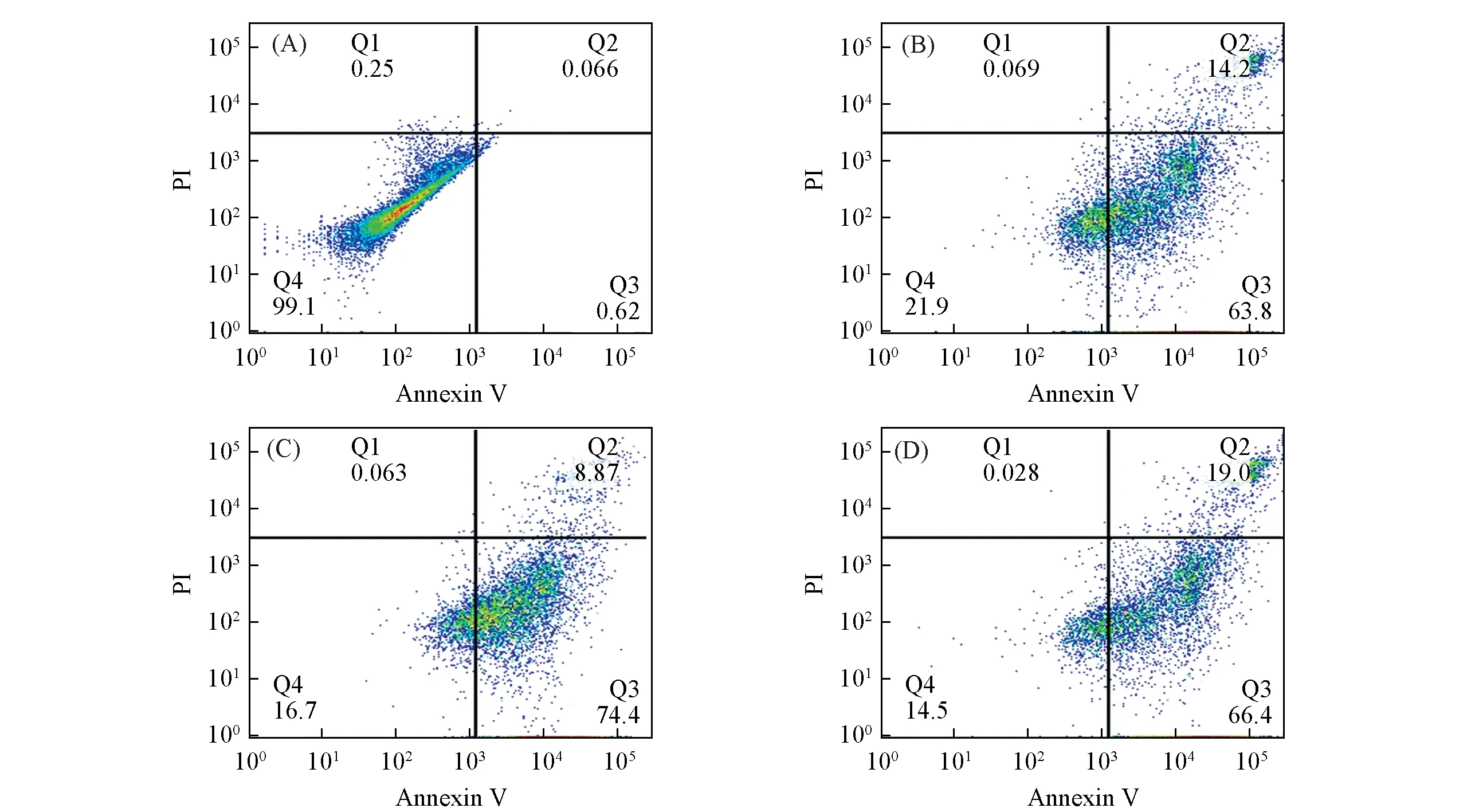
Fig.6 Cell apoptosis of MCF-7 cells after being treated with different drug formulations(60 μmol/L Pt,72 h)
2.6 MUC-1/Pt-SNAs的体内抗肿瘤效果
为了系统评估MUC-1/Pt-SNAs的体内抗肿瘤效果,建立了MCF-7细胞荷瘤裸鼠动物模型,并分别给予PBS(作为对照)、顺铂药物和MUC-1/Pt-SNAs药物治疗(顺铂含量均为4 mg/kg).如图7(A)和(B)所示,各治疗组MCF-7 肿瘤的起始尺寸相当,给药第15 d 时,MUC-1/Pt-SNAs 治疗组的肿瘤体积小于PBS 对照组的肿瘤体积,差异显著;且MUC-1/Pt-SNAs 治疗组的肿瘤体积比顺铂药物治疗组更小.以上结果说明MUC-1/Pt-SNAs能够有效抑制肿瘤增殖,甚至抑制效果比顺铂更好.而顺铂药物在治疗后期毒副作用明显,如图7(C)和图S10(见本文支持信息)所示,顺铂药物治疗组裸鼠体重急剧下降,形体消瘦不健康;而对照组和MUC-1/Pt-SNAs 治疗组在治疗期间,体重和生存状态正常,并未发生明显变化.以上结果表明与游离顺铂药物相比,MUC-1/Pt-SNAs 因其具有靶向肿瘤细胞能力,能够更出色地抑制肿瘤增殖,与此同时大大降低了顺铂药物的毒副作用.
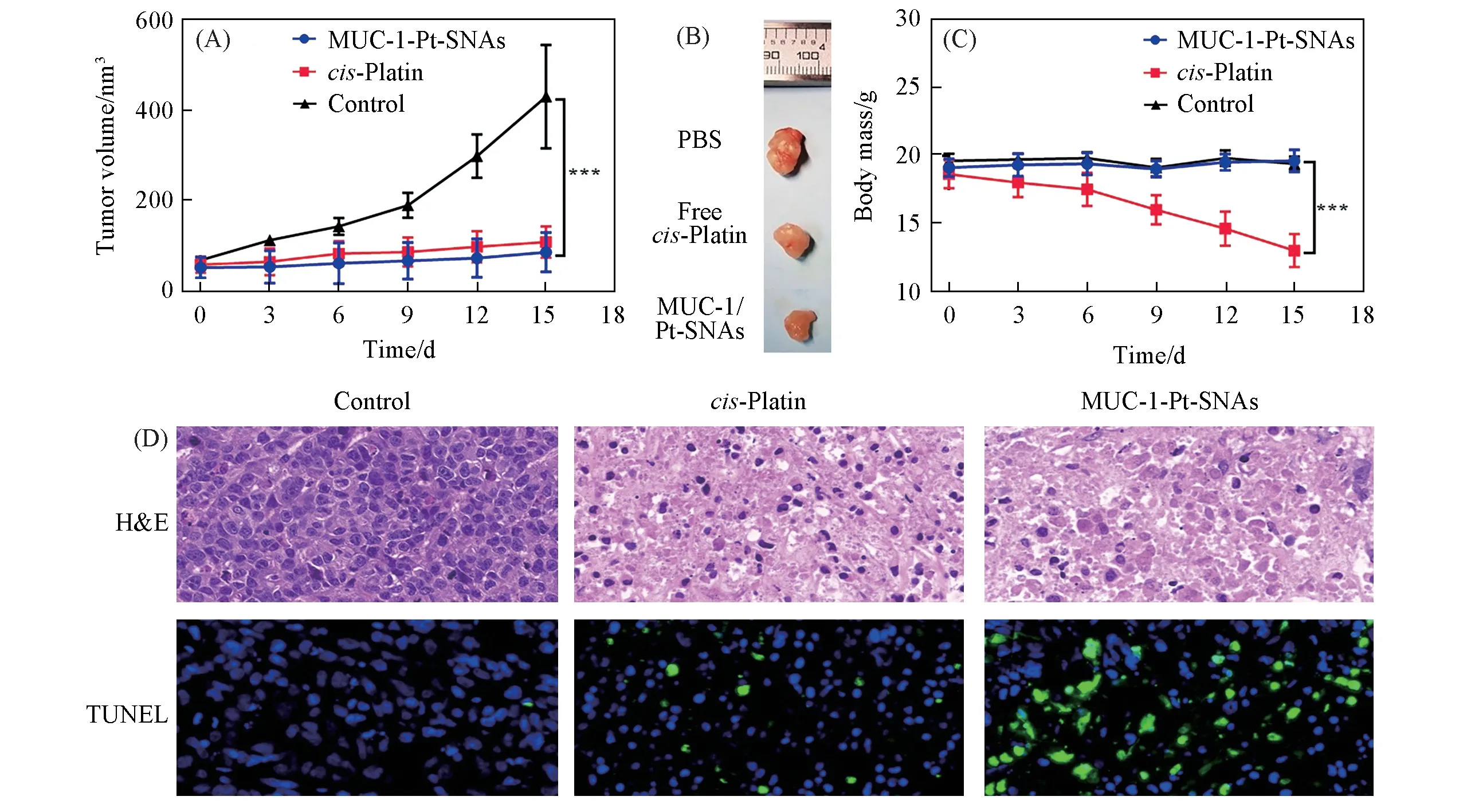
Fig.7 In vivo therapeutic efficacy of MUC-1-Pt-SNAs in the athymic nude mice bearing human breast cancer MCF-7 cells
此外,通过组织病理学和免疫荧光分析考察药物对小鼠器官和皮下肿瘤的细胞形态以及对肿瘤凋亡的影响.其中,用组织病理学表征治疗后各组器官和肿瘤细胞的形态变化,结果如图S11(见本文支持信息)所示,MUC-1/Pt-SNAs治疗组中心脏、肝脏、脾脏、肺和肾脏组织的细胞形态均没有明显损伤,证明了MUC-1/Pt-SNAs具有良好的安全性及低毒副作用.如图7(D)所示,MUC-1/Pt-SNAs和顺铂药物治疗组的肿瘤细胞中均出现明显的细胞核皱缩和空泡化现象,且MUC-1/Pt-SNAs治疗组细胞核皱缩数目比顺铂药物治疗组更多,而对照组的细胞核形态正常.原位末端转移酶标记(TUNEL)法可以标记凋亡细胞发出绿色荧光.由图7(D)可见,MUC-1/Pt-SNAs治疗组的肿瘤细胞核里呈现大量绿色荧光,而顺铂药物治疗组和对照组则较少.以上结果说明MUC-1/Pt-SNAs能有效诱导肿瘤细胞凋亡,抑制肿瘤细胞增殖,甚至比顺铂药物治疗效果更好,且对其它器官具有极低的毒副作用,这与前面体内治疗MCF-7细胞荷瘤裸鼠的肿瘤体积及体重变化结果一致.
3 结 论
构建了通过硫代磷酸酯修饰的嵌段DNA接枝Pt(Ⅳ)前药形成核酸-顺铂前药缀合物,进而自组装成类似球形核酸的新型铂类纳米药物递送系统MUC-1/Pt-SNAs.该球形核酸纳米药物MUC-1/Pt-SNAs生物相容性好,合成简单,载药率高达39.6%,具有较为均一的粒径,在模拟生理环境下具有较好的稳定性.MUC-1/Pt-SNAs 还具有还原响应性释放药物的特点,核酸适配体的引入赋予其优异的靶向性,使其能够高效靶向进入MUC-1 蛋白高表达的MCF-7 人乳腺癌细胞,减少了对正常组织细胞的毒副作用.细胞实验和动物实验均显示MUC-1/Pt-SNAs具有良好的抗肿瘤治疗效果,并且大大降低了顺铂药物的毒副作用.因此,该MUC-1/Pt-SNAs纳米药物递送系统在高效肿瘤靶向治疗领域具有潜在的应用前景.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20200283.
