解淀粉芽胞杆菌YU-1对水稻纹枯病的防治作用
2020-08-25郑少兵孙正祥徐梦亚
郑少兵 孙正祥 徐梦亚


摘要 本文旨在筛选对水稻纹枯病有生防作用的菌株,并初步探索其生防作用机理。收集水稻、甘蓝、黄瓜等不同植物根际土壤,采用稀释分离和对峙培养法筛选对水稻纹枯病菌Rhizoctonia solani Kühn有抑菌作用的菌株;通过离体接种防效、盆栽防效、抑菌谱、对水稻纹枯病菌菌核萌发及形成的抑制作用等方面评价其生防潜力,并对生防菌株进行鉴定。结果表明,从采集的37份根际土壤中共分离获得细菌297株,其中4株对纹枯病菌具有较好的拮抗作用,菌株YU-1对水稻纹枯病菌菌丝生长的抑制率达89.8%;对西瓜枯萎病菌、草莓灰霉病菌、番茄早疫病菌、油菜菌核病菌、小麦赤霉病菌菌丝生长的抑制率均在85%以上;对水稻纹枯病的离体和盆栽防效分别为73.1%和66.3%;对水稻纹枯病菌菌核萌发的抑菌率在92%以上;经生理生化和分子鉴定为解淀粉芽胞杆菌Bacillus amyloliquefaciens。由此可看出,菌株YU-1对水稻纹枯病的防治具有较强的应用价值,具有进一步开发成生物农药的潜力。
关键词 水稻纹枯病; 根际; 生防作用; 解淀粉芽胞杆菌
中图分类号: S 476.1
文献标识码: A
DOI: 10.16688/j.zwbh.2019141
Control effect of Bacillus amyloliquefaciens YU-1 on rice sheath blight
ZHENG Shaobing1,2, SUN Zhengxiang2*, XU Mengya2,3
(1. Guangxi Key Laboratory of Biology for Crop Disease and Insect Pests, Nanning 530007, China;
2. College of Agriculture, Yangtze University, Jingzhou 434025, China; 3. Laboratory of Microbial
Resources Collection and Preservation, Ministry of Agriculture and Rural Affairs, Beijing 100081, China)
Abstract
This study was aimed to discover bacterial strain with biocontrol activity against rice sheath blight (RSB) and preliminarily explore its biocontrol mechanism. The bacterial strains isolated from rhizosphere of rice, cabbage, cucumber et al., with strong antagonistic effects on Rhizoctonia solani Kühn(RS), were screened by confrontation culture. The biocontrol potential was evaluated by vitro inoculation, pot experiments, antagonistic spectrum, germination inhibition and sclerotium formation tests. The results showed that the inhibition activity of stain YU-1 on RS mycelia growth was 89.8%, and that on mycelia growth of watermelon wilt, strawberry grey mould, tomato early blight, rapeseed germ and wheat red mould was more than 85%. Control efficacies on RSB were 73.1% and 66.3% in vitro and pot tests, respectively. The germination inhibition on RS sclerotium was more than 92%. Based on physiological and biochemical characteristics and molecular naturalization identification, the strain YU-1 was identified as Bacillus amyloliquefaciens. These results showed that strain YU-1 had strong application value to control RSB and significant potential to be developed into biopesticide.
Key words
rice sheath blight; rhizosphere; biocontrol effect; Bacillus amyloliquefaciens
水稻是我國的主要粮食作物之一,由立枯丝核菌Rhizoctonia solani Kühn侵染引起的纹枯病是水稻的三大病害之一[1]。病原菌形成的菌核抗性强,在土壤里存活时间长,发病时可以借助植物叶片横向传播,具有土传和叶传特点[2]。该病害一般可造成减产10%~30%,较重时减产达50%[3]。目前生产中尚无高抗品种,主要采用己唑醇、三唑酮、苯醚丙环唑、噻呋酰胺等化学药剂防治,随着生态环保及抗药性问题逐渐受到关注,化学防治面临严峻的挑战[4]。继日本1968年发现有效霉素(validamyoin)后,1973年沈寅初等分离产validamyoin的链霉菌株被广泛用于水稻纹枯病的防治,每年的防治面积超过0.087亿hm2,但随着病原菌的抗药性增强,使用浓度虽逐年增加,防效却逐年下降[5]。
近年来,生防微生物在水稻纹枯病的防治上呈现出较大的潜力,已报道的生防菌以细菌为主,如:芽胞杆菌、土壤放射杆菌、假单胞杆菌等,其中研究较多的为芽胞杆菌[6]。陈志谊等报道枯草芽胞杆菌Bs-916对水稻纹枯病具有良好的防效,防治效果为50.0%~81.0%[7]。陈刘军等报道蜡质芽胞杆菌AR156对水稻纹枯病的室内防效达73.06%[8]。Kumar等从水稻根际分离出4株对纹枯病菌具有拮抗作用的枯草芽胞杆菌,田间试验结果表明,菌株UASP7在两个生长季分别使纹枯病发病率减少11.93%和4.17%[9]。Yang等从牛粪中分离出多黏类芽胞杆菌SB177,田间试验结果表明其培养滤液在2013年和2014年对纹枯病的防效分别为71.1%和94.2%[10]。
本研究从水稻、甘蓝、黄瓜等不同植物根际土壤中分离筛选对水稻纹枯病菌有抑制作用的生防细菌,并通过离体接种和盆栽试验对其生防效果进行评价,以期为水稻纹枯病的生物防治提供更多的菌源,为我国粮食产业的可持续发展奠定基础。
1 材料与方法
1.1 材料与菌种
水稻品种:‘武粳21(感病品种)。
病原菌:水稻纹枯病菌 R.solani、西瓜枯萎病菌 Fusarium oxysporum、草莓灰霉病菌 Botrytis cinerea、番茄早疫病菌 Alternaria solani,油菜菌核病菌 Sclerotinia sclerotiorum和小麦赤霉病菌 F.graminearum Sehw.均由本实验室保存。
供試药剂:95%申嗪霉素,由上海农乐生物制品股份有限公司提供。
PDA培养基、NA培养基和NB培养液的配方参照陈天寿[11]。
1.2 水稻纹枯病菌生防菌株的分离与筛选
分离:从湖北荆州采集水稻、甘蓝、黄瓜根际土,带回实验室保存,备用。称取土样10 g,加入90 mL灭菌水中,160 r/min振荡培养10 min,静置30 min,取上清液1 mL,加到盛有9 mL无菌水的试管中,振荡混匀,制成样品悬浮液。取1 mL样品悬浮液用无菌水依次进行10倍系列稀释,分别取10-5、10-6、10-7的稀释液50 μL涂布于NA平板,置于28℃培养24 h。根据菌落形态、大小、色泽等特点,挑取不同菌落,转接于NA平板上培养,保存备用。
初筛:将PDA平板培养2 d的水稻纹枯病菌接种于PDA平板中心,用灭菌的牙签将上述分离的细菌纯培养菌株呈三角状对称接入PDA平板,距离中心2 cm,28℃培养,观察对峙培养抑菌情况并记录抑菌圈大小。
复筛:将初筛抑菌作用明显的菌株接种于NB液体培养基中,28℃、130 r/min振荡培养48 h,12 000 r/min离心10 min,上清液用0.22 μm微孔滤膜过滤,获得无菌滤液。滤液以1∶10的比例(V/V)与45℃的PDA培养基混合,制成平板,平板中央接水稻纹枯病菌菌饼(直径为6 mm),以混入等量的NB培养液为对照,每个处理3次重复,28℃培养48 h,观察与记录菌落直径。
相对抑制率=(对照组菌落直径-处理组菌落直径)/对照组菌落直径×100%。
1.3 菌株YU-1的抑菌谱测定
参照上述复筛方法,测定菌株YU-1对西瓜枯萎病菌、草莓灰霉病菌、番茄早疫病菌、油菜菌核病菌、小麦赤霉病菌菌落生长的抑制作用。
1.4 菌株YU-1对水稻纹枯病的离体防效
采用叶片浸药法测定。选择等位且生长一致的健康水稻叶片,将其浸泡于菌株YU-1的悬浮液(OD600=1.0)中10 min,取出晾干后放置于水琼脂培养基中,再将PDA平板培养2 d的水稻纹枯病菌菌饼(d=6 mm)接入叶片中央,每皿3个叶片,设置5个处理:NB培养液、YU-1悬浮液、NB培养液+纹枯病菌、YU-1悬浮液+纹枯病菌、0.005%申嗪霉素(有效成分1% 悬浮剂)+纹枯病菌,每处理重复10次。置于30℃培养箱,当对照组(NB培养液+纹枯病菌)的叶片发病约90%时,观察并记录数据。
病斑分级标准[12]:0级,无病;1级,病斑面积占叶片面积的1/8以下;2级,病斑面积占叶片面积的1/8~1/4(不包括1/4);3级,病斑面积占叶片面积的1/4~1/2(不包括1/2);4级,病斑面积占叶片面积的1/2~3/4(不包括3/4);5级,病斑面积占叶片面积的3/4及以上。
病情指数=∑(各级病叶数×病级值)/(调查总叶数×最高级值)×100;
防治效果=(对照组病情指数-处理组病情指数)/对照组病情指数×100%。
1.5 菌株YU-1对水稻纹枯病的盆栽防效
将水稻种子(‘武粳21)浸泡24 h,置于25℃培养箱中保湿催芽,露白后播种于装有灭菌泥土的塑料盆中,定期浇水,20 d后移栽于塑料桶中,每桶栽种3 穴,每穴3株。将菌株YU-1用 NB培养液,于28℃,150 r/min振荡培养24 h,稀释至OD600=1.0,备用。选取分蘖末期长势一致的水稻植株,在等位置处以短牙签梗嵌入法接入纹枯病菌饼(d=6 mm)。随后喷雾菌株YU-1悬浮液,至叶片向下滴水为止。设置5个处理:NB培养液、YU-1菌悬液、NB培养液+纹枯病菌、YU-1悬浮液+纹枯病菌、0.005%申嗪霉素(有效成分1% 悬浮剂),每处理重复10次。每处理含有0.02%吐温80表面活性剂。每7 d喷施1次,连续喷施2次,21 d后调查与记录病斑长度。
按照0~9级标准记录病害严重度[13]。0级:健康无病害;1级:病斑面积小于叶鞘面积的1/4;3级:病斑面积占叶鞘面积1/4~1/2(不包括1/2);5级:病斑面积占叶鞘面积的1/2~3/4(不包括3/4);7级:病斑面积大于等于叶鞘面积的3/4;9级:病斑到达植株顶部,所有叶片被严重侵染。
病情指数=∑(各级病株数×病级值)/(调查总株数×最高级值)×100;
防治效果=(对照组病情指数-处理组病情指数)/对照组病情指数×100%。
1.6 菌株YU-1对水稻纹枯病菌菌核萌发及形成的影响
1.6.1 菌株YU-1对水稻纹枯病菌菌核萌发的影响
将长势一致的水稻纹枯病菌菌核置于生防菌YU-1发酵液(OD600=1.0)中浸泡1 h,在超净工作台中彻底风干后转接至PDA平板中,每皿4个菌核,以NB液体浸泡1 h为对照,每处理10次重复。28℃培养,每隔12 h测量并记录菌核萌发形成菌落的直径,以菌落直径≥8 mm视为萌发,8 mm以下视为未萌发。
抑菌率=(对照菌核萌发数-处理菌核萌发数)/对照菌核萌发数×100%。
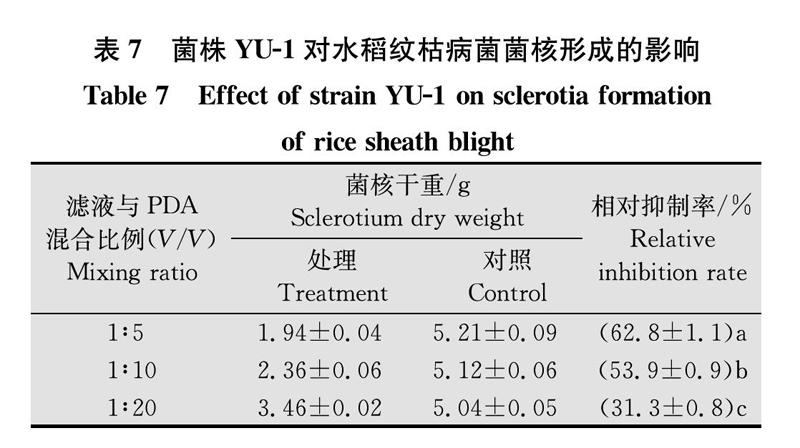
1.6.2 菌株YU-1对水稻纹枯病菌菌核形成的影响
将菌株YU-1单菌落接种于30 mL NB 液体培养基中150 r/min, 28℃振荡培养2 d,取适量细菌发酵液(OD600=1.0),10 000 r/min离心5 min,上清液用细菌滤膜(孔径0. 22 μm)除菌,获得无菌滤液,放于4℃冰箱备用。按1∶5,1∶10,1∶20的体积比例分别与PDA培养基混匀,倒入培养皿制成平板。以无菌NB培养液为对照。将纹枯病菌菌饼(d=6 mm)接种于各处理平板中央,25℃培养,每处理10次重复。待7 d后用镊子从平板中取出各处理形成的菌核,烘干,称量干重。
1.7 菌株YU-1的鉴定
1.7.1 菌株YU-1的形态及生理生化特征
生理生化特征鉴定按东秀珠等方法进行[14]。
1.7.2 菌株YU-1的分子鉴定
参照Lane的方法[15],提取菌株YU-1的基因组DNA并对其16S rDNA进行特异性扩增,引物为27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-TACGGCTACCTTGTTACGACT-3′。PCR反应体系(20 μL)为:模板 DNA 1.5 μL,引物(50 pmol/μL)各1 μL,TaqTM 1.5 μL,Mg2+(25 mmol/L)2 μL,10× buffer 2 μL,dNTPs (10 mmol/μL)0.5 μL,加超纯水补足至20 μL。PCR扩增条件:预变性94℃ 10 min;94℃变性 1 min,55℃退火1 min,72℃延伸1 min,30个循环;72℃延伸10 min。gyrB特异性扩增条件参照Yamamoto的方法[16],引物为Up-1:5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′;Up2r:5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNCRTCNGTCAT-3′。PCR产物测序由华大基因完成。用BLAST软件将所得序列与GenBank中已报道的序列进行同源性比较。
1.8 数据处理与统计分析
所有数据经Excel整理后,采用SPSS 20.0对不同处理进行统计分析,均值采用Duncan氏新复极差法(Duncans new multiple range test)进行多重比较。
2 结果与分析
2.1 水稻纹枯病生防菌株的分离
从湖北荆州采集水稻、甘蓝、黄瓜、西瓜等根际土样37份,采用土壤稀释分离法,共分离获得细菌297株,保存备用。
2.2 水稻纹枯病生防菌株的筛选
2.2.1 初筛
以水稻纹枯病菌为靶标菌,采用平板对峙培养,对分离获得的菌株进行初筛,结果如表1所示,从中可看出,菌株YU-1、YU-2、YU-3、YU-4对水稻纹枯病菌的抑菌作用显著,抑菌圈直径在20 mm以上。
2.2.2 复筛
采用混药平板法,将初筛抑菌圈直径在20 mm以上的菌株进行复筛,结果如图1,表2所示,从中可看出,菌株YU-1对水稻纹枯病菌菌落生长的抑制作用最为显著,达89.8%。
2.3 菌株YU-1的抑菌谱测定
菌株YU-1对西瓜枯萎病菌、草莓灰霉病菌、番茄早疫病菌、油菜菌核病菌、小麦赤霉病菌菌丝生长有明显的抑制作用(图2)。菌株YU-1对上述几种病原真菌抑制率均在85%以上(表3)。
2.4 菌株YU-1对水稻纹枯病的离体防效
菌株YU-1对水稻纹枯病的离体防效如表4和图3所示,从中可看出:菌株YU-1对水稻叶片无致病作用,和申嗪霉素对水稻纹枯病均有较好的离体
防效,分别为73.1% 和71.4%。
2.5 菌株YU-1对水稻纹枯病的盆栽防效
菌株YU-1对水稻纹枯病的盆栽防效结果如表5所示:菌株YU-1对水稻植株无致病作用,和申嗪霉素对水稻纹枯病均有较好的盆栽防效,分别为66.3%和64.7%。
2.6 菌株YU-1对水稻纹枯病菌菌核萌发及形成的影响
2.6.1 菌株YU-1对水稻纹枯病菌菌核萌发的影响
将水稻纹枯病菌菌核置于菌株YU-1发酵液中浸泡1 h,在超净工作台中风干后转接至PDA平板中,以在NB液体中浸泡为对照。28℃培养,每隔12 h观察并计算菌核萌发抑制率,结果如表6所示:菌株YU-1在处理后48 h内对水稻纹枯病菌菌核萌发具有较强的抑制作用,抑菌率均在92%以上。
2.6.2 菌株YU-1對水稻纹枯病菌菌核形成的影响
将菌株YU-1的无菌滤液按1∶5, 1∶10, 1∶20(V/V)分别与PDA 培养基混匀,倒入培养皿,制成平板,以混入无菌NB培养液为对照。将纹枯病菌接入各处理平板中央,25℃培养,7 d后称取菌核干重,计算相对抑制率,结果如表7和图4所示:菌株YU-1对水稻纹枯病菌菌核形成具有一定的抑制作用,当混合比例为1∶5时,相对抑制率可达62.8%。
2.7 菌株YU-1的鉴定
2.7.1 形态及生理生化特征
菌株YU-1在NA平板上菌落圆形,淡黄色,不透明,边缘不规则,革兰氏呈阳性,细胞形态杆状,产芽胞,接触酶和氧化酶反应均为阳性。利用碳水化合物产酸试验:淀粉水解、水解酪素及水解明胶均为阳性,甲基红试验呈阴性,柠檬酸利用试验呈阳性。
2.7.2 分子鉴定
菌株YU-1的16S rDNA和gyrB序列片段大小分别为1 386 bp和1 259 bp,用BLAST软件进行相似性比较,与GenBank中核苷酸数据的对比结果表明菌株YU-1与解淀粉芽胞杆菌Bacillus amyloliquefaciens的相似性为100%。
3 讨论
近些年,随着矮杆多蘖品种的推广,水稻密集型的栽培模式,以及氮肥施用量的不断增加,水稻纹枯病的发生逐年加重,在我国稻区已成为危害最严重的病害之一。化學药剂的长期使用,不仅破坏生态环境,而且危害人类健康,科研工作者将研究方向转向新型绿色生物农药的开发创制。
植物根际微生物数量庞大,种类繁多,有些微生物在促进植物生长,提高植物抗病性中发挥重要功能。宋金秋等报道绞股蓝的9株根际细菌都具有分泌IAA的能力,其中3株对猕猴桃致病菌丁香假单胞菌具有很好的抑菌作用[17]。本研究从水稻根际土壤中分离获取的菌株YU-1能明显抑制纹枯病菌的生长,同时对多种病原菌具有抑菌作用,在离体和盆栽中的防效分别为73.1%和66.3%,但是否具有促生作用有待进一步研究。
菌核是水稻纹枯病的主要侵染源,在病害的发生发展中起着重要作用。本研究中的菌株YU-1不仅能抑制菌核的萌发还能抑制菌核的形成,从来源上减少水稻纹枯病的发生。李松鹏等报道的两株木霉菌株3S1-13和4S2-46发酵液对水稻纹枯病的防治效果均达到75%以上,本研究结果与其一致[18]。
已有研究结果表明,芽胞杆菌防治植物病害的作用机制主要包括拮抗作用,营养和生态位竞争,诱导植物抗病性[19]。张荣胜等报道解淀粉芽胞杆菌Lx-11对水稻植株的生长具有明显的促进作用,且促生长物质主要存在于发酵上清液中[20]。程敏等报道解淀粉芽胞杆菌CGMCC 11640对核桃干腐病菌的抑菌率可达94.3%,其通过破坏病原菌菌丝和孢子细胞壁、细胞膜,使细胞内原生质泄漏,导致菌丝和孢子萎缩,最终杀死病原菌细胞[21]。本研究分离获得的解淀粉芽胞杆菌YU-1对水稻纹枯病菌具有拮抗作用,其作用机理还有待于进一步深入研究。
参考文献
[1] SLATON N A, CARTWRIGHT R D, MENGJIE, et al. Sheath blight severity and rice yield as affected by nitrogen fertilizer rate, application method and fungicide [J]. Agronomy Journal, 2003, 95: 1489-1496.
[2] 王伟, 杨惠, 王政逸, 等. 在水稻纹枯病菌菌核形成中5个基因的表达差异分析[J]. 浙江大学学报(农业与生命科学版), 2013, 39(1): 18-25.
[3] LEE F N, RUSH M. Rice sheath blight: A major rice disease [J]. Plant Disease, 1983, 67: 829-833.
[4] PENG Di, LI Shandong, WANG Jianxin, et al. Integrated biological and chemical control of rice sheath blight by Bacillus subtilis NJ-18 and validamycin [J]. Pest Management Science 2014, 70: 258-263.
[5] 沈寅初. 井冈霉素研究开发二十五年[C]∥叶正楚,张芝利.全国生物防治学术讨论会论文摘要集, 1995.
[6] KAZEMPOUR M N. Biological control of Rhizoctonia solani, the causal agent of rice sheath blight by antagonistic bacteria in greenhouse and field conditions [J]. Plant Pathology Journal, 2004, 3(2): 88-96.
[7] 陈志谊, 高太东, 严大富, 等. 枯草芽胞杆菌 Bs-916 防治水稻纹枯病的田间试验[J]. 中国生物防治, 1997, 13(2): 75-78.
[8] 陈刘军, 愈仪阳, 王超, 等. 蜡质芽胞杆菌AR156防治水稻纹枯病机理初探[J]. 中国生物防治学报, 2014, 30(1): 107-112.
[9] KUMAR M K P, AMRUTA N, MANJULA C P, et al. Characterisation, screening and selection of Bacillus subtilis isolates for its biocontrol efficiency against major rice diseases [J]. Biocontrol Science and Technology, 2017, 27(4): 581-599.
[10]YANG Jinghui, ZHANG Wenwen, ZHUANG Yiqing, et al. Biocontrol activities of bacteria from cowdung against the rice sheath blight pathogen [J]. Journal of Plant Diseases and Protection, 2017, 124: 121-141.
[11]陈天寿. 微生物培养基的制造与应用[M]. 北京: 中国农业出版社, 1995.
[12]WIWATTANAPATAPEE R, CHUMTHONG A, PENGNOO A, et al. Preparation and evaluation of Bacillus megaterium alginate microcapsules for control of rice sheath blight disease [J]. World Journal of Microbiology and Biotechnology, 2013, 29(8): 1487-1497.
[13]IRRI. Standard evaluation system for rice [M]. Philippines: International Rice Research Institute, 1980.
[14]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.[15]LANE D J. 16S/23S rRNA sequencing [C]∥STACKEBRANDT E, GOODFELLOW M. Nucleic acid techniques in bacterial systematics. UK, Chichester: John Wiley & Sons, 1991: 115-175.
[16]YAMAMOTO S, HARAYAMA S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of pseudomonas putida strains [J]. Applied and Environmental Microbiology, 1995: 61(3): 1104-1109.
[17]宋金秋, 刘淑娇, 崔丽红, 等. 根际细菌溶磷、产 IAA 及其抑菌作用的研究[J]. 基因組学与应用生物学, 2017, 36(11): 4722-4728.
[18]李松鹏, 崔琳琳, 程家森, 等. 两株哈茨木霉菌株防治水稻纹枯病及促进水稻生长的潜力研究[J]. 植物病理学报, 2018, 48(1): 98-107.
[19]JIANG Chunhao, YAO Xiefeng, MI Dandan, et al. Comparative transcriptome analysis reveals the biocontrol mechanism of Bacillus velezensis F21 against Fusarium wilt on watermelon [J/OL]. Frontiers in Microbiology, 2019, 10: 652. DOI: 10.3389/fmicb.2019.00652.
[20]张荣胜, 戴秀华, 刘永锋, 等. 解淀粉芽胞杆菌Lx-11的促水稻生长作用及促生长物质分析[J]. 核农学报, 2018, 32(6): 1230-1238.
[21]程敏, 徐秋芳. 解淀粉芽胞杆菌植物亚种CGMCC 11640对山核桃干腐病菌的抑制机制[J]. 浙江农林大学学报, 2017, 34(2): 326-331.
(责任编辑:杨明丽)
