Wolbachia对土耳其斯坦叶螨生殖影响的转录组测序分析
2020-08-25张燕娜赵倩赵伊英
张燕娜 赵倩 赵伊英
摘要 为进一步探索内共生菌Wolbachia对土耳其斯坦叶螨生殖调控的影响,本试验筛选出完全感染Wolbachia和完全不感染的土耳其斯坦叶螨品系进行转录组测序。结果表明:感染Wolbachia后,叶螨体内一些与生殖相关的基因发生明显变化,其中3 810个基因在雌成螨中受到影响,2 885个基因在雄成螨中受到影响;其中一些参与脂质转运、氧化还原反应、消化及解毒作用的基因具有明显的性别特异性。这为内共生菌Wolbachia引起宿主生殖调控提供了新的理论依据。
关键词 土耳其斯坦叶螨; Wolbachia; 转录组; 生殖调控
中图分类号:
S 476
文献标识码: A
DOI: 10.16688/j.zwbh.2018389
Transcriptome sequencing and analysis of the effects of Wolbachia on the
reproduction of Tetranychus turkestani
ZHANG Yanna, ZHAO Qian, ZHAO Yiying*
(College of Agriculture, Shihezi University, Shihezi 832000, China)
Abstract
To further explore the effects of endosymbiotic bacteria Wolbachia on reproduction of Tetranychus turkestani, the completely single-infected and uninfected T.turkestani lines were established and their transcriptomes were sequenced. The results showed that after infection with Wolbachia, some genes related to reproduction in the mites showed significant change, in which 3 810 genes were affected in female adult mites and 2 885 genes were affected in male mites. Some of the genes involved in lipid transport, redox reaction, digestion and detoxification were closely related to gender specific. Our study provides a new theoretical basis for the host reproductive regulation by Wolbachia.
Key words
Tetranychus turkestani; Wolbachia; transcriptome; reproductive regulation
内共生菌广泛分布于昆虫体内,如头、胸、腹、唾液腺、消化道等[1];其分布受许多因素影响,胚胎发育过程是最主要的因素之一[2]。昆虫与体内共生菌形成密切的互利共生关系[3],内共生菌不仅能为宿主昆虫提供多种必需营养物质[4-5],保护宿主免受病原菌侵害,抵御病原微生物侵染[6],还能通过调节宿主耐热性、抗药性及改变体色等途径提高昆虫对环境的适合度[7-9]。由此可见,内共生菌是调控宿主昆虫新陈代谢及生物学性状的重要因子。
Wolbachia是自然界迄今为止分布最广泛的内共生菌,约有65%的昆虫受其感染[10-11]。作为生殖调控因子,Wolbachia可诱导胞质不亲和性(CI),即被Wolbachia感染的雄性个体与未感染的雌性个体或感染不同株系Wolbachia的雌性个体交配后不能或很少产生后代,或者后代偏雄性的现象; 或通过孤雌生殖或杀雄作用来提高后代雌虫比例,影响种群动态[12-14]。研究已经证实感染Wolbachia后,在黑腹果蝇Drosophila melanogaster幼虫睾丸中发现与生殖有关的基因发生了下调,Wolbachia還可使黑腹果蝇产生对RNA病毒的抗性[15-16]。土耳其斯坦叶螨Tetranychus turkestani是新疆棉田的重要害螨[17-18],其体内Wolbachia可以诱导宿主产生胞质不亲和作用[19-20],还可以通过增加雌性繁殖力来影响土耳其斯坦叶螨的适合度[21]。
在本研究中,我们通过比较感染和未感染Wolbachia的雌成螨和雄成螨的转录组测序数据,探究Wolbachia对宿主生殖调控的影响。发现Wolbachia影响叶螨许多基因的表达,包括氧化还原、消化解毒和繁殖等的基因。研究结果为节肢动物和内共生菌之间复杂的相互作用提供了新的见解。
1 材料和方法
1.1 试验叶螨的饲养及样品收集
土耳其斯坦叶螨:2016年6月采自石河子大学农学院试验站试验田,在石河子大学昆虫生理实验室光照培养箱(25℃,L∥D=16 h∥8 h,RH 60%)中用豇豆Vigna sinensis饲养至今,饲养过程中未接触任何药剂。
1.2 土耳其斯坦叶螨Wolbachia感染情况检测
土耳其斯坦叶螨总DNA的提取采用苗慧等[22]的方法:挑取单头健壮雌成螨置于装有25 μL STE缓冲液(100 mmol/L NaCl,10 mmol/L Tris-HCl,1 mmol/L EDTA,pH=8.0)的1.5 mL离心管内,用塑料碾槌充分碾碎,然后加入2 μL蛋白酶K(10 mg/mL),以上过程均在冰上完成。然后将离心管于37℃孵育30 min,95℃初始变性5 min,离心1~2 min后,-20℃保存或取2 μL作为PCR反应的模板,立即进行PCR扩增。
设计Wolbachia的wsp基因特异性引物WSP/F236(5′-GACAGTTTAACAGCATTTTCAGGA-3′)和WSP/R44(5′-GTTTGATTTCTGGAGTTACATCAT-3′),
DNA扩增条带为211 bp
。反应总体系为25 μL:2 μL DNA模板,14.8 μL ddH2O,2.5 μL 10×buffer,1.5 μL MgCl2,
2.0 μL dNTPs,
0.2 μL Taq DNA聚合酶,上、下游引物各1 μL; 扩增条件: 94℃ 预变性2 min;94℃ 30 s,55℃ 45 s,72℃ 45 s,35个循环;72℃延伸5 min。取PCR产物15~20 μL,用0.5%的琼脂糖凝胶电泳检测,Bio-RadGel DocEQ凝胶成像系统下观察结果。
1.3 土耳其斯坦叶螨品系筛选
采用苗慧等[22]的方法筛选感染Wolbachia的土耳其斯坦叶螨品系:在装有海绵的培养皿中(直径9 cm)放入完整的新鲜四季豆叶片,根据叶片大小用湿润脱脂棉条将其划分成3~5个面积近似的小室。从实验室品系中挑取静Ⅲ态未经过交配的雌螨放入小室中单独培养,使其进行产雄孤雌生殖,待后代雄螨发育为成螨后,将母体与其雄螨后代回交。回交2 d后,将母体转移到新的小室中产卵,7 d后对母体进行PCR检测。将感染Wolbachia的雌螨所产的后代重复以上步骤3~5代后,挑取50头左右进行PCR,检测Wolbachia感染率,达到全部感染用于后续测序试验。
抗生素处理筛选不感染Wolbachia的品系:挑取土耳其斯坦叶螨新孵化的幼螨(尚未进食,近白色)放在特制的玻璃皿里,用0.3%的四环素溶液饲喂48 h。在装有海绵的培养皿中(直径9 cm)放入完整新鲜四季豆叶片,四周围上湿润的脱脂棉条防止叶螨逃逸。将处理后的幼螨挑到叶片上,使其自然生长并繁殖后代。以后每日向培养皿中加入蒸馏水以保持海绵的湿润,并及时更换新鲜的叶片。幼螨成熟后,挑取50头左右进行PCR,检测Wolbachia的感染情况,若全部个体均不感染Wolbachia,则将该品系后代继续培养3至5代,用于后续测序试验。
1.4 供试样品转录组测序
收集感染和不感染Wolbachia的土耳其斯坦叶螨雌螨(分别编号为A_W_F和A_F,F表示雌性;W代表Wolbachia)及雄螨(编号为A_W_M和A_M,M表示雄性),3次重复。样品收集好后,快速置于液氮中,用于后续试验。采用天根TRNzol Universal总RNA提取试剂(DP431)提取供试土耳其斯坦叶螨总RNA,步骤参考说明书。转录组测序工作委托北京诺禾致源生物科技有限公司完成。
1.5 实时荧光定量PCR鉴定
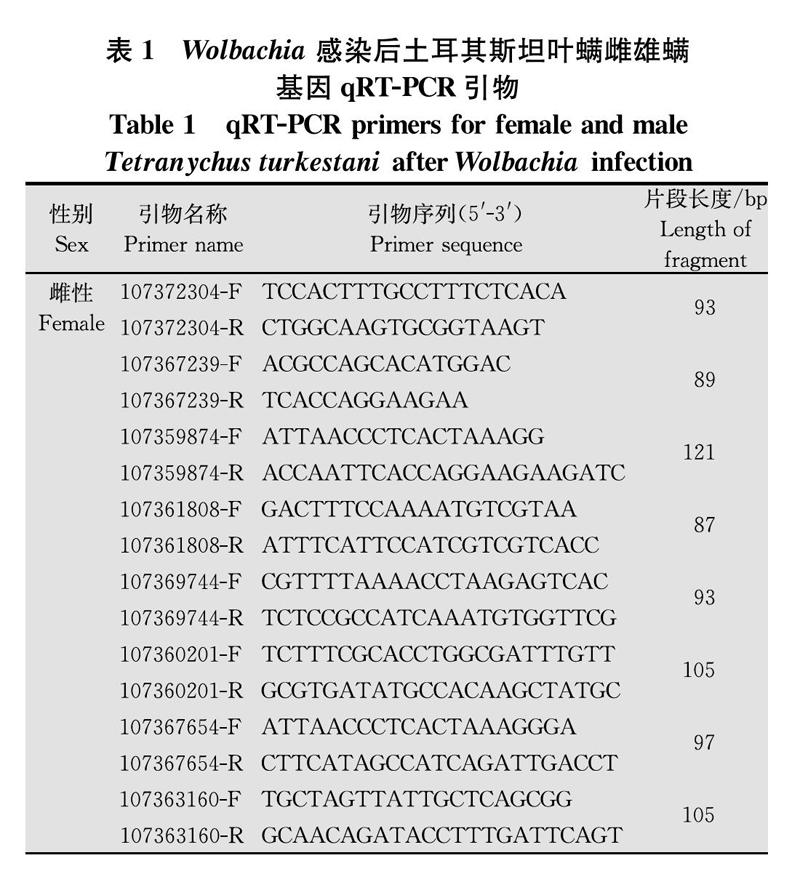
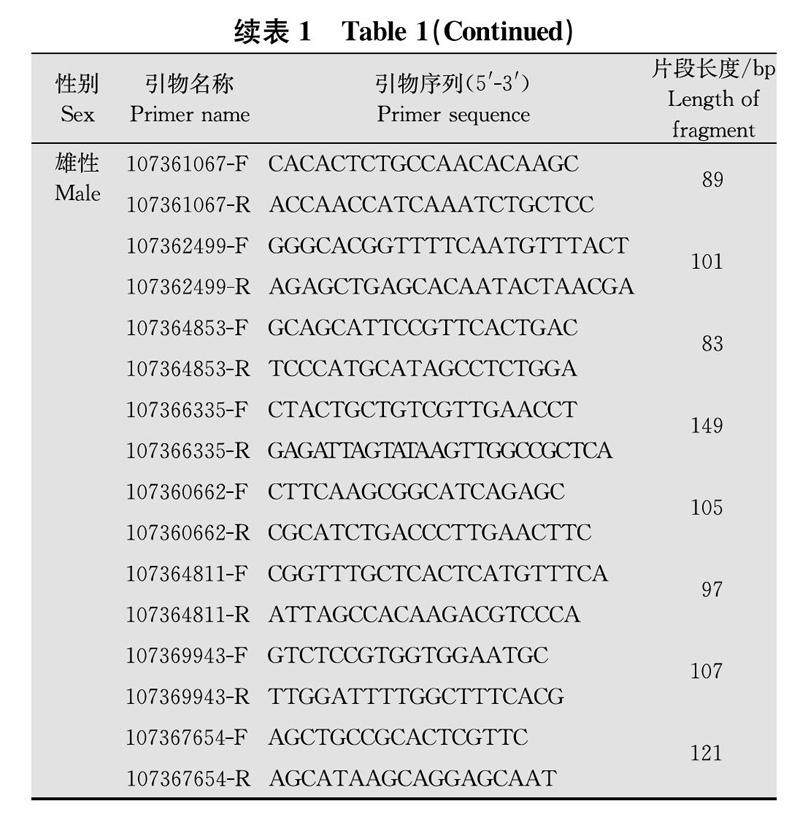
为了检测RNA-Seq分析的准确性,根据转录组测序数据筛选基因序列,利用Primer Premier 5进行引物设计及验证(表1),将提取的供试材料RNA通过TaKaRa公司Prime ScriptTM 1st Strand cDNA Synthesis Kit反转录获得cDNA第一链,取5 μL合成产物稀释10倍用于试验,根据TaKaRa公司SYBR Premix Ex TaqTM(商品编号为DRR420S)说明书进行荧光定量PCR反应(ABI 7300),每个反应重复3次。使用2-ΔΔCT方法计算相对表达量[23]。
2 结果与分析
2.1 有参转录组测序结果分析
利用Illumina测序技术对感染Wolbachia和未感染Wolbachia的土耳其斯坦叶螨的雌成螨和雄成螨分别进行转录组测序。感染Wolbachia的雌成螨平均获得24 117 129 clean reads,比对到参考基因组的reads数目为40 957 849,占clean reads的84.91%,比对到参考基因组唯一位置的reads数目为39 924 187,占所有reads的82.78%, GC平均含量为36.93%。感染Wolbachia的雄成螨平均获得21 783 386 clean reads,比对到参考基因组的reads数目为35 671 706,占clean reads的81.89%,比对到参考基因组唯一位置的reads数目为34 743 136,占所有reads的79.75%, GC平均含量为36.24%(表2)。
2.2 差异表达基因的GO分析
GO功能分类发现,在雌成螨中感染Wolbachia 品系变化明显的主要有以下几个方面: 生物过程中的细胞蛋白质代谢过程、病毒-宿主交互作用、磷酸盐化合物代谢过程及应激反应;分子功能中的氧化还原酶活性、RNA结合、转移酶活性及核苷酸结合蛋白(图1a)。在感染Wolbachia的雄成螨中包括生物过程中的有机氮化合物代谢过程、转运和肽生物合成;分子功能中为参与
氧化还原过程的GTP酶活性、锌离子结合及核苷酸结合(图1b)。在整个感染过程中,雌成螨和雄成螨都做出了相应的应激反应。
2.3 差異表达基因KEGG富集分析
对差异表达基因进行KEGG通路分类注释,并对感染Wolbachia的雌雄螨的差异表达基因富集度最高的10个通路进行比较,结果表明: 在雌成螨中,Wolbachia感染品系中的差异表达基因主要集中到80个KEGG途径,其中显著富集的代谢途径主要涉及核糖体、氧化磷酸化、吞噬和RNA转运等(图2a)。在雄成螨中,差异表达基因主要集中到81个KEGG途径,其中显著富集的代谢途径主要涉及蛋白酶体、吞噬、RNA转运、蛋白质输出、MAPK信号通路及mRNA监测途径(图2b)。
2.4 差异表达基因筛选
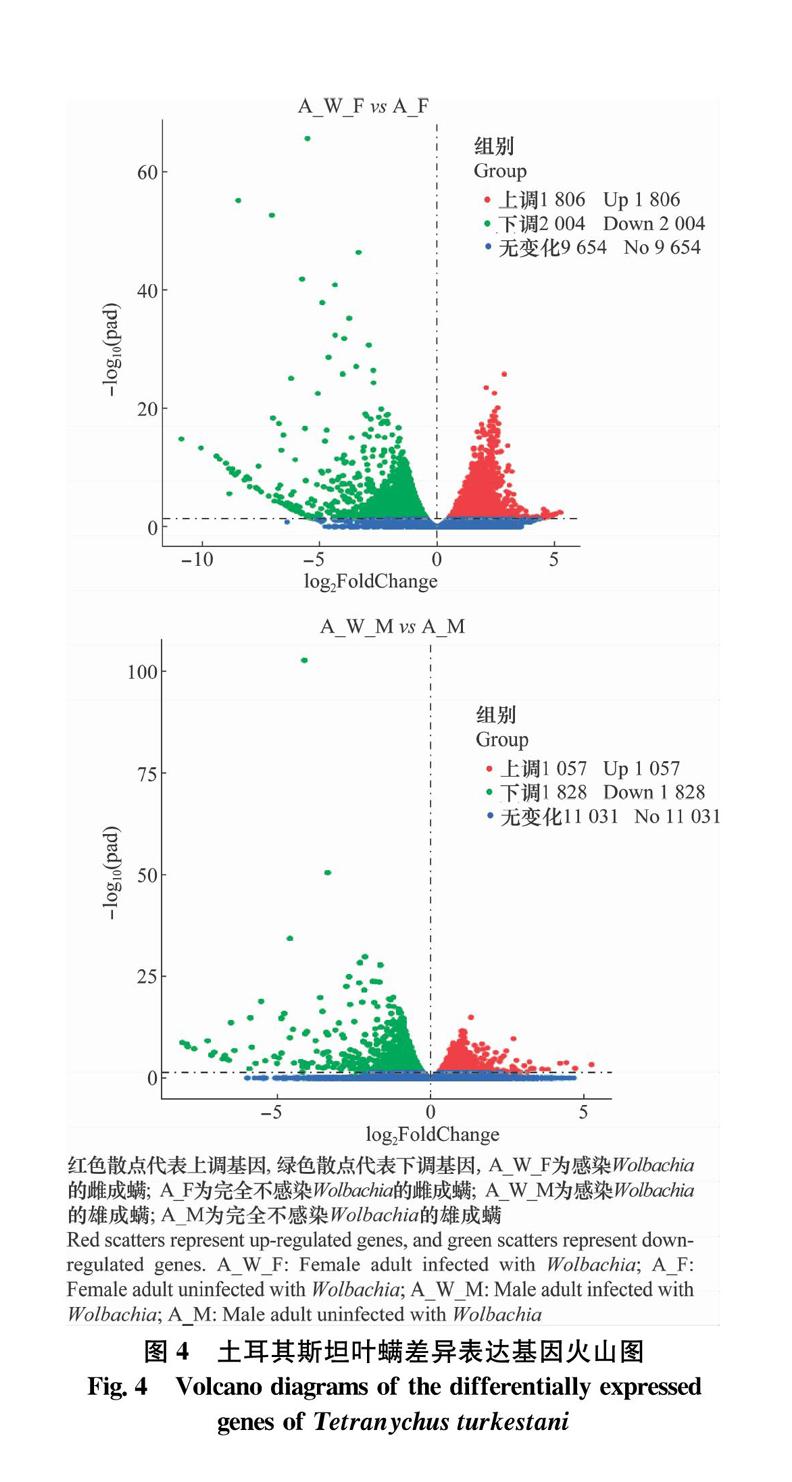
以不同试验条件下的差异表达基因的FPKM值为表达水平,进行层次聚类(hierarchical clustering)分析,不同颜色的区域代表不同的聚类分组信息,同组内的基因表达模式相近,可能具有相似的功能或参与相同的生物学过程,结果显示,基因表达都是特异性的,A_W_M与A_M及A_W_F与A_F之间的比较表明,每一个文库都有独特的转录变化(图3),这表明有许多基因受到了内共生菌Wolbachia的影响,尽管不能排除在筛选完全不感染Wolbachia品系过程中残留的抗生素引起的基因差异。
对样本cluster后的unigene进行差异表达分析。以log2FoldChange>1且P<0.05为标准进行样本间的差异表达基因筛选,完全单感染Wolbachia的雌成螨和完全不带菌的雌成螨相比上调表达的基因有1 806个,下调表达基因有2 004个;完全单感染Wolbachia和完全不带菌的雄成螨相比有1 057个基因上调表达,1 828个基因下调表达(图4)。
为深入了解内共生菌Wolbachia对叶螨的影响,我们将变化明显的差异表达基因列表分析(表3)。已知细胞色素P450、谷胱甘肽S-转移酶及ABC转运蛋白是叶螨体内最常见的几种解毒代谢基因,受Wolbachia感染后的雌成螨中有4种P450,雄成螨中有6种P450,它们大多数为上调表达。3个谷胱甘肽S-转移酶基因在雌成螨中全部为上调表达,而在雄成螨中编码谷胱甘肽S-转移酶基因(107360606)为下调表达。4个ABC转运蛋白基因在雌(novel.5873、novel.11318、107366618和107362311)、雄螨(107366618和107362311)中均为下调表达。
脂质运载蛋白(lipocalin)是能够结合疏水性的小分子蛋白质,受Wolbachia感染后雌雄螨中全部表现为下调表达(雌性中4个,雄性中2个; 表3)。一些与生殖功能相关的基因如组蛋白基因、编码卵黄蛋白的基因(107370220)、innexin inx2(107366133、107365265等)、附睾分泌蛋白(107365091、107365137等)、cathepsin(107371482、107364383等)等受内共生菌Wolbachia感染后发生了明显的上调或下调变化,这可能影响了卵子或胚胎的形成。
2.5 差异表达基因的qRT-PCR荧光定量分析
随机筛选雌雄螨各8个差异表达基因(上调5个,下调3个)采用荧光定量PCR验证RNA-Seq测序结果。结果显示,实时荧光定量PCR与转录组测序的结果在基因表达变幅上有一定的差异,但基因的表达趋势是一致的(图5),验证了转录组测序结果的可靠性。
3 讨论
Wolbachia是广泛存在于节肢动物体内的共生细菌,可通过宿主卵的细胞质进行母系遗传,并且能够通过不同的方法调控寄主的生殖,实现其在宿主种群中的稳定存在和传播。有研究表明Wolbachia可以在分子水平和细胞水平上与其宿主之间进行相互作用,诱导宿主强胞质不亲和性,并提高雌性的繁殖力[21-24]。Wolbachia增加了D.mauritiana的繁殖力和生殖系干细胞的有丝分裂活性,并减少了卵巢中的程序性細胞死亡[25],Wolbachia诱导的胞质不亲和性强度随着雄性年龄和幼虫阶段发育显著降低[26]。本研究中,我们选取完全感染Wolbachia和完全不感染Wolbachia的土耳其斯坦叶螨作为试验材料,挑选1日龄的雌成螨和雄成螨进行转录组测序,结果显示:与卵子或精子形成相关的基因,如组蛋白基因、卵黄蛋白基因、组织蛋白酶B等发生了明显的变化。卵黄原蛋白(vitellogenin, Vtg)作为卵黄蛋白(yolk protein, YP)的前体参与卵生动物的卵子发生。卵黄蛋白对于卵母细胞的生长和分化以及将金属离子、脂质和维生素运送到卵母细胞中起重要作用[27-28]。受Wolbachia感染之后,雌成螨中编码卵黄原蛋白的基因(107370220)发生了明显的下调,推测其可能在增强雌性的生殖力方面起作用。
组蛋白磷酸化是组蛋白氨基酸残基的磷酸化修饰,是一类重要的翻译后修饰,与有丝分裂和减数分裂的染色质压缩、染色质功能调节、转录的激活与抑制、DNA 损伤修复以及物质代谢等多种机制相关[29]。本研究发现,感染Wolbachia的雄成螨中编码组蛋白H2B的基因(107360201,log2FC-5.10)发生了显著下调。组蛋白 H2B 主要以变异体 TH2B 和 H2BFW 形式特异地存在于雄性生殖细胞系中,体细胞系中没有变异体,其可能参与调控特殊染色质区域的基因转录。潘晓燕等[30]和Lu等[31]在小鼠精子发生不同阶段检测到了睾丸特异组蛋白 TH2B 的第 116 位苏氨酸的磷酸化。研究证实, TH2B 磷酸化在减数分裂后染色质折叠和压缩过程中发挥了直接的调控作用。而感染Wolbachia的雄成螨,编码组蛋白 H2B的基因表达量大幅下调,可能会影响雄性精子的生成。H3.3 是重要的母源因子,在正常受精后精子的重编程以及体细胞核移植后供体细胞核的重编程过程中起重要作用。在正常受精过程中,H3.3 能替换精子中的鱼精蛋白,将其重编程为雄原核[32]。感染Wolbachia的雌雄成螨中编码组蛋白H3.3的基因发生了明显的变化,也有可能引起雄性不育现象的发生。
Inx 基因在动物体内的分布比较广,Inx2在控制果蝇胚胎前肠的发育等方面发挥着重要作用[33]。Lehmann 等[34] 的研究表明,Inx2蛋白和 Inx3 蛋白在膜上的分布和定位相互影响,当沉默 Inx2 基因的表达时,Inx3 蛋白会在细胞中积累并分布紊乱,反之亦然。Inx2和Inx3基因协同表达后通过细胞内的C端功能域相互作用形成异聚化的 Inx2∶Inx3 通道,这对果蝇胚胎上皮组织发育和胚胎表皮极性形成起着关键作用。如果Inx2 或 Inx3 发生突变,会导致表皮上有大的皮孔形成,极端情况下甚至导致外皮的缺失。感染了Wolbachia后,雌雄成螨中Inx2发生了不同程度的上调或下调变化,而Inx3都趋于稳定,这将导致Inx2∶Inx3的比例不平衡,影响胚胎的正常发育。
[7] CHEN Deqiao, MONTLLOR C B, PURCELL A H. Fitness effects of two facultative endosymbiotic bacteria on the pea aphid, Acyrthosiphon pisum and the blue alfalfa aphid,A.kondoi [J]. Entomologia Experimentalis et Applicata,2000,95(3):315-323.
[8] OLIVER K M, DEGNAN P H, BURKE G R, et al. Facultative symbionts in aphids and the horizontal transfer of ecologically important traits[J]. Annual Review of Entomology, 2010, 55: 247-266.
[9] TSUTOMU T, KOGA R, HORIKAWA M, et al. Symbiotic bacterium modifies aphid body color [J]. Science, 2010, 330(6007): 1102-1104.
[10]DURON O, BOUCHON D, BOUTIN S, et al. The diversity of reproductive parasites among arthropods: Wolbachia do not walk alone [J/OL]. BMC Biology, 2008, 6: 27.DOI: 10.1186/1741-7007-6-27.
[11]HILGENBOECKER K, HAMMERSTEIN P, SCHLATTMANN P, et al. How many species are infected with Wolbachia?-A statistical analysis of current data [J]. FEMS Microbiology Letters, 2008, 281(2): 215-220.
[12]CLARK M E, BAILEY-JOURDAIN C, SULLIVAN W, et al. Wolbachia modification of sperm does not always require residence within developing sperm [J]. Heredity, 2008, 101(5): 420-428.
[13]DEDEINE F, BOULETREAU M, VAVRE F.Wolbachia requirement for oogenesis: occurrence within the genus Asobara (Hymenoptera, Braconidae) and evidence for intraspecific variation in A.tabida [J]. Heredity, 2005, 95: 394-400.
[14]KREMER N CHARIF D HENRI H et al. Influence of Wolbachia on host gene expression in an obligatory symbiosis[J/OL]. BMC Microbiology, 2012, 12(S1): S7.DOI: 10.1186/1471-2180-12-S1-S7.
[15]HEDGES L M, BROWNLIE J C, ONEILL S L, et al. Wolbachia and virus protection in insects[J]. Science, 2008, 322(5902): 702.
[16]TEIXEIRA L, FERREIRA A, ASHBURNER M. The bacterial symbiont Wolbachia induces resistance to RNA viral infections in Drosophila melanogaster [J/OL]. PLoS Biology, 2008, 6(12): e1000002. DOI: 10.1371/journal.pbio.1000002.
[17]張艳璇, 季洁, 王福堂, 等. 土耳其斯坦叶螨的生殖潜能[J]. 植物保护学报, 2006, 33(4): 379-383.
[18]王旭疆, 袁丽萍, 王永卫, 等. 土耳其斯坦叶螨的生物学特性及其综合防治[J]. 蛛形学报, 1999(1): 16-19.
[19]BREEUWER J A J. Wolbachia and cytoplasmic incompatibility in the spider mites Tetranychus urticae and T.turkestani [J]. Heredity, 1997, 79: 41-47.
[20]GOTOH T, SUGASAWA J, NODA H, et al. Wolbachia induced cytoplasmic incompatibility in Japanese populations of Tetranychus urticae (Acari: Tetranychidae) [J]. Experimental Applied Acarology, 2007, 42: 1-16.
[21]XIE J, BUTLER S, SANCHEZ G, et al. Male killing Spiroplasma protects Drosophila melanogaster against two parasitoid wasps [J]. Heredity, 2014, 112: 399-408.
[22]苗慧,洪晓月,谢霖,等.朱砂叶螨体内感染的Wolbachia的wsp基因序列测定与分析[J].昆虫学报,2004,47(6):738-743.
[23]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method [J]. Methods, 2001, 25(4): 402-408.
[24]KREMER N, VORONIN D, CHARIF D, et al. Wolbachia interferes with ferritin expression and iron metabolism in insects[J/OL]. PLoS Pathogens, 2001, 5: e1000630. DOI: 10.1371/journal.ppat.1000630.
[25]FAST E M, TOOMEY M E, PANARAM K, et al. Wolbachia enhance Drosophila stem cell proliferation and target the germline stem cell niche [J]. Science, 2011, 334(6058): 990-992.
[26]REYNOLDS K T, HOFFMANN A A.Male age, host effects and the weak expression or non-expression of cytoplasmic incompatibility in Drosophila strains infected by maternally transmitted Wolbachia [J].Genetics Research,2002,80(2):79-87.
[27]RAIKHEL A, DHADIALLA T. Accumulation of yolk proteins in insect oocytes [J]. Annual Review Entomology, 1981, 37: 217-251.
[28]朱路雨.共生菌Wolbachia和Cardinium對中国截形叶螨和皮氏叶螨生殖调控作用的研究[D].南京:南京农业大学,2012.
[29]葛少钦,李建忠,张晓静.精子发生过程中组蛋白甲基化和乙酰化[J].遗传,2011,33(9):939-946.
[30]潘晓燕,李质馨,王正朝,等.精子发生过程中的组蛋白变化与雄性不育[J].中国医学科学院学报,2014,36(1):108-113.
[31]LU Xu, HANSEN J C. Identification of specific functional subdomains within the linker histone H10 C-terminal domain[J]. The Journal of Biological Chemistry, 2004, 279(10): 8701-8707.
[32]黄星卫, 程香荣, 王楠, 等. 组蛋白H3变体H3.3及其在细胞重编程中的作用[J]. 遗传, 2018, 40(3): 186-196.
[33]BAUER R, LEHMANN C, FUSS B, et al. The Drosophila gap junction channel gene innexin 2 controls foregut development in response to wingless signalling [J]. Journal of Cell Science, 2002, 115(Pt9): 1859-1867.
[34]LEHMANN C, LECHNER H, LER B, et al. Heteromerization of innexin gap junction proteins regulates epithelial tissue organization in Drosophila[J]. Molecular Biology Cell, 2006, 17(4): 1676-1685.
[35]杜海宁, 胡红雨. 锚蛋白重复序列介导的蛋白质-蛋白质相互作用[J]. 生物化学与生物物理进展, 2002(1): 6-9.
[36]BRENNAN L J, HAUKEDAL J A, EARLE J C, et al. Disruption of redox homeostasis leads to oxidative DNA damage in spermatocytes of Wolbachia-infected Drosophila simulans[J]. Insect Molecular Biology, 2012, 21: 510-520.
[37]GRBIC' M, VAN LEEUWEN T, CLARK R M, et al. The genome of Tetranychus urticae reveals herbivorous pest adaptations [J]. Nature, 2011, 479(7374): 487-492.
[38]MOHAN M, GUJAR G T. Characterization and comparison of midgut proteases of Bacillus thuringiensis susceptible and resistant diamondback moth (Plutellidae: Lepidoptera)[J]. Journal of Invertebrate Pathology, 2003, 82(1): 1-11.
[39]HECKEL D G. The complex genetic basis of resistance to Bacillus thuringiensis toxin insects [J]. Biocontrol Science & Technology, 1994, 4(4): 405-417.
(责任编辑:田 喆)
