磁性MnFe2O4@Al2O3 对废水中铜的吸附行为研究
2020-07-22何宗文鲍东杰刘占孟
李 静,何宗文,鲍东杰,刘占孟
(1.邢台职业技术学院,河北邢台054035;2.华东交通大学土木建筑学院,江西南昌330013;3.丰城市水利局,江西丰城331100)
重金属具有持久毒性、生物富集性,重金属的环境风险阻断是环境保护中的重中之重〔1-2〕。铜是常见的一类重金属污染物质,世卫组织(WHO)规定铜的最大质量浓度限值为2 mg/L。含铜废水主要来源于采矿、冶炼、金属加工、机械制造等行业,废水中Cu2+质量浓度可达10~1 000 mg/L。
吸附技术可有效去除废水中的重金属,制备性能优良、成本低廉、环境友好的重金属专用吸附剂是吸附技术广泛应用与推广的关键所在〔3-4〕。三氧化二铝由于具有较大的比表面积,常用于对重金属离子的吸附去除〔5〕,但粉体三氧化二铝存在活性氧化铝在使用后难以回收的技术缺陷〔6-7〕。铁酸锰(MnFe2O4)具有热稳定性高,硬度高、耐腐蚀、比表面积大、磁性强等特点,作为吸附剂可用于重金属和有机物的去除〔8-10〕。相比Fe3O4而言,因其同时含有两种过渡金属Mn2+和Fe3+,不易产生团聚,用于重金属的去除适用的pH 范围广〔11〕。然而,铁酸锰直接应用于重金属的吸附效果较为有限。鉴于此,本实验将铁酸锰负载至活性氧化铝,制备核壳结构的磁性复合吸附剂MnFe2O4/Al2O3,用于废水中重金属铜的吸附去除,优化相关吸附参数,考察其重复利用性能,探讨相关吸附机理。
1 材料与方法
1.1 实验水样
准确称取3.927 g CuSO4·5H2O,置入烧杯中加入去离子水溶解,后转移至容量瓶内,加去离子水定容至1 L 备用。所配溶液即为含1 000 mg/L Cu2+的标准储备液。根据实验中所需其他Cu2+的浓度,按要求配比稀释相应浓度Cu2+溶液。
1.2 MnFe2O4@Al2O3 吸附剂的制备
第一步,首先采用水热合成法制备MnFe2O4。将和KMnO4按照物质的量比为2∶1 溶于一定量的乙二醇中, 缓慢加入NH4Ac 和聚乙二醇,混合液转移至反应釜中,200 ℃下反应12 h,冷却,磁性分离,用去离子水和乙醇清洗数次,放入真空干燥箱,在60 ℃烘干6 h,制得MnFe2O4。第二步,将MnFe2O4包被活性氧化铝制备核壳磁性复合吸附剂MnFe2O4@Al2O3。取6 g 经清洗干燥后的活性氧化铝,以及制备好的1 g MnFe2O4于装有100 mL 超纯水的250 mL 三角锥形瓶中,超声30 min,放在摇床中以30 ℃,200 r/min 浸渍12 h,用无水乙醇和超纯水清洗数次,制得MnFe2O4@Al2O3吸附剂,于鼓风干燥箱中80 ℃下烘干备用。
1.3 吸附实验
取50 mL 一定浓度的重金属模拟废水,调节溶液pH,置于锥形瓶内再加入一定量吸附剂后,放入恒温振荡器中进行30 ℃震荡实验,吸附一定时间后,水样通过钕铁硼强磁铁对混合液进行磁固相萃取,取上清液,采用火焰原子吸收法测定Cu2+浓度。
1.4 样品表征
采用型号为PPMS-9T 的振动样品磁强计(VSM)对所制备的磁性材料的磁性和饱和磁化强度进行分析。为防止粉末对样品盒的污染,将待测样品装入一个小塑料袋中,然后用黏胶将其固定在样品盒中进行测量。工作条件:测量温度为298.5 K;磁场强度为7 T;磁矩测量灵敏度为5×10-8emu。
采用型号为X’pert Pro 的X 射线衍射仪对磁性材料的晶型结构进行分析。使用Cu-Kα射线源对粉末样品进行衍射,所得数据用Origin 做图并进行分析。工作条件:工作电压为40 kV;工作电流为40 mA;波长为0.451 46 nm;射线衍射仪测角转速器的转速为4(°)/min,扫描范围5°~90°。
2 结果和讨论
2.1 MnFe2O4@Al2O3 吸附Cu2+
2.1.1 吸附剂投加量对吸附效果的影响
在Cu2+质量浓度20 mg/L,pH 为6, 吸附时间180 min 条件下,吸附剂投加量对吸附效果的影响见图1。
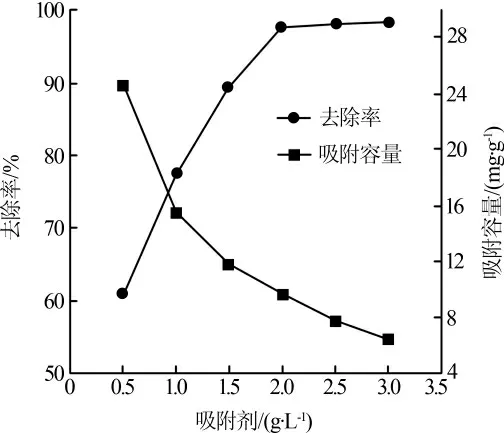
图1 吸附剂投加量对吸附效果的影响
Cu2+的去除率随着吸附剂用量的增加,先迅速上升后趋于平缓。在0.5~2.0 g/L 内,Cu2+去除率迅速上升,这是由于在该反应阶段Cu2+浓度相对比较高,吸附活性位点有限,而随着吸附剂投加量的增加,可与Cu2+结合的吸附活性位点亦随之增多,废水中Cu2+浓度降低。当投加质量浓度增至2.0 g/L 时,Cu2+去除率和吸附容量分别达到97.6%和9.76 mg/g。继续增加吸附剂用量,Cu2+去除率提高不明显。可能的原因在于:当吸附剂MnFe2O4@Al2O3的投加量达到某一临界值时,废水中大量的Cu2+已经吸附在MnFe2O4@Al2O3表面,此时影响吸附效果的主要因素是Cu2+浓度,吸附剂投加量的增大对于改善吸附效果作用甚微。
2.1.2 pH 对吸附效果的影响
在Cu2+质量浓度20 mg/L,吸附剂投加质量浓度2.0 g/L,吸附时间180 min 条件下,pH 对吸附效果的影响见图2。
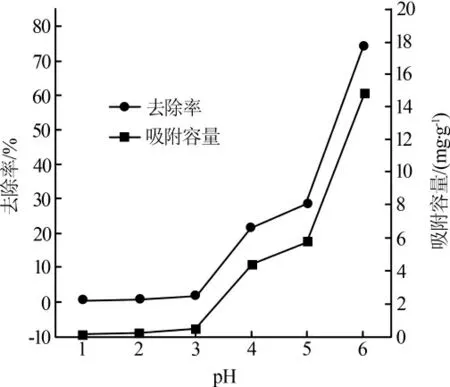
图2 pH 对吸附效果的影响
Cu2+的去除率和吸附量随着pH 的提高呈现出相同的变化趋势。虽然提高pH 有利于吸附效果的改善,但在pH 为1~3 范围内,MnFe2O4@Al2O3对Cu2+的去除效果甚微。这是因为Al2O3是一种两性氧化物,而且MnFe2O4@Al2O3是采用浸渍法制备的,未经煅烧,结晶度低,在较低的pH 下易溶解,使得较多的Al3+溶进溶液里,与Cu2+形成竞争吸附。随着pH的增加,Al2O3变得不再容易溶解,而其较大比表面积的性质发挥了主要作用。在pH 为6 时,Cu2+的去除率和吸附量均达到了最大,分别为74.45%和14.89 mg/g。 说明弱酸性环境有利于MnFe2O4@Al2O3对Cu2+的吸附。但溶液pH 大于6 时,Cu2+易形成沉淀而影响吸附效果。
2.1.3 Cu2+初始浓度对吸附效果的影响
在吸附剂投加质量浓度2.0 g/L,pH 为6,吸附时间180 min 条件下,Cu2+初始浓度对吸附效果的影响见图3。
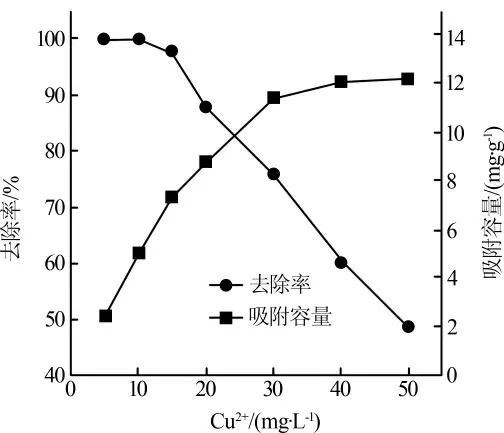
图3 Cu2+初始浓度对吸附效果的影响
随着废水中Cu2+浓度的升高,Cu2+的吸附量先快速增加,后趋于平缓。这是由于在吸附之初,溶液中存在较多的吸附活性位点,此时Cu2+浓度占主导地位,影响着吸附效果。Cu2+初始质量浓度从5 mg/L 增至30 mg/L,吸附容量从2.50 mg/g 增至12.24 mg/g。继续增加溶液中Cu2+浓度,吸附容量无显著提升。这表明在30 mg/L Cu2+质量浓度下吸附几乎达到动态平衡,吸附剂表面大量的活性位点被占用。
2.1.4 吸附时间对吸附效果的影响
在Cu2+质量浓度20 mg/L,吸附剂投加质量浓度2.0 g/L,pH 为6 条件下,吸附时间对吸附效果的影响见图4。
磁性MnFe2O4@Al2O3吸附剂对Cu2+的吸附过程分为两个阶段。在初始阶段,吸附进行得非常迅速,之后,吸附变得较慢。原因可能是随着反应时间的延长,在吸附剂投加量一定的情况下,吸附位点逐渐饱和,使得Cu2+在磁性MnFe2O4@Al2O3上的吸附变得困难。180 min 内Cu2+去除率随着吸附时间的延长迅速升高。吸附时间为180 min 时,Cu2+去除率为96.7%,吸附容量为9.67 mg/g。继续延长吸附时间,Cu2+去除率和吸附容量提升缓慢。从经济的角度出发,吸附时间为180 min 是适宜的。
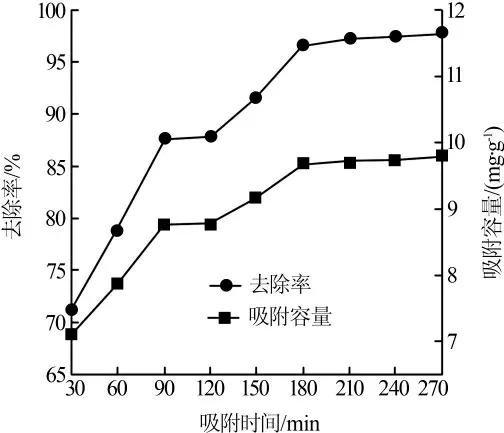
图4 反应时间对吸附效果的影响
2.2 吸附动力学分析
设定反应温度30 ℃,Cu2+质量浓度20 mg/L,吸附剂投加质量浓度2.0 g/L,废水初始pH 为6,在4 h的反应时间内,每隔30 min 取1 次水样,测定Cu2+浓度,采用伪一级动力学和伪二级动力学方程对实验数据进行拟合。拟合结果显示,伪二级模型的相关系数(R2=0.998 6)优于伪一级模型(R2=0.920 6)。这说明对于Cu2+在MnFe2O4@Al2O3磁性吸附剂的吸附过程,采用伪一级反应动力学模型拟合程度较差,可能原因在于吸附边界条件的选择和计算上的局限性所致〔12〕。相比而言,伪二级吸附动力学模型能更好地描述Cu2+在MnFe2O4@Al2O3上的吸附过程,表明吸附过程有可能基于吸附剂和吸附质之间的化学吸附或电子共享及交换为主〔13〕。此外,从伪二级模型得出的吸附平衡值为10.45 mg/g,与实验数据所得的9.78 mg/g更接近。
2.3 MnFe2O4@Al2O3 脱附再生实验
为了考察吸附剂的稳定性及其可重复利用性,同时针对废水中重金属离子的回收富集,先借助永磁铁,在外加磁场的作用下,对吸附了Cu2+之后的吸附剂与水溶液进行固液分离,随后将收集的吸附剂用0.03%的NaOH 溶液进行解吸。 最后过滤悬浮液,用超纯水洗涤吸附剂数次。经干燥后,回收的吸附剂用于新一轮的循环吸附。在连续进行5 个循环的脱附再生实验后,考察吸附剂对Cu2+去除率和吸附量的影响。在连续5 个循环后,去除率和吸附量的值仅略微降低,分别高达85.7%和8.57 mg/g。磁性MnFe2O4@Al2O3具有较好的再生能力,并且对废水中Cu2+的去除具有良好的应用前景。
2.4 MnFe2O4@Al2O3 的磁滞回线分析
为了验证磁性MnFe2O4@Al2O3的磁化强度并得到其磁滞回线,采用PPMS-9T 型VSM 测定仪,对吸附剂进行了检测,结果表明,磁性吸附剂MnFe2O4@Al2O3的矫顽力(Hc)和剩磁(Mr)几乎可以忽略不计,接近于0,表现出磁性MnFe2O4@Al2O3吸附剂的超顺磁性。其饱和磁化强度达到了7.76 emu/g,足以在添加外部磁场的情况下将吸附剂与水溶液进行固液分离。实际上,在有外部磁场的情况下,磁性MnFe2O4@Al2O3在约2 min 左右的时间内就可以从水溶液中分离出来,这进一步确定了磁性MnFe2O4@Al2O3吸附剂具有较强的磁性,为其回收利用提供了便捷。
2.5 MnFe2O4@Al2O3 的XRD 图谱分析
为了进一步研究磁性MnFe2O4@Al2O3吸附剂的结构和结晶度,对其进行了XRD 表征,见图5。
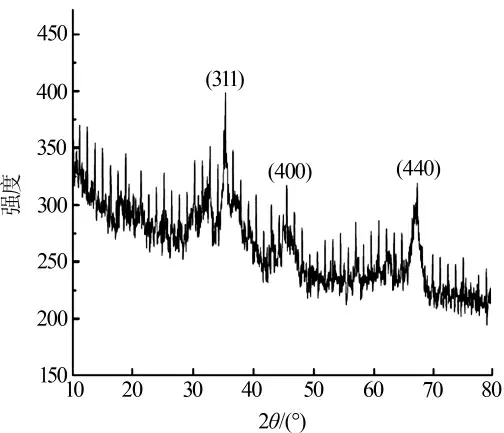
图5 磁性MnFe2O4@Al2O3 的XRD 图
与磁性MnFe2O4吸附剂的衍射峰相比, 磁性MnFe2O4@Al2O3吸附剂的衍射峰数量减少,且磁性MnFe2O4吸附剂的衍射峰大部分消失或者表现得不明显,在2θ 为36.69°、46.60°、68.08°处出现了一些新的衍射峰。根据JCPDS File NO.29-36,这些新出现的衍射峰属于Al2O3相。出现这些情况的原因是由于实验采用浸渍法合成磁性MnFe2O4@Al2O3吸附剂,且在合成过程中,投加的Al2O3占比高,掩盖了MnFe2O4的衍射峰或者将其强度削弱了。结合磁分离过程中材料表现出较强的磁性,证实了磁性MnFe2O4@Al2O3吸附剂的成功合成。
3 结论
磁性复合吸附剂MnFe2O4@Al2O3对Cu2+展现了良好的吸附效果,具有较好的应用前景。在Cu2+浓度为20 mg/L,吸附剂质量浓度为2.0 g/L,pH 为6,吸附时间180 min 条件下,Cu2+去除率为96.7%,吸附量为9.67 mg/g。吸附—脱附—再生实验表明:在连续5 个循环后,去除率和吸附量的值仅略微降低,分别高达85.7%和8.57 mg/g。
伪二级吸附动力学模型更好地描述了Cu2+在MnFe2O4@Al2O3上的吸附过程,吸附过程可能基于吸附剂和吸附质之间的化学吸附或电子共享及交换为主。VSM 测试显示MnFe2O4@Al2O3具有超顺磁性,其较强的磁性为其回收利用提供了便捷;XRD 图谱分析印证了MnFe2O4与Al2O3成功制备出磁性MnFe2O4@Al2O3复合吸附剂。
