黄酒多肽的多级分离纯化及其对小鼠巨噬细胞免疫调节的影响
2020-07-20冯瑞雪姬中伟钱肖华徐岳正许正宏
冯瑞雪,史 瑛,姬中伟,钱肖华,徐岳正,毛 健,*,许正宏,*
(1.粮食发酵工艺与技术国家工程实验室,江南大学,江苏无锡214122; 2.浙江古越龙山绍兴酒股份有限公司,国家黄酒工程技术研究中心,浙江绍兴312000)
黄酒是中国历史上最悠久的传统酿造酒,自古被视为我国传统的养生保健品[1]。黄酒中的肽类含量丰富、具有多种生物活性,氨基酸含量为13.5 g/L,含量是啤酒的7.55倍,比白酒多2.09倍[2],故开展黄酒多肽分离纯化、结构鉴定以及功能性研究是十分必要的。黄酒多肽主要来源于原料分解与微生物代谢积累,酿造黄酒的原料如糯米等富含丰富的蛋白质,微生物体内含有各种代谢酶,因此在发酵过程中可以产生多种不同功能的活性肽[3]。
炎症是机体对感染、组织损伤及伤害性刺激等做出的保护性反应,是伴随很多疾病如高血脂、糖尿病、癌症等的一种共有病理现象。适当的炎症反应对机体有免疫增强的作用[4],但过度的免疫应答会导致组织损伤[5],对人体产生重大伤害[6-7]。巨噬细胞是主要的炎症细胞,当其受到外界抗原(如LPS)刺激时会释放NO、TNF-α、IL-1β、IL-6等一系列炎性细胞因子调节免疫反应[8]。目前黄酒多肽已有很多活性如抗氧化活性等的报道[9-10],但黄酒多肽对小鼠巨噬细胞免疫活性的调节功能还未被深入研究。免疫调节肽是一类对生物机能有益的蛋白肽,通过调控细胞因子的分泌、炎性介质的合成分泌以及炎症信号通路来调节生物体的炎症反应[11],通过分离纯化技术对所得到的黄酒多肽进行结构鉴定和进一步活性分析,继而确定可能的构效关系,这将为黄酒多肽保健功能的研究提供重要的理论依据。
本研究通过LPS诱导小鼠巨噬细胞RAW264.7建立炎症模型,初步探讨黄酒多肽对小鼠巨噬细胞免疫活性的调节作用,为黄酒多肽的保健功能及研究开发利用提供理论基础,通过食物或药食同源的方式起到调节免疫活性的效果,具有较高的经济和研究价值,同时也促进黄酒在大健康背景下的进一步发展和食品产业升级。
1 材料与方法
1.1 材料与仪器
黄酒 绍兴;小鼠巨噬细胞RAW264.7 细胞系购于中国科学院上海细胞库;胎牛血清(Fetal Bovine Serum,FBS) 美国Gibco;二甲基亚砜(Dimethyl Sulfoxide,DMSO)、脂多糖(LPS)、噻唑蓝(MTT)、Griess reagent 美国Sigma公司;DMEM高糖培养基、双抗青霉素(104μg/mL,链霉素104μg/mL) Hyclone;Sephadex G-15凝胶填料 上海源叶生物科技有限公司;BCA检测试剂盒 上海碧云天生物公司;其他试剂 均为分析纯。
Beta 1-8 LD plus冷冻干燥机 德国Christ公司;冷冻离心机 艾本德国际贸易有限公司;SY2000旋转蒸发器 上海亚荣生化仪器有限公司;SynergyH1全功能酶标仪 美国Biotek;小型超滤装置 美国Millipore公司;DHL-A恒流泵、HD-3紫外检测仪、DBS-100电脑全自动收集器 上海沪西分析仪器厂;Agilent1260液相色谱 安捷伦公司;SHA-C往复水浴振荡器 上海百典仪器设备有限公司;PL6001E天平 梅特勒-托利多仪器上海有限公司;AL204分析天平 无锡旭野科技有限公司;SHZ-Ⅲ型循环水真空泵 上海亚营仪器有限公司。
1.2 实验方法
1.2.1 大孔树脂吸附黄酒多肽及条件优化
1.2.1.1 黄酒预处理 循环水式真空泵抽滤黄酒使其过0.22 μm的微孔滤膜,去除黄酒中分子量较大的固形物。实验用超滤组件经过0.1 mol/L NaOH溶液洗涤后用蒸馏水洗至流出液为中性后方可使用。研究表明,肽类的分子量一般在3 kDa以下才具有特殊的生理活性,故通过超滤系统分级超滤酒样,取小于3 kDa的组分进行后续实验。
1.2.1.2 大孔树脂预处理 95%乙醇浸泡D101、DA201、DA201-C三种大孔树脂24 h,蒸馏水清洗大孔树脂至无明显乙醇气味,流出液清澈透明、无浑浊物后,分别用1 mol/L的HCl和4% NaOH浸泡24 h,以去除树脂在合成过程中的杂质,避免对样品的吸附造成影响[12],树脂洗至中性后滤去水分备用。
1.2.1.3 大孔树脂的筛选 不同性质大孔树脂适合分离的物质不同,综合考虑大孔树脂对黄酒多肽的吸附率、解析率筛选树脂。通过文献调研后选取3种不同型号的大孔树脂,其各种参数见表1。

表1 树脂的物理参数Table 1 The physical properties of macroporous resin
参考文献[9]确定条件即分别称取三种经过1.2.1.2方法预处理的树脂10 g(干重)置于锥形瓶中,加入预处理之后的黄酒样品100 mL,于25 ℃、150 r/min条件下吸附24 h,测定上清液中多肽浓度Ce,并按照公式分别计算多肽的吸附量Ac和吸附率A。
吸附率A(%)=100×(C0-Ce)/C0
吸附量Ac(mg/g)=V0×(C0-Ce)/W
式中:C0(mg/mL)表示溶液中多肽的初始浓度;Ce(mg/mL)表示大孔树脂吸附多肽达到吸附平衡时的浓度;V0表示样品的体积(mL);W表示树脂的干重(g)。
1.2.1.4 树脂的静态吸附实验 按照1.2.1.3的方法进行静态吸附24 h,每隔1 h测定上清液中多肽浓度Ce。通过BCA试剂盒检测、按照标准曲线计算多肽浓度,后按照公式计算吸附率A[13]。
1.2.1.5 洗脱剂浓度的选择 收集吸附黄酒多肽后的DA201-C大孔树脂,抽滤去除滤液,用适量蒸馏水冲洗滤干后加入一定体积分数的乙醇溶液,25 ℃、150 r/min条件下洗脱24 h,抽滤后测定多肽含量。按照上述方法依次进行体积分数为20%、40%、60%、80%、100%的乙醇溶液洗脱,并按公式计算大孔树脂解析率Dr。洗脱液经旋蒸去除乙醇后冻干,所得冻干粉即为黄酒多肽SJ。
解析率Dr(%)=Cd×Vd/(Ac×W)
式中:Cd(mg/mL)表示洗脱样品多肽浓度;Vd(mL)表示洗脱液的体积。
1.2.2 凝胶色谱层析 参考文献[14-15]进行Sephadex G-15葡聚糖凝胶预处理及装柱。装柱后用蒸馏水平衡2个柱体积至检测器基线平稳。用蒸馏水将黄酒多肽组分SJ配成浓度为16 mg/mL的溶液,经0.22 μm微孔膜过滤后经过凝胶过滤分离层析系统,蒸馏水(pH7.0)为流动相,流速为3 mL/min,洗脱液自动部分收集,合并同一分离峰的洗脱液进行冷冻干燥后得三个组分即G1、G2、G3。
1.2.3 细胞实验
1.2.3.1 细胞培养 小鼠巨噬细胞RAW264.7培养于含10%胎牛血清、1%双抗的DMEM高糖细胞培养基,于T25细胞培养瓶中接种,放置于温度为37 ℃、CO2浓度为5%的恒温培养箱中培养[16],取对数生长期细胞用于实验。
1.2.3.2 细胞活力的测定 黄酒多肽SJ、G1、G2、G3样品(0.02、0.04、0.08、0.16、0.31、0.63、1.25、2.50、5.00、10.00 mg/mL)溶解于DMEM高糖培养基,过0.22 μm无菌微孔滤膜。对照组即正常培养基培养细胞,样品干预组即含黄酒多肽样品的培养基培养细胞,每个浓度设6个重复孔。取对数生长期的RAW264.7细胞,按每孔1×104细胞接种于96孔板中,于培养箱中培养24 h后加黄酒多肽样品。加完样品1 h后加入LPS(终浓度为1 μg/mL)。24 h后,每孔加入20 μL的MTT溶液(5 mg/mL)于培养箱继续培养4 h。弃去培养基后向各孔中加入150 μL的DMSO,酶标仪低速振荡使结晶充分溶解后测定各孔在490 nm下的吸光值[17]。细胞存活率按如下公式计算:
细胞存活率(%)=[(As-Ab)/(Ac-Ab)]×100
式中,As:实验孔;Ab:空白孔(仅含培养基);Ac:对照孔(含细胞与培养基)。
1.2.3.3 形态学变化的观察 实验分组包含对照组、LPS组、样品干预组。黄酒多肽SJ样品(0.3、2.5 mg/mL)溶解于DMEM高糖培养基,过0.22 μm无菌微孔滤膜。取对数生长期细胞按每孔2×106细胞接种于6孔板中,培养箱中培养24 h后弃除培养液。对照组加正常培养基;LPS组加2 mL浓度为1 μg/mL的含LPS培养基;样品干预组加含黄酒多肽样品的培养基,1 h后加入LPS(浓度最终为1 μg/mL),放入培养箱中继续孵育24 h。在倒置光学显微镜下观察RAW264.7小鼠巨噬细胞在不同种类、浓度黄酒多肽样品干预下形态的变化并拍照。
1.2.3.4 NO释放量的检测 实验分组包含对照组、LPS组、样品干预组。黄酒多肽SJ、G1、G2、G3样品(0.3、0.6、1.2、2.5 mg/mL)溶解于DMEM高糖培养基,过0.22 μm无菌微孔滤膜。取对数生长期细胞按每孔1×104细胞接种于96孔板中,培养箱中培养24 h后弃除培养液。对照组加正常培养基;LPS组加200 μL浓度为1 μg/mL的含LPS培养基;样品干预组加含黄酒多肽样品的培养基,1 h后加入LPS(浓度最终为1 μg/mL),放入培养箱中继续孵育24 h,收集细胞培养上清液。Griess法检测:取50 μL细胞上清液与亚硝酸钠标准品(80、40、20、10、5、2.5、0 μmol/L)于96孔板中,后在各孔中加入50 μL Griess试剂,酶标仪540 nm条件下测定各孔OD值。以亚硝酸钠标准品浓度为x轴,OD值为y轴,绘制标准曲线,从而计算细胞培养上清液中一氧化氮的含量。标准曲线性方程为:y=0.0055x+0.0066决定系数R2=0.9987。一氧化氮抑制率按以下公式计算为:
抑制率(%)=(LPS组-样品组)×100/(LPS组-对照组)
1.2.4 氨基酸组成的分析 对NO释放抑制率最高的黄酒多肽组分G1进行结构分析,称取0.1 g样品加到水解管中,加入6 mol/L的HCl溶液,充氮气使溶液呈微沸状态,然后密封水解管,在120 ℃条件下水解22 h,反应结束后打开水解管,待溶液冷却后加入10 mol/L NaOH中和,用蒸馏水定容至25 mL。双层滤纸过滤收集上清液过微孔滤膜(孔径0.22 μm),然后采用氨基酸分析仪进行分析。
1.3 数据处理
利用Excel 2016、Graphpad Prism 7等软件进行数据分析及图谱制作。其中,显著性差异分析使用Graphpad Prism 7软件进行,多组数据进行对比采用ANOVA检验,采用标准偏差表示数据误差。
2 结果与分析
2.1 通过大孔树脂吸附黄酒中的多肽及条件优化
2.1.1 具有最佳黄酒多肽吸附效果的大孔吸附树脂筛选 在生物活性肽的研究中,分离纯化是关键环节,只有达到一定纯度,活性肽的功能性研究才得以展开[9]。大孔吸附树脂的吸附是基于化合物与吸附剂间的范德华引力与静电引力,故不同大孔树脂适合吸附的物质不同,通过前期文献调研及预实验筛选出了三种适用于黄酒多肽分离的大孔树脂,但仍需进一步筛选具有最佳黄酒多肽得率的大孔吸附树脂。由表2可得,大孔吸附树脂DA201对黄酒多肽的吸附量最大,其次是DA201-C、D-101。另外比较解吸率可知,DA201-C的解吸率高于另外2种树脂。因此,结合吸附量和解析率的结果可知[18],大孔吸附树脂DA201-C最适用于黄酒多肽的分离。故本实验选取DA201-C型大孔树脂进行吸附解析黄酒多肽。
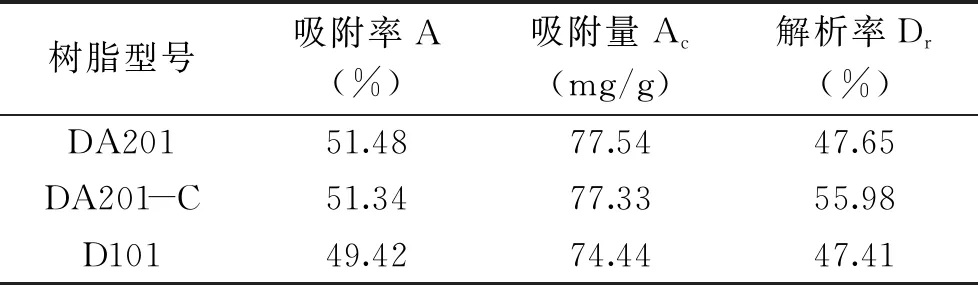
表2 不同型号树脂对黄酒多肽的吸附率解析率及吸附量Table 2 Adsorption and desorption ratio and adsorption capabilities of huangjiu peptides on different macroporous resins
2.1.2 DA201-C大孔树脂的静态吸附曲线 如图1所示,树脂DA201-C在静态吸附过程中对黄酒多肽吸的附率呈现随时间增加先增加后趋于平稳的趋势。在前3 h吸附率增加较快,在3 h时大孔树脂对黄酒多肽的吸附率达到53.41%。3 h后大孔树脂DA201-C对黄酒多肽的吸附率基本维持平衡,表示大孔树脂吸附达到饱和,树脂表面已被吸附物分子占满,这与文献报道的吸附状况一致[19]。
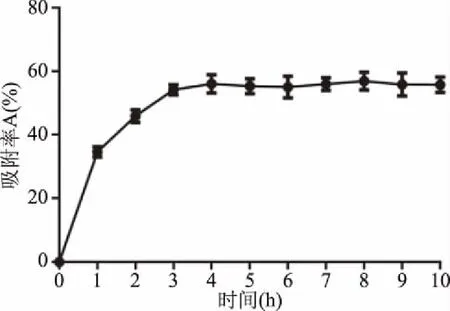
图1 DA201-C树脂对多肽的静态吸附动力学曲线Fig.1 Kinetic curve of static adsorption of peptide with resin DA201-C
2.1.3 黄酒多肽最佳解析率的乙醇体积分数确定 乙醇溶液通过削弱吸附物多肽与吸附剂大孔树脂之间的疏水相互作用,从而使吸附物洗脱下来,且乙醇溶液无毒性、易浓缩去除、便于样品的回收,所以实验最终选择乙醇为洗脱剂对吸附于大孔树脂上的黄酒多肽进行解析。从图2可知,随乙醇浓度增加,多肽的解析率先增加后降低,在乙醇浓度为60%达到最大。当乙醇浓度大于60%时,部分小分子蛋白可能变性导致洗脱液浑浊从而增加洗脱难度。故本实验采取静态吸附后蒸馏水冲洗吸附饱和的树脂去除未吸附组分,再用60%乙醇溶液进行洗脱的方法。洗脱液通过旋蒸冻干后得到大孔吸附树脂分离黄酒多肽组分,即为SJ组分。
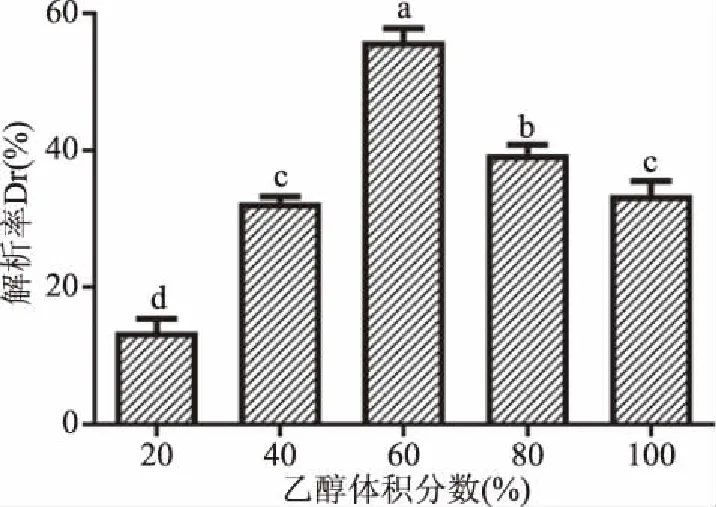
图2 乙醇体积分数对多肽解析率的影响Fig.2 Effects of different concentrations of ethanol on desorption of peptides注:不同小写字母表示差异显著,P<0.05;图7、图8同。
2.2 黄酒多肽SJ的Sephadex G-15凝胶色谱层析
为将黄酒多肽SJ组分中多肽进一步分离纯化,采用葡聚糖凝胶色谱柱Sephadex G-15进行下一步分离纯化。如图3所示,大孔树脂吸附解析后得到的黄酒多肽组分SJ进一步通过葡聚糖凝胶色谱柱进行洗脱分离,得到了3个洗脱峰,以洗脱时间为X轴,以紫外检测的OD值为Y轴作图。收集这3个主要的峰,分别命名为G1、G2、G3。将各组洗脱液冷冻干燥,储存-20 ℃下待用。通过细胞实验测定其对小鼠巨噬细胞的免疫调节活性,对活性最高组分进行氨基酸组成分析。
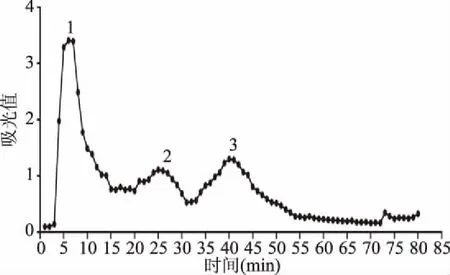
图3 Sephadex G-15纯化黄酒多肽SJ的柱层析图Fig.3 Sephadex G-15 column chromatography of the huangjiu peptides SJ
2.3 各级分离黄酒多肽样品对RAW264.7细胞免疫调节作用的影响
2.3.1 各级分离黄酒多肽样品对RAW264.7细胞活力的影响
2.3.1.1 大孔吸附树脂分离所得黄酒多肽SJ组分对RAW264.7细胞活力的影响 为了研究黄酒多肽对RAW264.7细胞内源性的保护作用,首先排除多肽自身对于细胞毒性作用的干扰,故本实验采用MTT法来检测不同的多肽浓度对RAW264.7细胞存活率的影响。不同浓度黄酒多肽SJ(0.02、0.04、0.08、0.16、0.31、0.63、1.25、2.50、5.00、10.00 mg/mL)干预后的RAW264.7细胞的存活率如图4所示。结果显示RAW264.7细胞的存活率随着多肽浓度升高呈现下降的趋势。当SJ浓度为5 mg/mL时,RAW264.7细胞的存活率与对照组相比高度显著下降(P<0.001),此时细胞的存活率仅为69.55%;黄酒多肽SJ在0.02~2.5 mg/mL浓度范围内干预巨噬细胞后,各组细胞存活率仍均高于95%,表明黄酒多肽SJ在此浓度范围内对RAW264.7无明显的毒性作用。因此,选取黄酒多肽SJ组分在0.02~2.5 mg/mL的质量浓度范围用于后续实验。
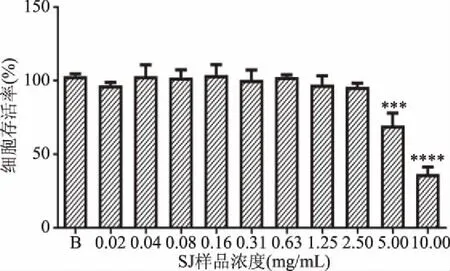
图4 不同浓度黄酒多肽SJ对RAW264.7细胞存活率的影响Fig.4 Effects of huangjiu peptides SJ concentration on the viability of RAW264.7 cells注:与对照组B相比,*:代表差异显著(P<0.05),**:代表差异很显著(P<0.01),***:代表差异高度显著(P<0.001),****:代表差异极显著(P<0.0001);图5同。
2.3.1.2 凝胶层析分离所得三种黄酒多肽组分对RAW264.7细胞活力的影响 为了研究葡聚糖凝胶柱分离出来的3种组分对小鼠巨噬细胞免疫调节活性的影响,首先需分析3种组分即G1、G2、G3对RAW264.7细胞活力的影响。如图5可知,葡聚糖凝胶层析分离的3种组分浓度范围为0.02~2.5 mg/mL时,RAW264.7细胞存活率都在90%以上,这表明此浓度范围内的3种组分对细胞活力均无显著的影响(P>0.05)。因此,3种葡聚糖凝胶层析分离组分选择0.02~2.5 mg/mL的质量浓度范围用于后续实验。
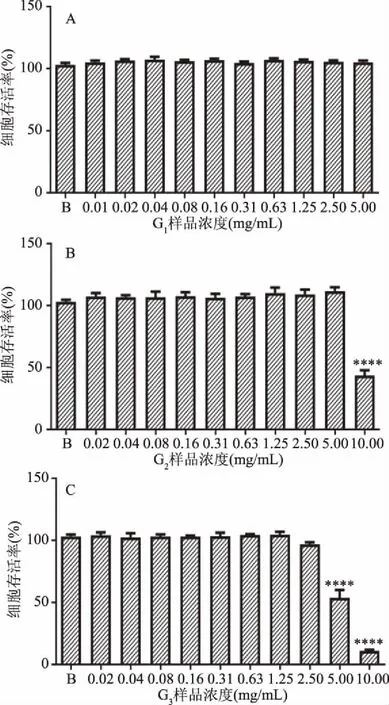
图5 不同浓度Sephadex G-15分离组分 对RAW264.7细胞存活率的影响Fig.5 Effects of the fractions concentrations eluted from Sephadex G-15 on the viability of RAW264.7 cells
2.3.2 大孔吸附树脂分离黄酒多肽SJ组分对RAW264.7细胞形态学的影响 有研究表明RAW264.7细胞的最佳形态是“小、圆、亮”的单核细胞,此种形态细胞对药物刺激敏感,贴壁状态正常,易于消化。故在本试验中,采用此种形态细胞[7]。
将细胞置于倒置显微镜下观察,在400倍镜下,正常培养细胞状态如图6A所示,细胞贴壁生长,形态呈现小而圆;当细胞受到LPS诱导的细胞状态如图6B所示,LPS刺激细胞后细胞发生炎症反应,细胞膨胀且部分呈现梭形;低、高浓度黄酒多肽SJ干预细胞后LPS诱导的细胞状态如图6C、D所示,在黄酒多肽SJ干预下受LPS诱导的RAW264.7的形态趋于正常形态,且随着黄酒多肽SJ样品浓度的增加,保护效果越明显,细胞形态越趋于正常,故黄酒多肽SJ可能对LPS诱导的细胞具有保护作用。
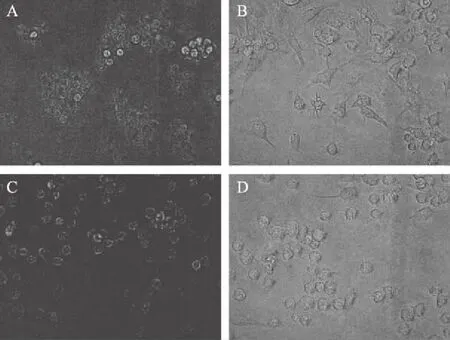
图6 黄酒多肽SJ对小鼠巨噬细胞 RAW264.7细胞形态影响(400×)Fig.6 Effects of the huangjiu peptides SJ on morphology of RAW264.7 cells(400×)注:A:对照孔;B:LPS孔;C:SJ浓度为 0.3 mg/mL;D:SJ浓度为2.5 mg/mL。
2.3.3 各级分离纯化样品对LPS诱导的RAW264.7细胞中NO释放量的影响
2.3.3.1 大孔吸附树脂分离黄酒多肽SJ组分对LPS诱导的RAW264.7细胞中NO释放量的影响 巨噬细胞在急性免疫应答中起关键作用,脂多糖LPS诱导巨噬细胞会产生大量NO,过量的NO会促进炎症的发生和发展,故本实验以LPS为刺激物建立体外炎症模型。通过Griess法测定细胞培养液上清液NO的含量,通过计算NO抑制率来评价抗炎活性的强弱[20]。
由图7可知,对照组NO释放量为1.89 μmol/L;仅LPS诱导细胞时NO的释放量为16.17 μmol/L,LPS组NO释放量是对照组的8.56倍,说明炎症模型建立成功。
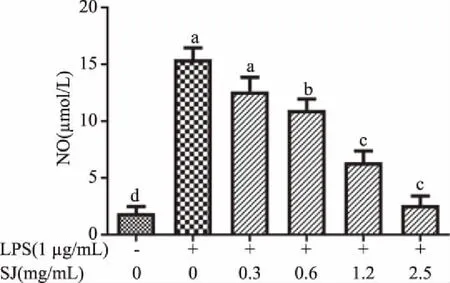
图7 不同浓度黄酒多肽SJ对RAW264.7分泌NO的影响Fig.7 Effect of huangjiu peptides SJ concentrations on the production of NO in RAW264.7 cells
样品干预组中(LPS和黄酒多肽SJ共同作用),随着黄酒多肽SJ样品浓度的增加,NO的释放量呈现出剂量依赖性下降。当浓度为0.3、0.6、1.2、2.5 mg/mL的黄酒多肽SJ作用于RAW264.7时,NO的释放抑制率分别为
20.85%、36.42%、68.58%、95.01%,说明经大孔树脂吸附的黄酒多肽SJ能够显著抑制NO的释放(P<0.05)。并且随着黄酒多肽浓度的增加,NO的抑制率增加。说明黄酒多肽SJ组分可以抑制LPS对巨噬细胞的过度刺激,避免巨噬细胞的过度炎症反应。因此,要想继续分析具体哪种结构的黄酒多肽的活性更高,需要进一步纯化黄酒多肽组分SJ[21]。
2.3.3.2 凝胶层析分离所得三种黄酒多肽组分对LPS诱导的RAW264.7细胞中NO释放量的影响 实验结果如图8所示,葡聚糖凝胶层析分离组分G1、G2、G3的IC50分别是0.68、0.86、0.75 mg/mL,其中G1活性最强。并与大孔吸附树脂分离黄酒多肽SJ组分的IC50的0.79 mg/mL相比,IC50值更低,说明G1能更好地抑制由LPS诱导的小鼠巨噬细胞中NO的释放,从而调节免疫应答,在3种组分中具有相对更好的活性,故对其进行氨基酸分析。
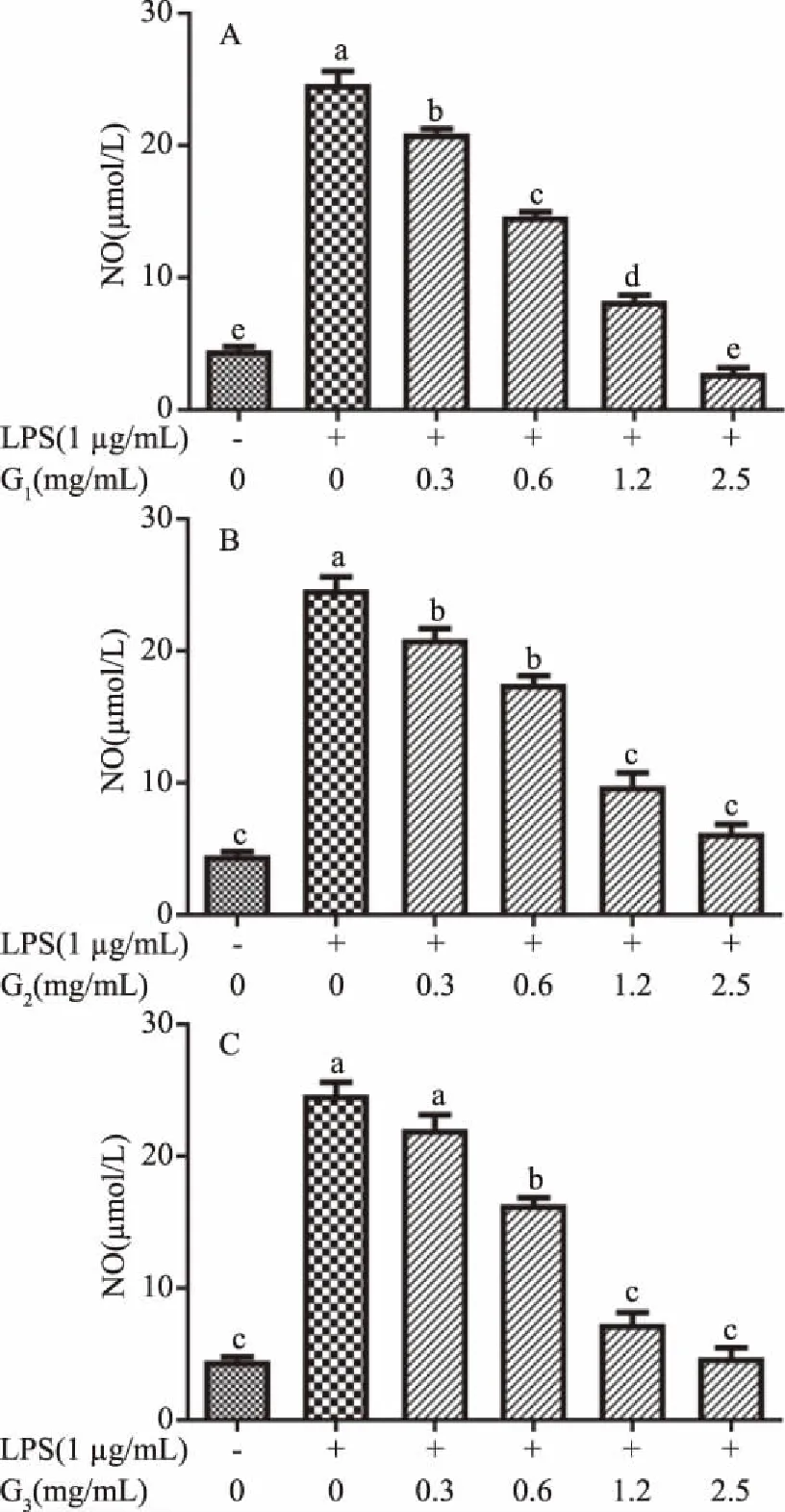
图8 不同浓度Sephadex G-15分离组分 对RAW264.7分泌NO的影响Fig.8 Effect of the fractions concentrations eluted from Sephadex G-15 on the production of NO in RAW264.7 cells
2.4 氨基酸组成分析
氨基酸的组成分析是多肽化学研究中最基本的内容之一[22]。生物活性肽的化学结构信息与其特定的生物活性存在密切联系[23],氨基酸组成及序列信息、肽的疏水性、带电性质、分子量大小、肽链长度以及所包含的微量元素等对其生理活性有着重要影响[24]。在上述实验的基础上,确定了G1组分能更好地抑制LPS对巨噬细胞的过度刺激,由表3可知,谷氨酸(24.41 g/100 g)是G1组分含量最丰富的氨基酸,其次是苯丙氨酸、亮氨酸、甘氨酸;甲硫氨酸是含量最低的氨基酸;疏水氨基酸占总氨基酸含量的32.63%。与文献中报道的活性肽中高疏水性氨基酸含量对免疫调节活性有重要影响这一结论具有一致性[25],强疏水作用能够使活性肽与细胞膜产生相互作用以发挥免疫作用。由于黄酒多肽G1中肽段较多,具体哪条肽段具有较强免疫活性尚未明确,仍需要进行下一步分离纯化,明确不同分子量段肽段的氨基酸序列,通过生物信息学对比分析肽段结构与免疫活性的关系,日后应加强解析构效关系为免疫调节肽作用提供理论基础。

表3 G1组分的氨基酸组成Table 3 Amino acid composition of fraction G1
3 结论
通过大孔吸附树脂及葡聚糖凝胶进行多级分离纯化得到黄酒多肽组分,通过细胞毒性实验(MTT法)和NO释放量评价对小鼠巨噬细胞RAW264.7免疫调节活性最高的黄酒多肽组分。结果表明:通过大孔树脂吸附黄酒获得了具有较高免疫调节活性的黄酒肽组分SJ。黄酒多肽SJ组分通过Sephadex G-15凝胶层析进一步分离纯化,得到3种组分,其中对NO释放抑制率最高的黄酒多肽组分为G1,其NO抑制IC50为0.68 mg/mL。由氨基酸分析可知G1的免疫调节活性与其氨基酸组成有关,疏水氨基酸含量对免疫活性有重要影响。
