猪圆环病毒2型感染人源细胞的转录组分析
2020-07-17刘小花徐鹏张昕薇欧阳婷吉卫龙刘晓慧任林柱
刘小花徐 鹏张昕薇欧阳婷吉卫龙刘晓慧任林柱
(吉林大学动物科学学院,长春 130062)
猪圆环病毒(porcine circovirus,PCV)是圆环病毒科圆环病毒属中的一员,为紧密的球形无包膜单链环状DNA病毒。根据基因组特点,可将PCV分为 PCV1型(porcine circovirus 1,PCV1)、2型(porcine circovirus 2,PCV2)和3型(porcine circovirus 3,PCV3)[1]。对PCV的研究初期,我们普遍以为这类病毒只能寄生在猪体或猪源细胞中。但随着科研人员的进一步研究发现,在非洲绿猴肾细胞及其他细胞中也发现了PCV的寄生,并且能够进行分离与传代[2]。PCV2与PCV1不同,它能够引起猪圆环病毒病(Porcine circovirus disease,PCVD)或猪圆环相关病毒病(Porcine circovirus associated disease,PCVAD)[2-3]。突出表现在猪皮炎肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS)、断奶仔猪多系统衰竭综合征(Post-weaning muhisystemic wasting syndrome,PMWS)、猪呼吸道疾病综合征(Porcine respiratory diseases complex,PRDC)和母猪繁殖障碍(Reproductive failure)等疾病中,给养猪业造成了巨大的经济损失[2]。
PCV2感染会引起猪源细胞内一系列的信号改变,这些信号包括PCV2增殖、细胞凋亡和自噬的启动以及抗病毒应答的诱导。已有研究发现许多与细胞信号通路相关的蛋白质可作为抗病毒效应的靶标[3]。研究发现,PCV1能够感染人源细胞,且能够引起细胞超微结构的改变[4-5],但PCV2是否也能感染人源细胞的问题一直存在争议。Hattermann等人[6]在2004年用带有 PCV2全长的质粒感染293T、HeLa等人源细胞后,发现在所有转染细胞中都扩增出了PCV2的DNA,并且发现了病毒抗原的表达;随后,转染3 d后的细胞出现病变,细胞形态变为圆形,上清液中死亡细胞和细胞碎片数量增加,但在两周之后,病毒颗粒消失,证明PCV2不能在人的细胞中稳定存在[6]。往后其他研究人员的调查显示,没有证据表明PCV2接触者的血清中存在PCV2特异性抗体,表明PCV2在人类细胞是有限存在[7-9]。直至2019年,我们用PCV2感染12种人的细胞,包括单核细胞、上皮以及成纤维细胞,结果发现PCV2都能够稳定感染这些细胞,且产生可感染性的病毒粒子[10]。但关于人源细胞感染PCV2之后所引起的免疫反应及抗病毒效应知之甚少。
RNA-seq技术是近些年发展较快的一种高通量测序技术,具有测序量大且快速、应用范围广等优势[11]。本文通过PCV2感染HeLa细胞后的转录组测序分析,将筛选出来的差异表达基因(differentially expressed genes,DEGs)做进一步分析,预测其相关的信号通路以及生物学功能,最后筛选出与抗病毒反应相关的基因,并通过实时定量PCR方法进一步验证,以期为人源细胞对PCV2及其他病毒产生抗病毒效应的研究提供参考。
1 材料和方法
1.1 实验材料
PCV2株CC1(GenBank登录号JQ955679)是从患有PMWS症状的猪组织标本中分离得到,并由本实验室培养及储存[12]。人源细胞系MCF-7、HeLa和A549购自上海通威生物科技公司[10]。
1.2 主要试剂与仪器
TRNzol-A+试剂(天根生化科技有限公司,中国北京);Agilent 2100生物分析仪(Agilent Technologies,Santa Clara,CA,USA);TruSeq链mRNA LT样品制备试剂盒(Illumina,San Diego,CA,USA);磁性寡糖(dT)珠(Anchored oligo(dT)23primers,Sigma);Illumina HiSeqTM 2500平台(Illumina,美国)。
1.3 实验方法
1.3.1 RNA制备与RNA序列测定
简单来说,接毒前1 d分板,待MCF-7、HeLa和A549细胞长至50%~60%时,用感染复数为1的PCV2株CC1毒液感染细胞,1 h后弃掉病毒液,用新鲜培养液轻轻洗涤1~2遍,然后加入正常培养液继续培养,未感染组同期进行,72 h后用TRNzol-A+试剂提取 RNA。总 RNA溶于50μL去 RNase的ddH2O中,并在-20℃下保存。
为制备cDNA文库,用去RNase的DNaseⅠ处理总RNA,然后用磁性寡糖(dT)珠纯化mRNA,并用Agilent 2100生物分析仪检测RNA完整性。RNA完整性指数(RINs)>8的可进行后续分析。纯化的mRNA用TruSeq链mRNA LT样品制备试剂盒构建文库。然后,在Illumina HiSeqTM 2500平台上对这些文库进行测序。
1.3.2 差异基因的功能注释与富集分析
利用Blast2 GO软件将所有的UniGenes比对到各大平台的数据库中,最后在Nr数据库可注释到最大的比对率。再将测序获得的所有DEGs进行基因功能注释(Gene Ontology,GO)分析和分类,获得转录本的GO功能注释信息。DEGs比对GO数据库后,获得 GO条目(term)。通过超几何检验(Phyper),将校正P值(correctedP-value)<0.05的GO term定义为DEGs中显著富集的GO term。将DEGs应用京都基因与基因组百科全书(Kyoto The Encyclopedia of Genes and Genomes,KEGG)数据库预测其参与的代谢途径(correctedP-value≤0.05为筛选标准)。再利用分子相互作用分析软件(STRING)预测DEGs相互作用网络,用 Cytoscape软件构建蛋白相互作用网络。
1.3.3 定量PCR分析基因表达
获得PCV2感染72 h以及未感染细胞的总RNA后,并用FastQuant RT-Kit(天根生化科技有限公司,中国北京)进行反转录。所得cDNA用Bio-Rad IQTM多色实时 PCR检测系统和 Luna®Universal qPCR Master Mix(新英格兰生物实验室,美国)进行SYBR Green定量实时PCR。
扩增20μL体系,上下游引物各0.5μL,cDNA 2μL,2×Luna通用 qPCR混合物 10μL,ddH2O 7μL,采用以下循环条件:95℃预变性60 s,95℃变性15 s,并在60℃下退火而后延伸30 s,40个循环。实验至少重复3次。
2 结果
2.1 PCV2感染人源细胞的转录组分析
本研究利用Illumina HiSeq平台共测了2组样品(每组样品有三个重复),每组样品平均有6.40 Gb的数据。共检测到表达的基因数为15402个,其中已知基因14817个,预测新基因有585个。
对感染72 h及未感染PCV2的HeLa细胞进行的转录组RNA序列分析,结果如表1所示。在感染PCV2的HeLa细胞中共鉴定出387个DEGs,包括267个上调基因和120个下调基因(表1,图1A)。在387个DEGs中,291个基因与生物过程有关。因此,选取生物过程(biological process)的差异基因做进一步GO分类分析。结果显示共有212个基因上调,79个基因下调。此外,调控基因可分为15个功能组别(图1B、1C),表明PCV2感染可上调或下调多种人类基因。在上调基因中,占比前四的组别分别是生物调控(biological regulation)、刺激应答(response to stimulus)、细胞过程(cellular process)以及代谢过程(metabolic process),分别占上调基因总数的15%、11%、10.8%和10.7%(图1B)。在下调基因中,同样是生物调控、刺激应答、细胞过程和代谢过程这几个功能组别占比较高,分别为16.9%、8.7%、17.2%和10.6%(图1C)。
2.2 PCV2感染细胞中DEGs的GO和KEGG途径富集分析
为了了解DEGs在PCV2感染细胞中的主要途径,我们进行了GO富集和KEGG通路分析,并预测了DEGs可能参与的生物学相互作用。GO富集结果表明,最常见的GO term是应激反应(97 DEGs)和免疫系统过程(80 DEGs)(图2A)。
此外,将DEGs进行KEGG通路分析以进一步评估它们各自的功能。图2B展示了PCV2感染的人类细胞中的前20个(按Q value从小到大排序)富集途径。在HeLa细胞对PCV2感染的应答中,NOD样受体信号途径(NOD-like receptor signaling pathway)有21个DEGs,单纯疱疹病毒感染(Herpes simplex infection)相关的途径中有22个DEGs被高度富集(图2B)。
2.3 参与PCV2感染的DEGs相关网络分析
利用 Cytoscape软件(http://www.cytoscape.org/,Version 3.6.1)的生物网络基因功能注释插件(Biological Networks Gene Ontology,BinGo)对基因的GO注释进行了超几何检验,P<0.001。如图3A所示,DEGs在炎症反应(inflammatory response)、细胞因子刺激反应(response to cytokine stimulus)、白细胞趋化性(leukocyte chemotaxis)、免疫应答(immune response)和病毒应答(response to virus)等生物过程中高度富集,表明这些生物过程与PCV2感染人类细胞的过程有关。
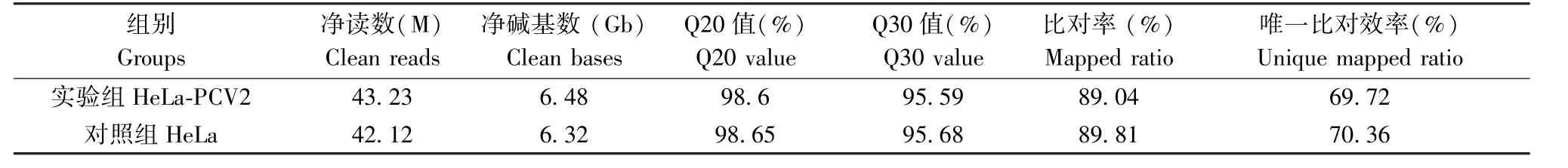
表1 RNA-Seq数据汇总Table 1 Summary of RNA-Seq data
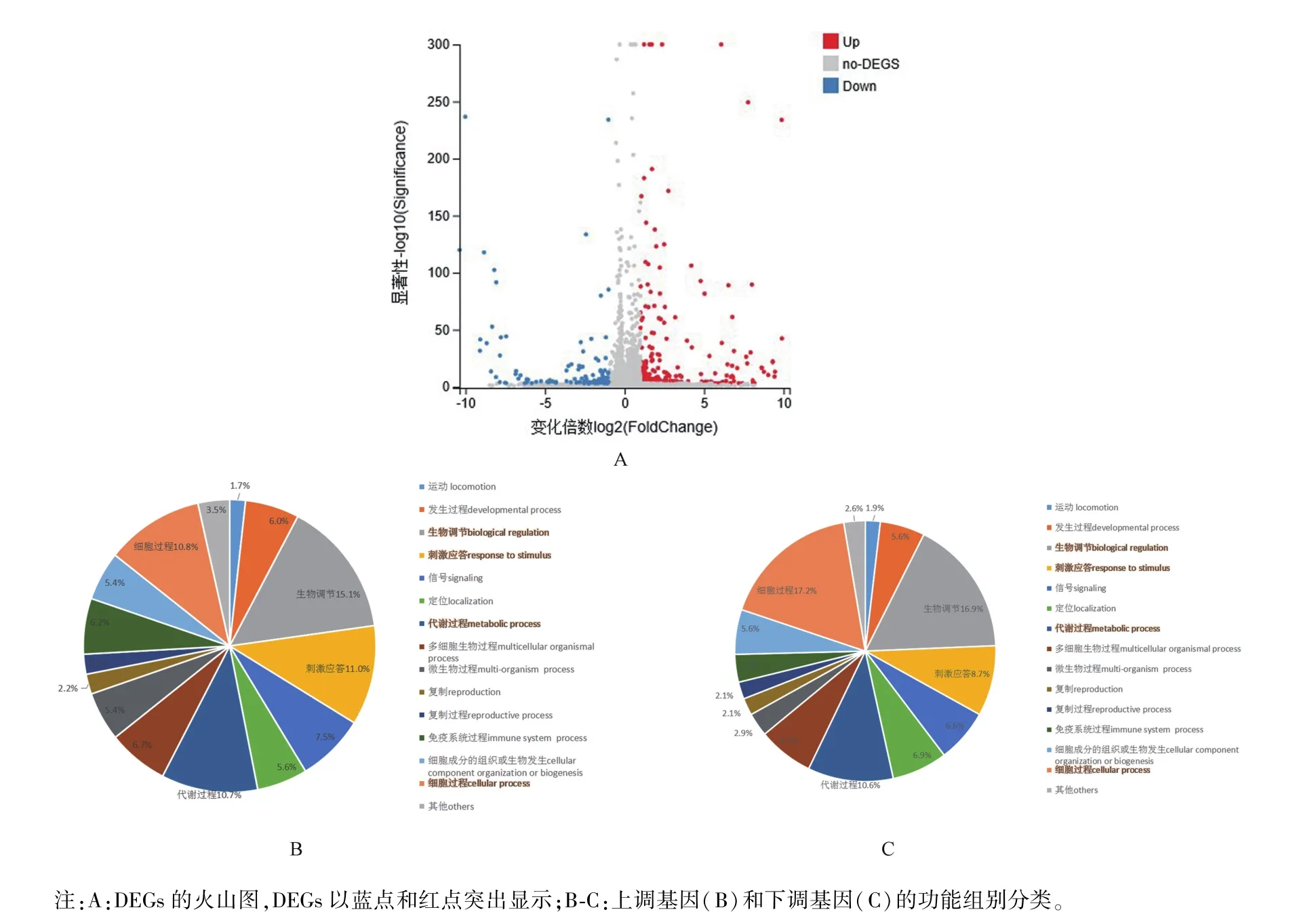
图1 PCV2感染与未感染细胞基因差异表达分析Note.A,Volcano plot of DEGs.Significantly DEGs were highlighted in blue and red dot.B-C,Categories of the up-regulated genes(B)and the down-regulated genes(C).Figure 1 Differential expression analyses of human genes between mock and PCV2-infected cells

图2 PCV2感染与未感染的HeLa细胞中GO富集的前20个生物过程Note.A,GO enrichment analysis.B,KEGG enrichment analysis.Circles indicate numbers of enriched genes and colors mean the Q value.Figure 2 Top 20 of GO terms between mock and PCV2-infected human cells
此外,利用STRING网站分析了与病毒应答相关的DEGs潜在的相互作用网络。如图3B所示,24个DEGs在PCV2感染后下调,包括 IRF9、IFI44L、DDX58、GBP1、GBP3、IFIT2、IFIT1、IFIT3、IL6、IRF1、IRF7、LGALS9、MX1、MX2、OAS1、OAS2、PLSCR1、DDX60、CCL5、 IFIH1(MDA5)、 DHX58(LGP2)、ZC3H12 A(MCPIP)、RSAD2和 ISG15(图 3B)。
2.4 实时qPCR对DEGs的确认
为了进一步验证上述RNA-Seq数据,选择了部分与病毒应答相关的属于刺激应答过程的DEGs,使用实时qPCR进行验证。如图4A所示,与未感染细胞相比,细胞感染PCV2之后,所选择的所有DEGs显著下调,但与RNA-Seq数据结果相反。
根据免疫系统过程(immune system process)、信号(signaling)和刺激应答(response to stimulus)三个生物学过程的GO富集,选择了在PCV2感染HeLa后差异最显著的前12个DEGs进行RT-qPCR验证,并以MCF-7细胞做相同处理进行进一步验证。如图4B所示,在感染PCV2的HeLa细胞中,F8A2的表达没有差异(FC<1.5);然而,CXCL3、CSF3、TNFAIP3和 ITGB2的表达水平明显升高,HIST1H2AK、CXCL1、FBXO17、HBA1、SAA1、PTX3和PI3的表达水平明显降低(图4B)。此外,感染PCV2的 MCF-7细胞中 HIST1H2AK、FBXO17、PTX3和PI3的表达水平同HeLa细胞一致,也明显降低,而其他基因 F8A2、CXCL1、HBA1、CXCL3、CSF3、SAA1、ITGB2和TNFAIP3的表达水平明显高于未感染细胞(图4C)。这些结果表明,不同人源细胞的抗病毒作用(特别是对病毒的应答)不尽相同。
为了进一步证实这些结果,用PCV2感染A549细胞72 h,随机选择前文中提到的DEGs做进一步实时qPCR验证。结果显示,病毒感染A549细胞后,SAA1、HIST1H2AK、PI3、F8A2、CXCL1、IL-6 和IFI44 L水平较未感染细胞明显降低,与HeLa细胞相比,除F8A2结果不一致之外,其他基因变化趋势均相同。
3 讨论
PCV2对猪源细胞的易感性,对全世界养猪业造成了严重的威胁,但该病毒是否存在公共卫生风险是目前首要关心的问题。随着以猪源器官为重点对象的异种移植技术的不断兴起与日趋成熟,PCV2能否感染人源细胞成为饱受争议且需亟待解决的问题[2]。我们之前的研究中初步证明PCV2能够感染人源细胞[10],这对于接触此病毒的研究人员以及接受器官移植的患者来说都是一个非常大的安全隐患。除了对PCV2的防控措施做好之外,研究其抗病毒效应也显得极为重要。
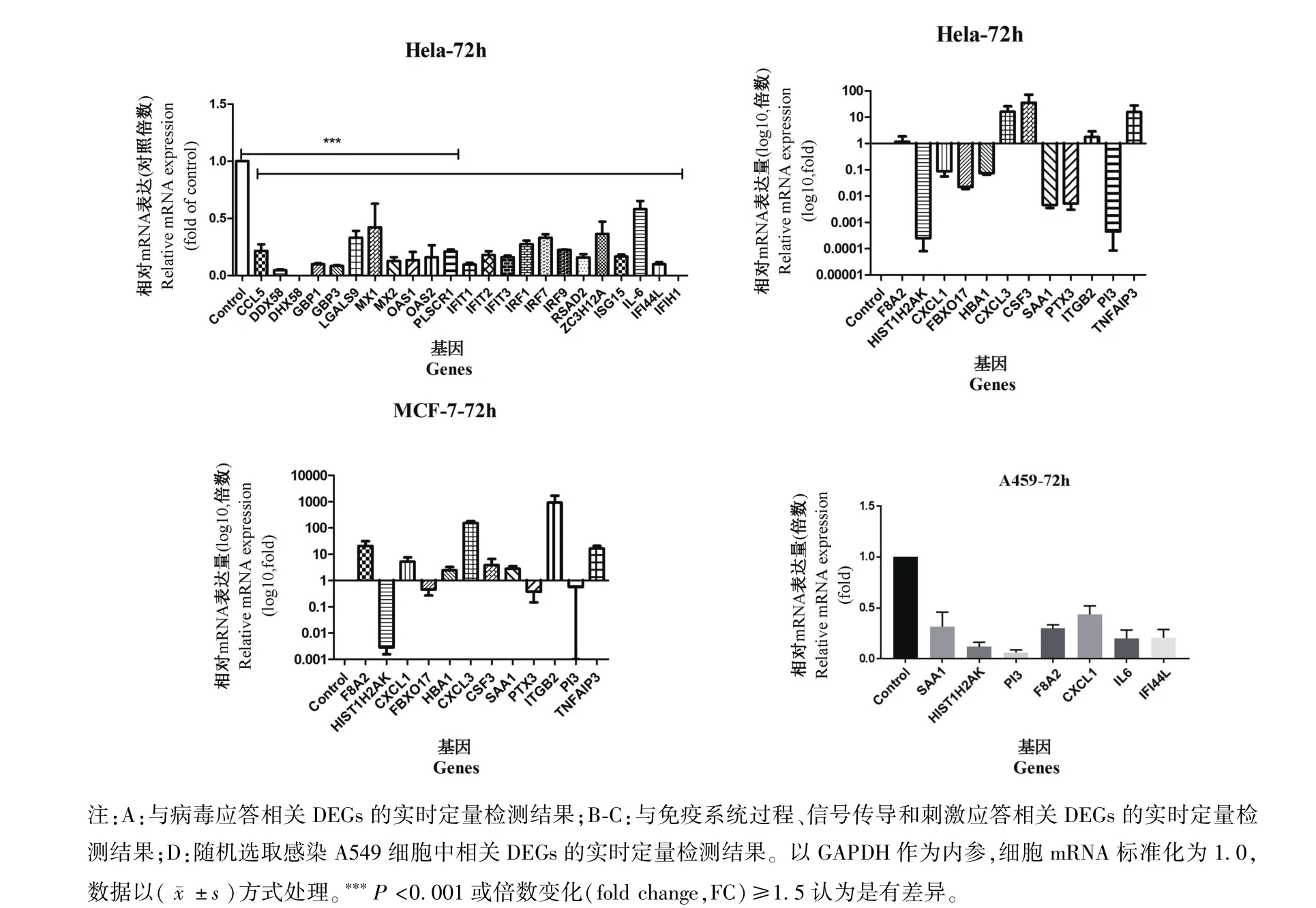
图4 qRT-PCR结果Note.A,The results of Real-time PCR of related DEGs from response to virus.B-C,DEGs of the immune system process,signal and response to stimulus.D,Randomly selected some related DEGs from the infect A549 cells.Normalized with GAPDH,the celluar mRNA standardization was 1.0,***P<0.001 or FC≥1.5 was considered as the significance.Figure 4 The results of qRT-PCR
在本次研究中,选用HeLa细胞作为转录组分析的对象。在感染PCV2之后,使用Illumina HiSeq平台一共测了 2个样品,共注释到 15402个UniGenes。感染PCV2之后有387个差异表达基因,267个上调基因和120个下调基因。Gene Ontology分为分子功能(molecular function)、细胞组分(cellular component)和生物过程(biological process)三大功能类。根据差异基因检测结果进行功能分类。本研究主要选取生物过程做进一步分析。上调基因集中于生物调控(biological regulation),而下调基因集中于细胞过程(cellular process)。对291个生物过程有关的差异基因做进一步GO富集和KEGG通路分析发现,应激反应(97/291 DEGs)和免疫系统过程(80/291 DEGs)占比最高,表明在感染病毒之后可能通过调控细胞调控免疫因子来产生抗病毒效应的。KEGG通路分析发现最富集显著的两条途径是NOD样受体信号途径(21/170 DEGs)和单纯疱疹病毒感染(22/170 DEGs)。用BinGo插件对生物过程所有差异基因的GO注释进行超几何检验发现,其中对病毒应答(response to virus)的差异表达基因被高度富集,而这个过程的基因多数都与抗病毒研究相关。继而对其中24个已知的DEGs进行实时定量PCR检测,结果显示这些病毒应答相关基因在感染之后全部下调。这与RNA-seq结果分析是相反的,实验重复了三次,结果较为可信,差异原因可能是由于RNA-seq是大规模筛选的,反映的是样本整体的基因表达变化趋势,所以存在一些基因与qPCR的结果不一致,需要挑选大量的基因验证。所以又在不同的细胞中选取了另外一些与免疫系统过程(immune system process)、信号(signaling)和刺激应答(response to stimulus)三个生物学过程相关的基因做进一步验证。结果表明,PCV2感染可调节人源细胞基因的表达,虽然不同细胞各基因变化有差异,但大致趋势相同,与RNA-seq结果有一些出入,这在其他一些研究中也出现过[13-14],其原因可能是由于Illumina HiSeq平台测序虽然比较精准,但存在识别序列通常较短,有一定的错误率从而会出现较高假阳性的问题[15]。
在预测的病毒应答相关基因中,变化差别较大的基因有:人粘液病毒抗性2(human myxovirus resistance 2,MX2/MXB)、鸟苷酸结合蛋白 1/3(guanylate binding protein 1/3,GBP1/3)、四磷酸肽重复序列1(tetratricopeptide repeats 1,IFIT1)、维甲酸诱导基因-I(retinoic acid-inducible gene-I,RIG-I/DDX58)以及干扰素诱导的44样蛋白(interferoninduced protein 44-like,IFI44L)。大量文献报道,上述基因均是与细胞抗病毒反应、细胞免疫反应或细胞增殖密切相关的。例如,Mx2在感染细胞中与HIV-1相互作用,并在逆转录和组装成完整病毒基因组过程的早期阶段阻断感染[16-18]。GBP1是多形性胶质母细胞瘤(glioblastoma multiforme,GBM)中表皮生长因子受体(epidermal growth factor receptor,EGFR)的新靶基因,在体内可促进GBM肿瘤的生长和侵袭,但在体外对GBM细胞增殖无明显影响[19-20]。另外,GBP3通过抑制病毒转录和复制参与抗流感活性[21]。在表达IFIT1的细胞中观察到较高水平的Ⅰ型干扰素(type I interferon,I-IFN),IFIT1能感应到RNA的甲基化状态,并通过与缺乏2′-O甲基化的5′帽结构结合而抑制病毒[22],也能通过抑制翻译起始的步骤发挥其抗病毒功能[23-24]。RIG-I和黑色素瘤分化相关基因5(Melanomadifferentiation-associated gene 5,MDA5)是作为RNA病毒限制因子的胞浆RNA解旋酶,有研究证明了RIG-I样受体(The RIG-I-like receptors,RLRs)限制了卡波西肉瘤相关疱疹病毒(Kaposi’s sarcomaassociated herpesvirus,KSHV)的裂解再活化[25];Dvorak等人[26]用PCV2感染猪源间充质样细胞系后发现,细胞主要通过RIG-I/MDA5通路产生大量的I-IFN来达到抗病毒应答的效果。IFI44L是I型干扰素刺激基因(type I interferon-stimulated gene,ISG),属于IFI44家族[27],经IL-28A和IFN-a处理抑制细胞丙型肝炎病毒(Hepatitis C virus,HCV)复制后,IFI44L表达显著增加[28]。但是,由于PCV2在感染猪源细胞的过程中具有免疫抑制作用[29-30],而病毒应答过程中的一些基因大多参与了免疫应答过程(如 ISG15、IL6、IRF1等),因此,推测PCV2感染人源细胞也可能具有免疫抑制作用或抑制相关抗病毒因子表达的作用,最终导致上述基因的mRNA水平在感染72 h后降低,但这些推测还有待进一步的研究证实。
总之,用PCV2感染宫颈癌细胞HeLa之后引起细胞内大量基因表达情况改变,利用RAN-seq技术系统性分析了胞内mRNA的差异变化,多数DEGs参与了免疫系统过程、应激反应以及免疫应答过程。本文着重检测了与病毒应答以及免疫系统过程等相关的DEGs的mRNA水平变化,这些DEGs可能与细胞抗病毒反应或致病机制有关。目前,正在以这些基因编码的蛋白质为研究对象,分析其在感染PCV2之后的活性及功能变化以及这些蛋白对PCV2和其他病毒感染的影响。
