胍丁胺鞘内注射对骨癌痛大鼠痛行为及脊髓CXCL13表达的影响
2020-07-17吴艳琼付学斌王明霞
吴艳琼 张 熙 付学斌 李 均 王明霞
骨癌痛是肿瘤患者发生骨转移时最常见的症状之一,伴有自发痛、痛觉过敏和痛觉超敏等特征,严重影响癌症患者生存质量[1]。胍丁胺(agmatine,AGM)是近年来发现的一种新的神经递质和/或调质,广泛分布于中枢神经系统,在脑和脊髓中合成,主要参与内脏活动、生长发育、降压、认知和疼痛等作用[2-3]。目前,AGM对骨癌痛镇痛作用及其机制的研究甚少。本研究拟通过构建大鼠胫骨骨癌痛模型,观察AGM鞘内注射对骨癌痛大鼠痛行为和脊髓CXCL13表达的影响,探讨AGM对骨癌痛的镇痛效果及可能机制,为临床治疗提供思路。
1 材料与方法
1.1 实验动物及分组 雌性 SD 大鼠60只,体质量200~220 g,由湖北医药学院动物实验中心提供(合格证号43004700)。大鼠常规饲养,温度22~24℃,湿度40%~60%。将预选合格的SD大鼠采用随机数字表法分为3组: 假手术组(A 组)、骨癌痛组(B 组)、胍丁胺组(C 组),每组20只。
1.2 骨癌痛模型建立 大鼠腹腔注射2%戊巴比妥50 mg/kg麻醉后,参照文献[4-5]方法,纵行切开B、C组大鼠左胫骨上段皮肤,切口长度约0.5~1 cm,仔细暴露胫骨,取10 mL注射器针头在胫骨粗隆平面处,与骨面夹角呈30°~45°,向尾部方向进行穿刺打孔,再用微量进样器抽取Walker 256细胞悬液10 μL[6],由穿刺孔进针缓慢注射至骨髓腔内,出针后迅速骨蜡封闭,无菌生理盐水局部冲洗,缝合伤口,外涂红霉素软膏预防感染。A 组胫骨髓腔内注射等量生理盐水,其余处理同B、C两组。造模后12天,取大鼠胫骨行HE染色,鉴定成模情况。
1.3 机械痛阈值测定 术前将大鼠置入机械刺激仪玻璃笼中,每天 30 min,连续3天,使其适应周围环境及操作,于造模后12天测量其机械痛阈值。使用 von frey 纤维丝,垂直方向刺激大鼠左后肢足底中部,记录仪自动记录大鼠缩足反射阈值,连续测3次,每次间隔时间10 min,取平均值作为该时点机械痛阈值。
1.4 鞘内置管和药物注射 大鼠麻醉后剔除两侧髂嵴部位毛发,两髂嵴连线为 L5~6 棘突水平,备皮部位消毒3 遍后置于手术台上。于 L5 棘突水平切开皮肤,分离棘突间隙,咬骨钳咬去 L5 椎体棘突,用1 mL 无菌注射器针头将硬脊膜刺破后拔出针头,将 PE-10 导管朝向头端方向置入蛛网膜下腔,深度约 3 cm 处, 此部位为脊髓腰膨大水平(L1~L2)处,导管置入后见清亮脑脊液从导管流出,为确保导管通畅,用生理盐水冲洗导管,冲洗后缝合固定导管。经导管给予2%盐酸利多卡因(D17G09Ⅱ, 山东华鲁)10 μL,注入局麻药后再用 10 μL 生理盐水冲洗导管,保证药物完全进入鞘内。观察大鼠注药后的反应,若注药 10 s后,双侧后肢出现拖地现象及运动障碍,约15 min后大鼠活动恢复自如,证明导管放置成功。A组不做鞘内注射,B组和 C组分别经导管注射等量0.9%生理盐水和AGM 160 mg/kg(3 mg/μL),10 s内注射完,连续注射6天后进行相关指标检测。
1.5 免疫荧光法检测CXCLl3 在脊髓背角神经元中表达 于建模后12天,痛阈测定结束后,取大鼠L4~L6脊髓,多聚甲醛固定,30%蔗糖脱水至完全沉底,连续冰冻切片(厚14 μm),加入5%羊血清抗体封闭液,室温孵育2 h,磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗后,同时加入兔源性单克隆CXCL13抗体(1∶500,美国Abcam公司,ab199043)和小鼠源性单克隆NeuN抗体(1∶1 000,美国Abcam公司,ab104224),4℃孵育12 h后,PBS洗涤3次,加入相应荧光标记二抗(1∶1 000),室温孵育2 h后,PBS洗涤3次,荧光封片剂封片。激光共聚焦荧光显微镜(Leica sp8,德国)观察CXCL13在脊髓背角神经元中的表达情况。
1.6 Western blot检测脊髓CXCL13蛋白表达 造模后12天鞘内注药测痛阈值后,A、B、C 3组大鼠行断头处死,迅速取L4~L6脊髓,加细胞裂解缓冲液匀浆,分离提取总蛋白。 采用Lowry法进行蛋白定量,以50 μg蛋白上样,经15%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离转膜。将NC膜浸入5%脱脂奶粉室温封膜1 h。洗膜3次后加入β-actin(1∶3 000,美国Abcam公司,ab179467)及兔源性单克隆CXCLl3抗体(1∶1 000),洗膜3次后加入二抗(1∶5 000,美国Abcam公司,ab205718),37℃孵育2 h ,最后用ECL显像曝光。用灰度扫描仪检测出相应CXCLl3条带和β-actin内参条带的平均灰度值,用目的条带与内参条带灰度值的比表示样品中目的蛋白含量。
1.7 RT-PCR法测定CXCLl3 mRNA表达 造模后第12天,A、B、C 3组大鼠取L4-L6节段脊髓,遵循PCR引物设计原则,以GAPDH作为内参。CXCLl3上游引物为: 5′-CTGCTCGGAATCTTAGTGT-3′,下游引物为: 5′-GGTAATGCGTCTGCTTCT-3′;GAPDH上游引物为: 5′-GGCACAGTCAAGGCTGAGAATG-3′,下游引物为: 5′-ATGGTGGTGAAGACGCCACTA-3′。PCR扩增条件:94℃预变性5 min,94℃变性1 min,55℃退火1 min,72℃延长1 min,72℃ 再延长7 min。以2-△△CT方法计算CXCLl3 mRNA 的相对表达水平。

2 结果
2.1 模型的鉴定 造模后12天,取大鼠右侧胫骨,经HE染色,观察到正常大鼠骨质致密,结构完整(图1A)。大鼠胫骨骨髓腔移植肿瘤细胞后,出现明显的骨质破坏(图1B)。
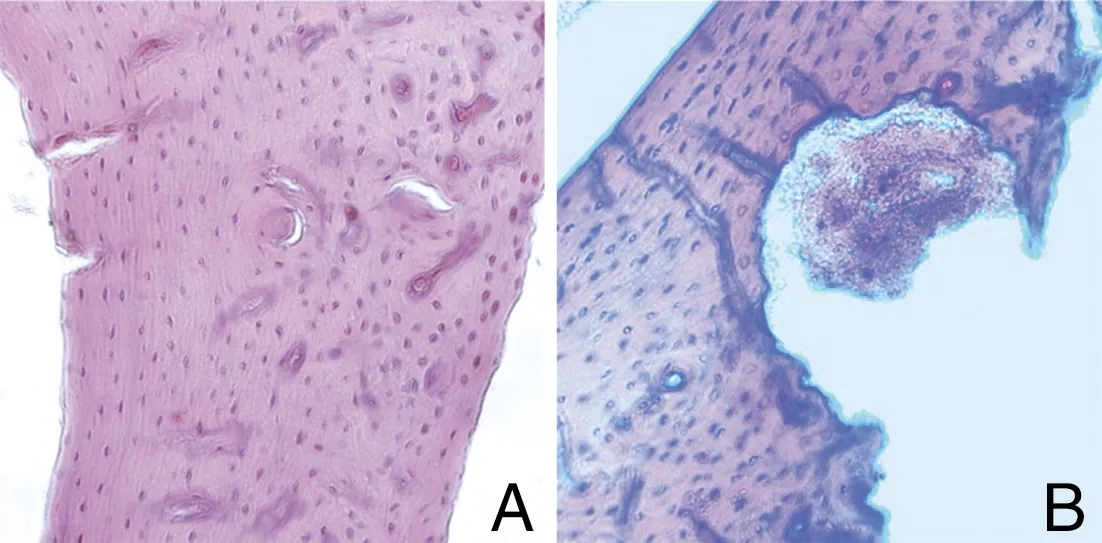
图1 大鼠胫骨HE染色(×100)
2.2 3组大鼠痛行为比较 建模后12天,B 、 C组大鼠机械缩足反射阈值均明显低于A组;与B组比较,C 组机械缩足反射阈值高于B组,差异均有统计学意义(P<0.05)。见表 1。
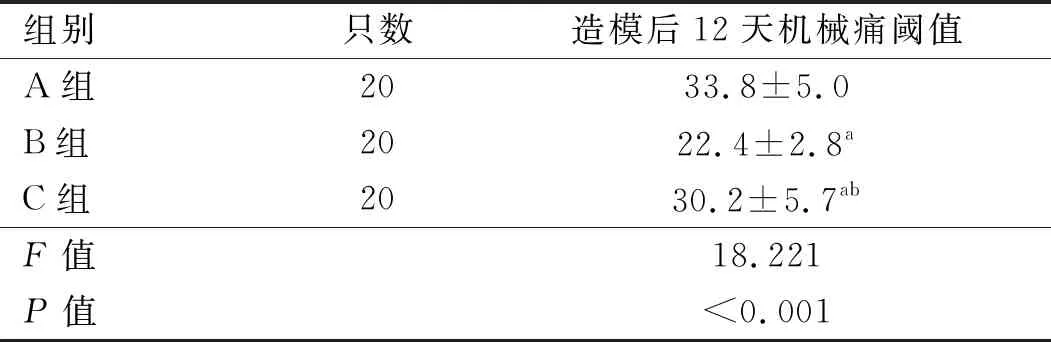
表1 3组大鼠机械痛阈值比较
2.2 CXCL13在大鼠脊髓背角神经元中的表达比较 建模后12天,与A组比较,B、C组大鼠CXCL13表达增加,与B组比较,C 组大鼠CXCL13表达减少。见图2。
2.3 CXCL13蛋白含量及其mRNA表达 建模后12天,与A组比较,B、C组大鼠CXCL13 蛋白及mRNA表达明显增加,与B组比较, C组大鼠脊髓CXCL13 蛋白及mRNA表达减低,差异均有统计学意义(P<0.05)。见表2、图3。
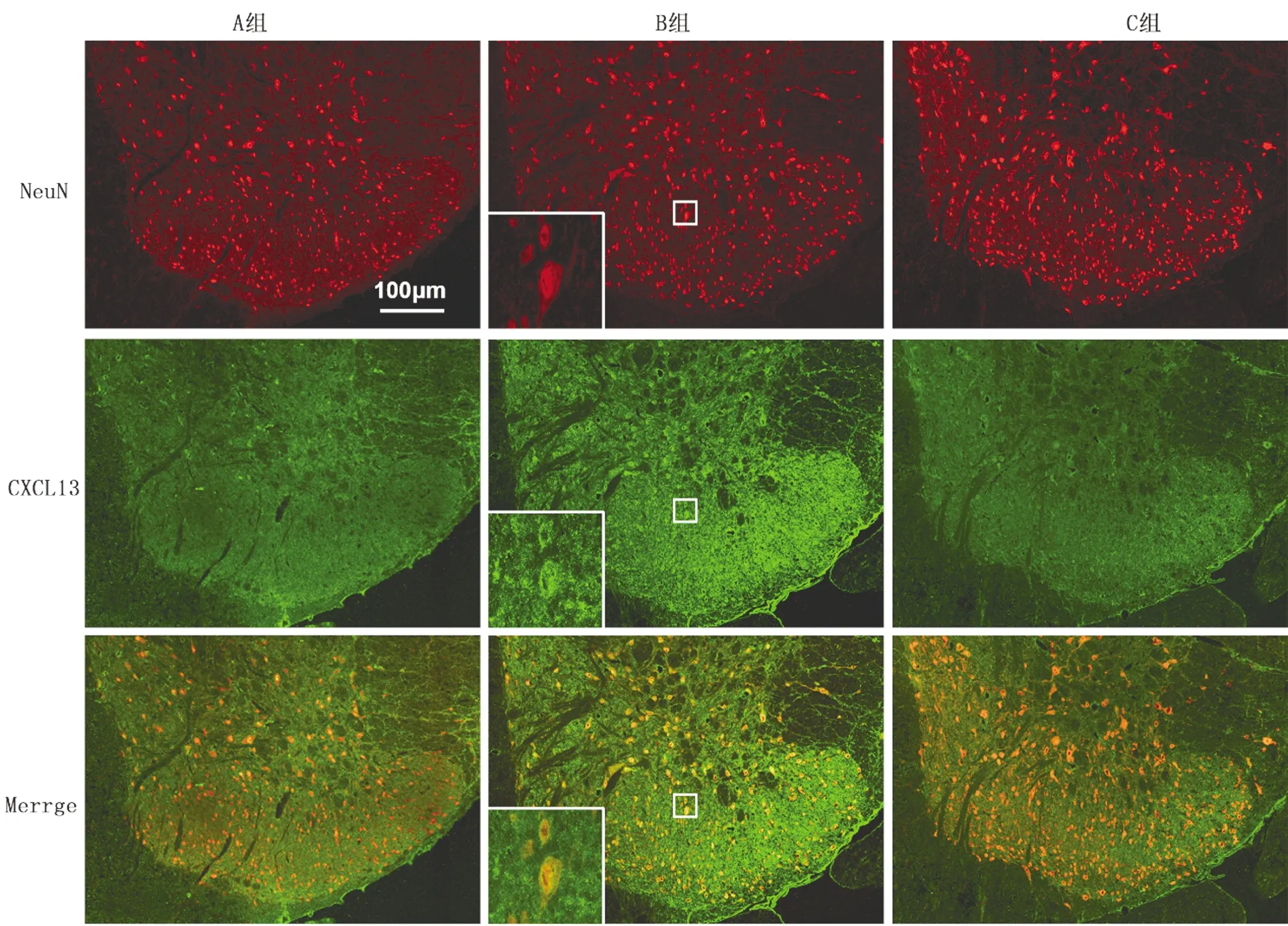
图2 CXCL13在脊髓背角神经元的表达(免疫荧光双标,×20)
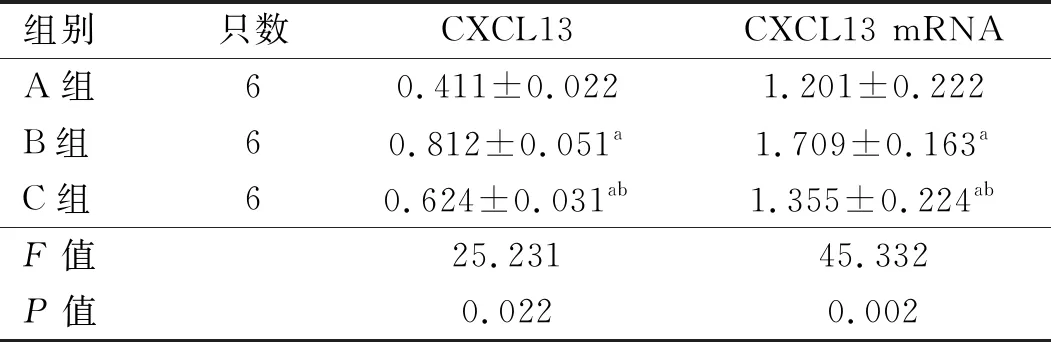
表2 3组大鼠CXCL13 蛋白含量及其mRNA表达
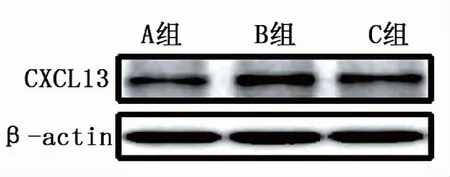
图3 3组大鼠CXCL13 蛋白表达情况
3 讨论
骨癌痛是原发性或转移性骨肿瘤引起的慢性疼痛,是癌症患者晚期骨转移后最常见的并发症。据世界卫生组织统计,癌症患者中约1/3的恶性肿瘤会发生骨转移。绝大部分骨肿瘤患者会出现不同程度的慢性疼痛。由于目前尚无确切治疗方法,约50%的骨癌患者疼痛未得到有效控制。长期慢性疼痛给患者及其家人带来巨大痛苦,严重影响患者生活质量。所以寻找有效的癌痛治疗措施,是目前亟待解决的问题。
胫骨癌痛模型是进行癌痛研究的常见模型之一,通过将肿瘤细胞注射到胫骨骨髓腔内,模拟骨转移癌的病理学特征[6],本实验采用了癌细胞胫骨骨髓腔注射的方式建立癌痛模型,通过行为学检测和胫骨病理切片检测,证实了骨癌痛模型制备成功。
AGM是一种内源性阳离子聚胺[3, 7],几乎分布于哺乳动物体内的所有器官,可作用于哺乳动物神经递质系统,同时调控天冬氨酸、聚胺及一氧化氮合成与代谢,在机体病理生理改变及细胞修复机制中起着重要作用。研究[8]证实,AGM可显著增加阿片类药物的镇痛强度,还能有效地预防和治疗吗啡的成瘾性[9];在神经病理性疼痛模型中,AGM可呈剂量依赖性地增加大鼠机械痛阈值[10-11]。本实验建立大鼠骨癌痛模型,通过连续鞘内注射AGM结合行为学检测,结果显示,建模后12天,B 、 C组大鼠机械缩足反射阈值均明显低于A组,C 组机械缩足反射阈值高于B组(P<0.05),证明AGM可有效缓解骨癌痛大鼠的痛觉过敏,但其疼痛治疗的作用机制尚不清楚。
骨癌痛发生机制十分复杂[12],目前公认的骨癌痛发病机制包括局部缺血缺氧微环境改变、各种细胞因子高表达导致胶质细胞的活化以及突触重塑导致的中枢敏化等。事实上这些机制可能存在相互协同作用,在骨癌痛的发生和维持中意义重大。
趋化因子CXCL13 作为重要的细胞因子,在疼痛中发挥的重要作用逐渐受到学者关注。研究[13-14]证实,脊髓CXCL13通过激活小胶质细胞参与大鼠骨癌痛的形成与维持,CXCL13的活化是调控大鼠痛觉过敏的关键环节[15];神经病理性痛模型实验中发现脊髓中趋化因子基因上调,尤其是CXCL13,其基因上调幅度最大[16]。本研究通过检测CXCL13在脊髓背角神经元上表达,定量分析显示,建模后12天,与A组比较,B、C组大鼠CXCL13 蛋白及mRNA表达明显增加(P<0.05)。提示上调神经元中CXCL13表达促进了骨癌痛的形成过程,其机制可能与神经病理性疼痛相同,与CXCL13激活脊髓背角胶质细胞有关,说明神经元和胶质细胞之间的相互作用在疼痛形成过程中有重要意义。本实验中通过鞘内置管给药,连续鞘内注射AGM后发现,与B组比较, C组大鼠脊髓CXCL13 蛋白及其mRNA表达减低(P<0.05),说明AGM可通过抑制CXCL13表达而发挥镇痛作用,其镇痛作用可能与CXCL13调控角质细胞活性有关。
综上所述,AGM鞘内注射可缓解骨癌痛大鼠的痛觉过敏,其机制可能为抑制骨癌痛大鼠脊髓神经元中CXCL13表达,抑制中枢敏化形成,发挥镇痛作用。但AGM是否直接作用于胶质细胞而发挥镇痛作用并不清楚。另外,AGM应用的副作用以及是否对肿瘤本身产生作用也有待进一步深入研究。
