高效液相色谱-原子荧光光谱联用法测定鱼肉罐头中甲基汞的不确定度分析
2020-07-14赵娜娜袁堃周赛静
赵娜娜 袁堃 周赛静


摘要 采用液相色谱-原子荧光光谱联用法测定鱼肉罐头中甲基汞含量,通过建立不确定度评估的数学模型,分析不确定度的主要来源,并对各不确定度分量、合成不确定度和扩展不确定度进行计算。结果表明,样品中甲基汞含量为0.048 mg/kg,其扩展不确定度为0.004 6 mg/kg(k=2),不确定度主要来源是标准曲线拟合、标准溶液配制、测量重复性和提取效率,其中影响不确定度的最大因素是标准曲线拟合,其次是标准溶液配制,样品称量对不确定度影响最小。
关键词 高效液相色谱-原子荧光光谱联用法;甲基汞;不确定度;金枪鱼罐头
Abstract The content of methylmercury in tinned tuna was determined by high performance liquid chromatography combined with atomic fluorescence spectrometry (HPLCAFS).The sources of uncertainty in the measurement process by mathematical modeling were systematically analyzed.The main uncertainty components,combined uncertainty and expanded uncertainty for the determination of methylmercury were calculated.The results showed that when the content of methylmercury in tinned tuna was 0.048 mg/kg,and the extended uncertainty was 0.004 6 mg/kg(k=2).The major factors which affected the uncertainty came from standard curve fitting,standard solution preparation,sample repeatability tests and extraction efficiency.The most important factor which affected the uncertainty was standard curve fitting,followed by standard solution preparation.The influence of the sample weighing on the uncertainty was the smallest.
Key words High performance liquid chromatography combined with atomic fluorescence spectrometry (HPLCAFS);Methylmercury;Uncertainty;Tinned tuna
汞及其化合物在環境中普遍存在,因其具有的高致毒性、持久性和长距离迁移性等特点,是一种全世界公认的持久性有毒物质(persistent toxic substance,PTS)[1]。食品中的汞主要以无机汞和有机汞的形态存在,其中,有机汞的毒性是无机汞的几百倍,而在有机汞中甲基汞的毒性最大。无机汞可以通过生物甲基化或者光化学反应等过程转化为毒性更强的甲基汞[2-7]。甲基汞主要损害中枢神经系统,对胎儿也有明显的致畸作用。由于环境的污染和生物链的富集作用,水产动物及其制品易受甲基汞的污染[8-11]。
笔者以基质复杂的鱼肉罐头为研究对象,采用液相色谱-原子荧光光谱联用方法测定其甲基汞含量,并依据JJF 1059.1—2012《测量不确定度评定与表示》[12]对检测结果进行不确定度评估。该试验是以日常检测工作为基础建立的评定方法,可以真实反映实验室检测结果的置信水平,给出结果判定的风险,为检测结果的科学性提供可靠的理论依据。
1 材料与方法
1.1 仪器与试剂
液相色谱-原子荧光光谱联用(中国吉天SA-50);高速冷冻离心机(美国Thermo公司);振荡器(德国IKA);XPE-205电子天平(中国梅特勒-托利多仪器(上海)有限公司)。
甲基汞标准溶液:甲基汞溶液(65.0±2.5)μg/g,中国计量科学研究院; 乙腈、乙酸铵为色谱纯,盐酸、氨水为优级纯,其余试剂均为分析纯。
1.2 仪器条件
1.2.1 色谱条件。
色谱柱:C18柱(柱长150 mm,内径4.6 mm,粒径5 μm);流动相:0.06 mol/L乙酸铵 +0.1% L-半胱氨酸+5%乙腈;流速:1.0 mL/min。进样量:100 μL。
1.2.2 光谱条件。负高压:280 V;灯电流:30 mA;载气流速:300 mL/min;屏蔽气流速:600 mL/min;泵速:65 r/min;载流:7%盐酸;还原剂:2% KBH4-0.5%KOH混合液;氧化剂:0.2%K2S2O8-0.5%KOH混合液。
1.3 检验方法 依据国家标准GB 5009.17—2014 《食品中总汞及有机汞的测定》[13]第二篇食品中甲基汞的测定。
1.3.1 样品前处理。
准确称取样品1.0 g(精确至0.000 1 g)于高速离心管中,加入盐酸溶液(5 mol/L)10 mL,涡旋混匀,放置过夜。室温下超声水浴提取60 min,期间振摇数次,离心15 min(4 ℃,8 000 r/min)。准确吸取2.0 mL上清液至5 mL 容量瓶中,缓慢逐滴加入氢氧化钠溶液(6 mol/L)调节样液pH为2~7。加入0.1 mL的L-半胱氨酸溶液(10 g/L),用水定容至刻度。经0.22 μm有机滤膜过滤后上机测定。按同一操作方法作空白试验。
1.3.2 标准溶液的配制。
称取甲基汞溶液0.769 2 g于50 mL容量瓶中,用纯水稀释定容至刻度,摇匀,得浓度为1.0 μg/mL的甲基汞标准储备溶液。用100~1 000 μL移液枪移取1.00 mL 储备液至10 mL容量瓶中,用纯水稀释定容至刻度,得浓度为100 ng/mL的甲基汞标准中间液。分别移取 0、100、200、400、600、1 000 μL的甲基汞标准中间液(100 ng/mL)至10 mL容量瓶中,用纯水稀释定容至刻度,得到浓度分别为0、1.0、2.0、4.0、6.0、10.0 ng/mL的标准工作液。
1.3.3 数学模型的建立。金枪鱼罐头中甲基汞含量计算公式如下:
式中,X为样品中甲基汞的含量(mg/kg);C0为空白溶液中甲基汞浓度(ng/mL);C为试样溶液中甲基汞浓度(ng/mL);V为试样提取液体积(mL);m为试样质量(g);1 000为换算系数;frec为回收率校正因子。
2 不確定度的分析
根据测量过程和数学模型分析,影响鱼肉罐头中甲基汞含量结果不确定度的因素主要包括称样量、样品前处理、标准溶液配制、样品测定重复性、回收率。
2.1 样品称量引入的相对标准不确定度Urel(m) 样品的称样量为m=1.0 g,天平的最大允许误差为±0.1 mg,为B类评定,按矩形分布,k=3,则其标准不确定度为:U1(m)=a/k=0.000 057 7。由于样品称量包括空杯清零和实际样品称量2次操作,计算称量2次的标准不确定度为:U(m)=U20(m)+U21(m)=0.000 081 6,相对标准不确定度为:Urel(m)=U(m)/m=0.000 081 6。
2.2 样品定容体积引入的相对标准不确定度Urel(V) 样品提取过程中用到了10 mL移液器(加盐酸10 mL)、5 mL移液器(吸取2.0 mL上清液)和5 mL容量瓶(定容),分别计算其不确定度。
依据JJG 646—2006《移液器检定规程》[14],10 mL移液器的最大允许误差为0.6%,5 mL移液器的最大允许误差为0.5%,按矩形分布,k=3,则其相对标准不确定度分别为:Urel(V10 mL)=0.6%3=0.003 46、Urel(V5 mL)=0.5%3=0.002 89。
样品处理完成后定容至5 mL容量瓶中,不确定度主要来源包括:①容量瓶最大允许误差引入的不确定度Urel(V1′),依据JJG 196—2006《常用玻璃量器检定规程》[15],A级5 mL容量瓶的最大允许误差为±0.020 mL,按三角分布,k=6,相对标准不确定度为:Urel(V1′)=0.0206×5=0.001 63;②温度误差引入的不确定度Urel(T1′),实验室温度变化范围为(20±5)℃,水在20 ℃的膨胀系数为α=2.1×10-4℃-1,由温度变化引起溶剂体积改变的标准不确定度为:U(T1′)=ΔV/k=(V×ΔT×α)/k,相对标准不确定度为Urel(T1′)=0.000 606。5 mL 容量瓶的合成相对不确定度为Urel(V5 mL)=U2rel(V1′)+U2rel(T1′)=0.001 74。样品定容体积引入的相对标准不确定度为:Urel(V′)=U2rel(V10 mL)+U2rel(V5 mL)+U2rel(V5 mL′)=0.004 83。
2.3 甲基汞标准溶液配制过程引入的相对标准不确定度Urel(C)
2.3.1 标准物质含量的相对标准不确定度Urel(CS)。甲基汞溶液标准物质为中国计量科学研究院提供,甲基汞含量为65.0 μg/g,其扩展不确定度为2.5 μg/g,k=2,标准物质的称量引入的相对标准不确定度为:Urel(Cs)=2.565.0×2=0.019 2。
2.3.2 标准物质的称量引入的相对标准不确定度Urel(m1)。标准物质称样量为0.769 2 g,天平的最大允许误差为±0.1 mg,按矩形分布处理,k=3,则标准物质在2次称量过程(清零和实际称量)中产生的相对标准不确定度:Urel(m1)=0.000 1×23×0.769 2=0.000 106。
2.3.3 标准溶液稀释过程中玻璃量器和移液器引入的不确定度Urel(VC)。
该项不确定度主要来源包括量器最大允许误差引入的不确定度Urel(V)、温度误差引入的不确定度Urel (T)。实验室温度变化范围为(20±5)℃,水在20 ℃的膨胀系数为2.1×10-4 ℃-1。标准溶液稀释过程中玻璃量器和移液器容量最大允许误差引入的不确定度见表1,温度误差引入的不确定度见表2,各量器相对标准不确定度见表3。
综上所述,甲基汞标准溶液配制过程中引入的合成相对标准不确度:Urel(C)=U2rel(CS)+U2rel(m1)+U2rel(VC)=0.026 9。
2.4 标准曲线拟合过程的相对标准不确定度Urel(Cstd)
利用液相色谱-原子荧光光谱联用仪对浓度分别为1、2、4、6、10 μg/L 的甲基汞标准工作液进行峰面积的测定,每个浓度点测定2 次,采用线性最小二乘法拟合标准工作曲线,结果详见表4。同时对鱼罐头样品在进行6次重复测定,根据如下公式对标准曲线拟合过程中引入的不确定度进行计算:
式中,b为标准曲线斜率,p 为测定样液的测定次数, p=6;m为每个浓度点的测定次数,m=2;n为标准溶液浓度点的总数, n=5;
C0为样品中甲基汞的质量浓度的平均值,C0=1.85 μg/L;Cij为标准溶液各校准点的浓度;C为标准曲线中校准点Cij的质量浓度平均值;Sij为各质量浓度点测定的峰面积;Si为由标准曲线计算得到的各质量浓度点的峰面积。根据表4的数据计算S(S)=2 282、SC=102.4、U(Cstd)=0.060 7、Urel(Cstd)=U(Cstd)C0=0.032 8。
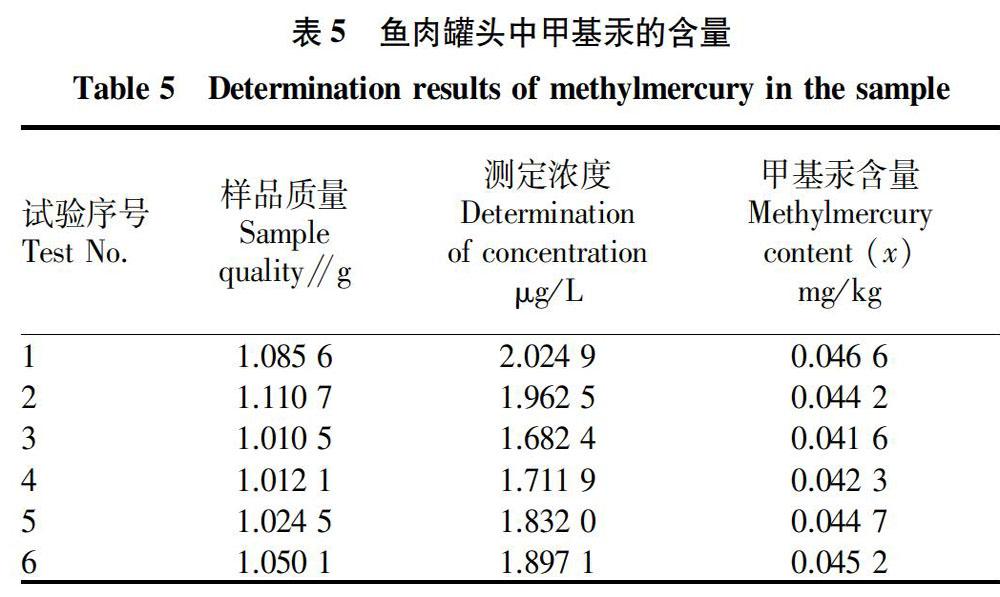
2.5 测量重复性引入的相对标准不确定度Urel(Rep) 在重复性条件下,对鱼肉罐头中甲基汞的含量进行了6次独立试验(n=6),所得测量数据见表5。由表5计算鱼肉罐头中甲基汞含量的平均值为=0.044 1 mg/kg,标准偏差为S=0.001 86,由测量重复性引入的相对标准不确定度:Urel(Rep)=sn×=0.017 2。
2.6 提取效率引入的相对标准不确定度Urel(Rec)
由于样品提取不完全或提取过程中导致甲基汞的损失等,使鱼肉罐头中的甲基汞不能100%进入到测定液中,因此,该试验在试样中添加3组不同含量的甲基汞标准溶液(0.05、0.10、0.15 mg/kg),考察回收率对不确定度的影响,即用回收率平均值的标准偏差评估样品提取效率引入的标准不确定度。同时根据t检验判断平均回收率与100%是否有显著性差异。
经计算,甲基汞的平均回收率为Rec=91.3%,标准偏差S(Rec)=3.13%。查t检验临界值分布表JJF 1059.1—2012《测量不确定度评定与表示》[12],t(95,n-1)=t(95,8)=2.31,该试验中t值8.34大于t(95,8),因此,该试验的回收率与100%有显著性差异,必须在计算结果的公式中乘以回收率校正因子(frec=1Rec)对结果进行修正,最后得出Urel(Rec)=S(Rec)Rec×n=0.011 4。
2.7 合成不确定度 将各不确定度分量来源及量值列于表6。
从表6可以看出,对测定结果影响较大的不确定度来源是标准溶液配制、标准曲线拟合、测量重复性和提取效率,样品称量和定容引入的相对不确定度较小。各不确定度分量相互独立,因此,合成相对不确定度为:
合成标准不确定度:U(X)=Urel(X)×X=0.002 3(X为表5的样品测定浓度按照甲基汞计算公式得到的平均值)。依据JJF 1135—2005《化学分析测量不确定度评定》[16],在0.05的置信水平下,取包含因子k=2,扩展不确定度U=k×U(X)=0.004 6。鱼肉罐头中甲基汞的测定结果:X=(0.048 0±0.004 6)mg/kg,k=2。
3 结论
该研究采用液相色谱-原子荧光光谱联用法测定鱼肉罐头中的甲基汞,对测定过程中不确定度的主要来源及各不确定分量进行评定。结果表明,不确定度主要来源是标准溶液配制、标准曲线拟合、测量重复性和提取效率,其中影响不确定度的最大因素是标准曲线拟合,其次是标准溶液配制,样品称量和定容对不确定度影响较小。
因此,在今后的检测过程中,重点监控标准曲线带来的不确定度,通过选择高纯度的标准品和高精度的量器、增加测量次数、提高检验人员的操作水平、注意仪器的维护保养使其保持较高灵敏度等措施减少测量数据的不确定性,保证检测结果的准确性。
参考文献
[1] 张文凤,张冠文,陈云,等.生物样品汞形态分析方法的研究进展[J].食品研究与开发,2019,40(9):210-216.
[2] LIU J L,XU X R,YU S,et al.Mercury pollution in fish from South China Sea:Levels,speciesspecific accumulation,and possible sources[J].Environmental research,2014,131(4):160-164.
[3] 李瑞陽,徐晓航,许志东,等.贵州某典型汞矿区流域水稻中总汞和甲基汞含量及暴露风险[J].环境科学研究,2016,29(12):1829-1839.
[4] 张秀尧,蔡欣欣,张晓艺.稳定同位素稀释-气相色谱质谱联用法测定水产品中甲基汞和乙基汞[J].分析化学,2014,42(10):1524-1529.
[5] 毛永杨,杨桐,苏涛,等.高效液相色谱-原子荧光光谱联用法测定牛肝菌中无机汞、甲基汞、乙基汞的不确定度评估[J].食品科学,2017,38(24):272-277.
[6] RENIERI E A,SAFENKOVA I V,ALEGAKIS A K,et al.Cadmium,lead and mercury in muscle tissue of gilthead seabream and seabass:Risk evaluation for consumers [J].Food and chemical toxicology,2019,124:439-449.
[7] 耿安静,陈岩,杨慧,等.大米中甲基汞污染状况及防控对策研究[J].农产品质量与安全, 2019(1):62-69.
[8] 李继源.鱼类甲基汞检测方法优化及在校学生摄食鱼类汞风险评估研究[D].上海:上海海洋大学,2015.
[9] 陈德泉,李岩,叶泽波.加速溶剂提取-液相色谱-原子荧光光谱法测定对虾饲料中5种形态的汞[J].理化检验(化学分册),2018,54(6):698-702.
[10] 刘秀红,罗秋红,马文天,等.市售婴幼儿辅助食品中砷、汞污染情况的调查与分析[J].食品安全质量检测学报,2019,10(9):2672-2677.
[11] 乔晴,何兵兵,王向军,等.超声辅助提取—HPLC—ICP—MS同时测定水产及其制品中3种形态汞的含量[J].食品与机械,2017,33(7):65-69,154.
[12] 国家质量监督检验检疫总局.测量不确定度评定与表示:JJF 1059.1—2012[S].北京:中国质检出版社,2013.
[13] 国家卫生和计划生育委员会.食品安全国家标准 食品中总汞及有机汞的测定:GB 5009.17—2014[S].北京:中国标准出版社,2015.
[14] 国家质量监督检验检疫总局.移液器检定规程:JJG 646—2006[S].北京:中国计量出版社,2006.
[15] 国家质量监督检验检疫总局.常用玻璃量器检定规程:JJG 196—2006[S].北京:中国计量出版社,2006.
[16] 国家质量监督检验检疫总局.化学分析测量不确定度评定:JJF 1135—2005[S].北京:中国计量出版社,2005.
