白桦BpJMJ18基因启动子克隆及表达分析
2020-07-14王万奇齐婉竹赵秋爽付鹏跃曲冠证赵曦阳
王万奇 齐婉竹 赵秋爽 曾 栋 刘 轶 付鹏跃 曲冠证 赵曦阳*
(1.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040; 2.吉林师范大学生命科学学院,四平 136000; 3.北华大学林学院,吉林 132013)
JMJ类蛋白是通过组蛋白的去甲基化以及与其他染色质修饰互作等方式,参与许多基因表达和染色质活动的调控,进一步影响生物生长发育、代谢和环境响应等生物学过程[1]。JMJ类蛋白成员数目众多,按照JmjC结构域的序列分析,可以将其分为7大类[2]:JARID类,具有H3K4去甲基化活性[3];JMJD2亚家族,是H3K9和H3K36的去甲基化酶[4];JHDM2类,能够去除H3K9me2[5];JMJD6类,只含有JmjC结构域,能够去除精氨酸甲基化[6];UTX/JMJD3和JHDM1是动物所特有的两类蛋白[7];而植物所特有的一类蛋白中,JMJ14成员是H3K4去甲基化酶基因,该基因在调控拟南芥开花中扮演重要的角色,能够与两个NAC家族转录因子互作来影响植株的生长发育[8]。此外,JmjC结构域属于Cupin超家族。JmjC结构域蛋白可能是催化组蛋白修饰的蛋白质羟化酶。同时,通过对本研究的JMJ18蛋白序列分析发现,该序列除含有FRY、FYRC、JmjC、JmjN结构域外,也含有C5HC2类的锌指结构域,而该结构域极有可能与特定序列的DNA结合,发挥类似转录因子的作用。
JMJ蛋白功能最初是在动物中发现的,它能影响小鼠(Mus musculus)的大脑和心脏发育[9~10],而植物中的JMJ蛋白虽然没有动物当中研究的那么广泛且深入,但就前人已有的研究发现JMJ蛋白能够参与植物器官发育、生殖过程、激素应答及DNA甲基化等多个生物学过程[11]。植物中最早发现的具有组蛋白去甲基化酶活性的是IBM1(即JMJ25),它能影响植株的许多表型[12];且到目前为止,JMJ蛋白的研究多数集中在拟南芥(Arabidopsisthaliana)和水稻(Oryzasativa)等草本植物中,例如:JHDM家族的JMJ12基因与拟南芥的花期有密切的关系[13];水稻中的组蛋白去甲基化酶JMJ705可以通过提高抗性基因的表达来去除H3K27的甲基化,进而提高水稻对白叶枯病的抗性[14];JMJ706基因突变后能够引起水稻花器官发育异常,进而影响花器官的形态建成[2];OsJMJ718基因在水稻的生殖发育阶段也能够呈现不同的动态表达模式[15];JMJ703突变后能够影响植物细胞分裂,从而使茎干和幼穗发育受到影响[16]。综上所述,不同植物中JMJ基因功能不尽相同,但均表明该基因与植物生长发育密切相关。
白桦(Betulaplatyphylla)是桦木科(Betulaceace)树种落叶乔木,是我国东北地区重要的阔叶落叶林及针叶阔叶混交林中常见树种,其具有生长快、木材细腻、适应性强等特点,是东北地区木材生产的重要材料,具有极高的研究和利用价值[17]。由于白桦全基因组已被测定[18],很多基因功能的开发与验证均以白桦为基础材料,例如:杨洋以白桦为实验材料来研究BpTCP基因在植物生长发育过程中发挥的作用,进而揭示BpTCP基因的生物学功能[19];李蕾蕾等[20]为了解GT14基因在生长发育过程中的功能及对环境的适应机制,选取白桦为材料,对该基因的启动子进行了相关的研究;同时,王宇航[21]也以白桦的锌指蛋白转录因子基因为研究对象,对基因的表达和功能进行了初步研究,但到目前为止对JMJ类基因在木本植物中的功能研究较少。本研究以白桦为研究对象,对BpJMJ18基因的启动子进行克隆,通过构建植物表达载体,并用农杆菌介导的瞬时转化法及原生质体瞬时转化,研究其BpJMJ18基因的组织表达模式以及BpJMJ18蛋白定位区域,为后续进一步研究JMJ18基因在植物生长发育方面的功能奠定重要基础。
1 材料与方法
1.1 实验材料
于2016年4月在东北林业大学林木遗传育种白桦强化育种基地,采集4年生的白桦优树嫩叶建立组培体系,并获得白桦组培苗。本研究选取生长1个月左右的组培苗进行白桦GUS组织化学染色,同时依次选取组培苗经盆栽生长2个月植株的顶芽、幼叶、成熟叶、初生茎、过渡茎、成熟茎及根进行不同组织部位的特异性表达分析。
1.2 主要试剂及菌株
TransStart®FastPfu Fly DNA Polymerase购自全式金;同源重组酶Mut Express® Ⅱ Fast Mutagenesis Kit V2购自诺唯赞公司;Plasmid mini Kit Ⅰ、Gel extraction kit购自杭州博日科技(Bioer)有限公司;DNA Marker DL5000、反转录试剂盒、SYBR® Premix Ex TaqTMⅡ、DNA连接酶、限制性内切酶HindⅢ等均购自TaKaRa公司(大连);大肠杆菌感受态(Trans1-T1)购自TransGen Biotech公司;农杆菌感受态(GV3101)购自上海唯地生物技术有限公司;pBI101-35S::GUS载体质粒由本实验室提供,其他实验试剂均为进口或国产分析纯。
1.3 实验方法
1.3.1 白桦BpJMJ18基因组织特异性表达分析
利用CTAB法[22]分别提取盆栽生长2个月白桦顶芽、幼叶、成熟叶、初生茎、过渡茎、成熟茎及根的RNA,利用TaKaRa公司的反转录试剂盒将其总RNA反转录为cDNA,反转录的cDNA稀释10倍作为定量PCR的模板,选用18S基因作为内参,其在NCBI网站的登录号为:MK388236.1,来检测目的基因在不同组织部位的表达情况。定量PCR使用的相关引物如下表1所示,反应体系为:20 μL;其中2×SYBR Green 10 μL,ROX Dye Ⅱ 0.4 μL,正向引物(JMJ18-RT-F)和反向引物(JMJ18-RT-R)各0.8 μL,反应程序为:95℃ 30 s;95℃ 5 s;60℃ 35 s;40cycle;95℃ 15 s;60℃ 1 min;95℃ 15 s。每个样品设置3次生物学重复,并通过2-ΔΔCt法进行数据分析。
表1 实时荧光定量PCR引物
Table 1 Primer sequence of the quantitative real-time PCR
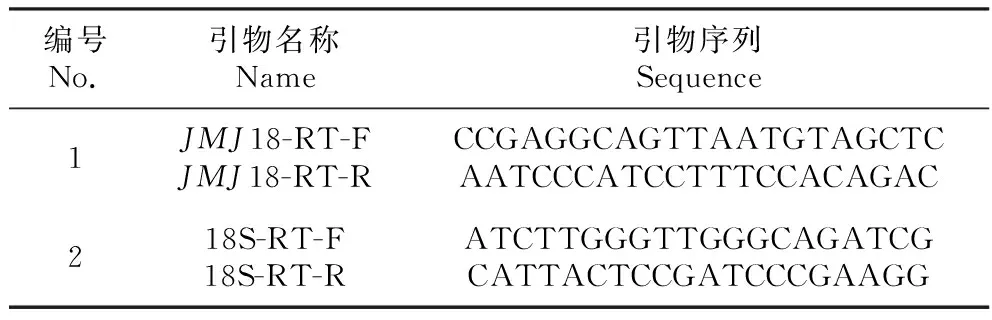
编号No.引物名称Name引物序列Sequence1JMJ18-RT-FJMJ18-RT-RCCGAGGCAGTTAATGTAGCTCAATCCCATCCTTTCCACAGAC218S-RT-F18S-RT-RATCTTGGGTTGGGCAGATCGCATTACTCCGATCCCGAAGG
1.3.2 白桦BpJMJ18基因启动子的克隆
根据已知的BpJMJ18基因在拟南芥中的序列,其在拟南芥Tair网站的命名为At1g30810,与白桦基因组数据库进行对比,克隆了白桦BpJMJ18基因上游1 932 bp的启动子区域,并设计带有酶切位点的引物,引物由吉林省库美生物科技有限公司合成。上、下游引物序列分别为BpJMJ18-promoter-F:5′-FATCAAGCTTAGTCAAAGCATCCTATGAAAACCCAGC-3′(下划线处为HindⅢ酶切位点);BpJMJ18-promoter-R:5′-ATCAAGCTTAGTCAAAGCATCCTATGAAAACCCAGC-3′(下划线处为HindⅢ酶切位点);以白桦组培苗叶片基因组DNA为模板扩增全长启动子序列,PCR反应体系为50 μL,含10 μL 5×pfu Buffer、4 μL 2.5 mmol·L-1High pure dNTPs、1.0 μL上游引物(BpJMJ18-promoter-F)、1.0 μL下游引物(BpJMJ18-promoter-R)、2.0 μL模板、1.0 μL pfu酶、31 μL ddH2O。反应条件为95℃预变性2 min;95℃变性20 s,57℃退火20 s,72℃延伸1 min,40个循环;72℃延伸5 min。PCR反应完成后将产物经1.0%的琼脂糖凝胶电泳检测。
1.3.3 白桦BpJMJ18基因启动子序列分析
利用PLACE数据库(http://www.dna.affrc.go.jp/PLACE)和Plant CARE数据库(http://bioinformatics.psb.ugent.Be/webtools/plantcare/html)在线分析软件,对BpJMJ18基因进行启动子顺式作用元件分析。
1.3.4 pBI101-BpJMJ18pro::GUS载体构建及瞬时转化
通过1.3.1中引物扩增目的片段,连接pEASY-Blunt载体并转化大肠杆菌Trans1-T1,随机挑取6个单克隆,进行PCR检测并送至擎科生物公司测序保存。将测序结果正确的菌液扩大培养,利用限制性内切酶HindⅢ对pEASY-Blunt-BpJMJ18-promoter和pBI101-35S::GUS质粒进行单酶切,分别回收目的片段,利用TaKaRa公司的SolutionⅠ进行连接并转化大肠杆菌。随机挑取单克隆进行PCR检测,将获得的阳性转化子菌液送公司测序,保存测序正确的重组质粒,命名为:pBI101-BpJMJ18pro::GUS。最后采用液氮冻融法将重组质粒转入农杆菌GV3101中,挑取单克隆经菌液PCR验证转化子。
参考李萌[23]等瞬时转化白桦的方法,并修改如下:将pBI101-BpJMJ18pro::GUS菌种接种到7 mL含卡那霉素的液体LB培养基中,28℃ 180 r·min-1震荡过夜进行活化培养;第二天接种活化好的菌液于100 mL含卡那霉素的液体LB培养基中,28℃ 180 r·min-1震荡培养至OD600=0.5,收集菌体,用1/2MS液体培养基将菌体进行重悬,使其OD600=0.8,取长势良好的白桦组培苗放入制备好的菌液中,25℃ 120 r·min-1培养2 d,每间隔16 h更换1次1/2MS液体培养基。
1.3.5 GUS组织化学染色分析
将瞬时侵染后的白桦苗放置于GUS染液中(配方如下:100 mL 50 mmol·L-1磷酸钠缓冲液(pH7.0),0.372 g 10 mmol·L-1EDTA·2 Na溶液,100 μL 0.1% Triton X-100,0.016 5 mg 0.5 mmol·L-1亚铁氰化钾,0.021 1 mg 0.5 mmol·L-1铁氰化钾,500 μL 1 mg·L-1X-Gluc),进行GUS染色,37℃条件下避光温浴过夜培养,将植株置于脱色液中脱色6~8 h(脱色液∶无水乙醇∶冰乙酸=3∶1),期间及时更换脱色液。待脱色完全后,通过显微镜观察BpJMJ18基因启动子的表达情况并拍照保存。
2 结果与分析
2.1 白桦BpJMJ18基因组织特异性表达分析
为了研究白桦BpJMJ18基因在各个组织部位的表达情况,提取白桦顶芽、幼叶、成熟叶、初生茎、过渡茎、成熟茎及根的total RNA,进行荧光定量PCR检测,结果如图1所示。表明BpJMJ18基因在各个组织部位中均有所表达,且BpJMJ18基因的表达模式在根和幼叶中的表达水平高于其他组织部位,在成熟茎的表达量相对较低,上述结果说明BpJMJ18基因在植株的根和叶中表达更为广泛。
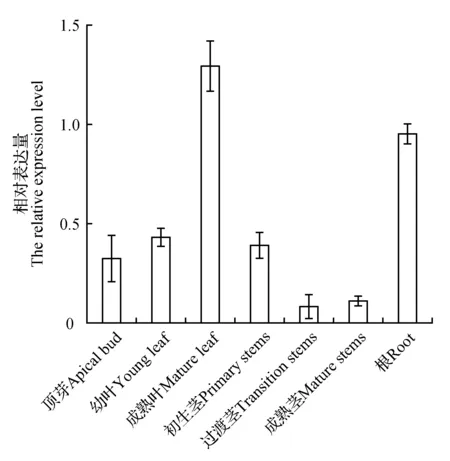
图1 BpJMJ18基因在白桦不同组织表达分析Fig.1 Expression analysis of BpJMJ18 gene in different tissues of B.platyphylla
2.2 白桦BpJMJ18基因启动子的克隆
通过上述组织特异性表达分析结果,利用PCR技术从白桦叶片中扩增出长度为1 932 bp的目的片段(见图2A),胶回收目的片段后连接pEASY-Blunt载体,转化大肠杆菌Trans1-T1感受态,随机挑取6个单克隆进行菌液PCR检测(见图2B)。将菌液检测成功的转化子送公司进行测序,结果表明插入目的片段未发生碱基突变,成功克隆BpJMJ18基因启动子。
2.3 白桦BpJMJ18基因启动子的序列分析及元件预测
利用PLACE和Plant CARE数据库对1 932 bp启动子进行顺式作用元件预测分析,结果如图3所示,该序列中除含有TATA-box和CAAT-box等基本顺式作用元件外,还具有光响应元件如G-Box、Box4、GT1-motif、TCT-motif;参与脱落酸反应的元件ABRE;MEJA反应的调节元件CGTCA-motif;厌氧诱导所必须的调节元件ARE;赤霉素和生长素响应元件P-box、TGA-element;除上述相关的响应元件外,BpJMJ18启动子还具有分生组织表达相关作用元件CAT-box(见表2)。由此可以推测BpJMJ18启动子可能在空间表达过程中受到光周期的调控、参与多种植物激素的响应,具有多种生物学功能,在植物生长发育过程中扮演不同角色。
2.4 pBI101-BpJMJ18pro::GUS载体构建
将测序正确的pEASY-Blunt-BpJMJ18pro菌液提取质粒,利用限制性内切酶HindⅢ对pEASY-Blunt-BpJMJ18pro和pBI101-GUS进行单酶切(见图4A),回收目的片段,利用TaKaRa公司的SolutionⅠ进行连接,转化大肠杆菌(Trans1-T1),随机挑取单克隆进行菌液PCR检测(见图4B),检测正确的转化子送擎科公司进行测序,结果表明插入的BpJMJ18启动子序列未发生碱基突变,至此植物表达载体构建完成,构建示意图如图4所示,并命名为pBI101-BpJMJ18pro::GUS。然后将pBI101-BpJMJ18pro::GUS质粒转入农杆菌感受态GV3101中,随机挑选单克隆进行PCR检测(见图4C)。
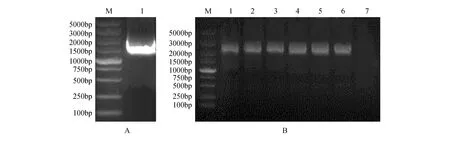
图2 白桦BpJMJ18基因启动子的克隆及鉴定 A. BpJMJ18启动子的克隆(M. DNA marker DL5000;1.JMJ18启动子的PCR扩增产物);B.pEASY-BpJMJ18pro载体在大肠杆菌菌液中的PCR检测(M. DNA marker DL5000;1~6.pEASY-BpJMJ18pro转化子的菌液PCR检测;7.阴性对照)Fig.2 The clone and verification of BpJMJ18 gene promoter from B.platyphylla A. The cloning of BpJMJ18 promoter(M. DNA marker DL5000; 1. PCR amplification product of JMJ18 promoter); B. PCR detection of pEASY-BpJMJ18pro vector in E.coli(M. DNA marker DL5000; 1-6. PCR detection of pEASY-BpJMJ18pro transformants; 7.Negative control)

图3 BpJMJ18启动子作用元件示意图Fig.3 BpJMJ18 promoter action element diagram
2.5 白桦BpJMJ18基因启动子瞬时转化及活性分析
为了进一步验证BpJMJ18启动子在白桦中的表达活性,我们将用农杆菌介导的瞬时转化法侵染白桦组培苗,进行了3次重复试验并通过GUS染色观察其表达特征。结果如图5A所示,发现BpJMJ18启动子驱动的GUS基因在白桦的主根、侧根、根尖、叶片的维管束和嫩茎中均检测到表达,在老茎中表达水平较低,而未经过侵染的野生型白桦未检测到GUS活性(见图5:B~E),这与前人在拟南芥中进行GUS组织化学染色表现出相似的表达模式。说明BpJMJ18启动子具有驱动GUS表达活性的能力,并在白桦植株的各个组织部位中发挥作用进而影响植株的生长发育。

表2 BpJMJ18启动子中顺式作用元件
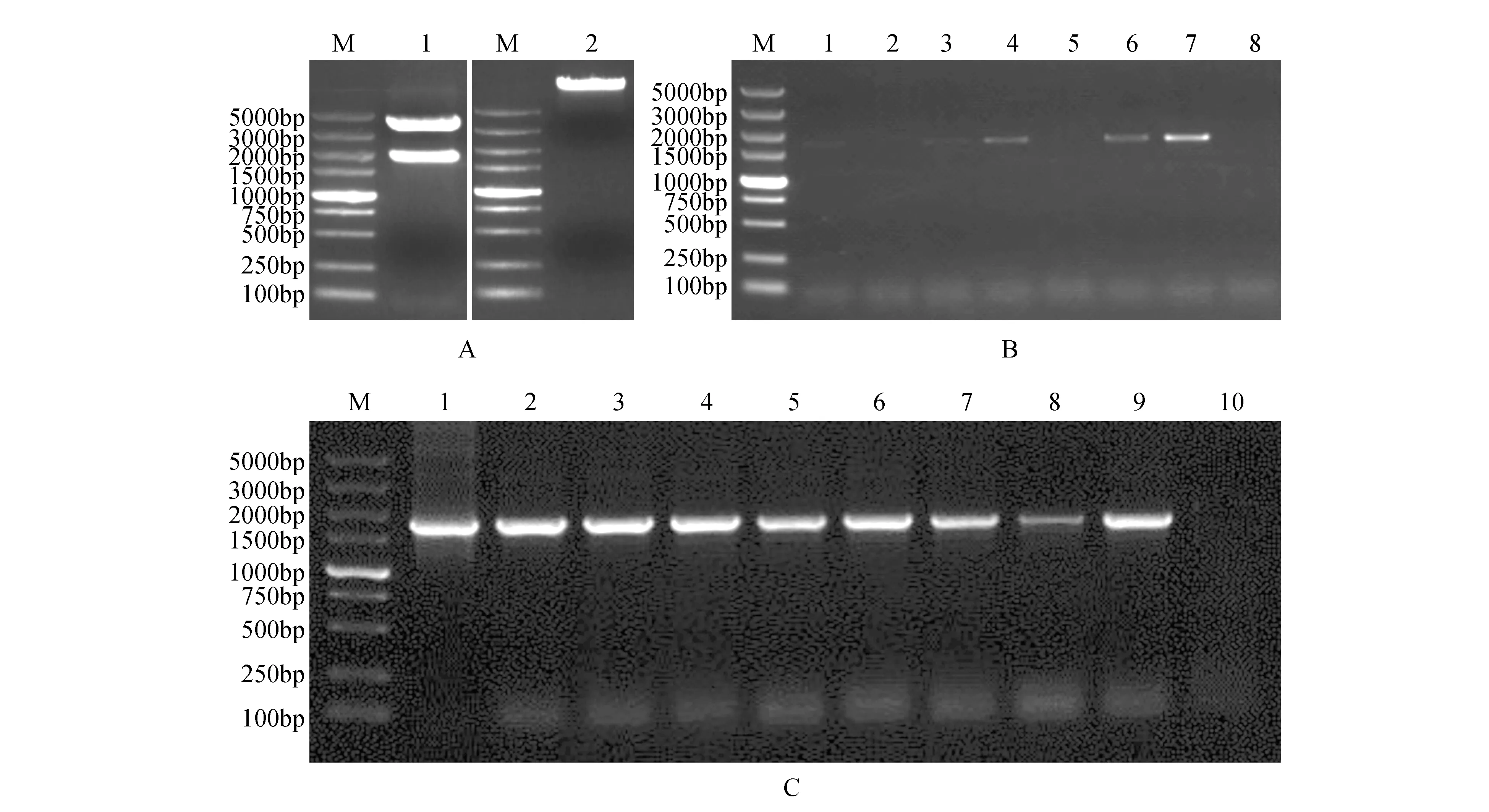
图4 植物表达载体pBI101-BpJMJ18pro::GUS的构建及验证 A.限制性内切酶酶切产物的结果(M. DNA marker DL5000;1.pEASY-Blunt-BpJMJ18pro单酶切条带;2.质粒pBI101-GUS的单酶切条带);B.植物表达载体pBI101-BpJMJ18pro::GUS的菌液PCR检测(M. DNA marker DL5000;1~7.pBI101-BpJMJ18pro::GUS菌液的PCR产物;8.阴性对照);C. GV3101-pBI101-BpJMJ18pro::GUS的菌液PCR检测(M. DNA marker DL5000;1~9.农杆菌转化子的菌液PCR检测;10.阴性对照)Fig.4 The construction and verification of plant expression vector pBI101-BpJMJ18pro::GUS A.Electrophoretogram of restriction enzymes digestion(M. DNA marker DL5000; 1.Digestion of pEASY-Blunt-BpJMJ18pro with HindⅢ; 2.Digestion of pBI101-GUS vector with HindⅢ); B.PCR detection of plant expression vector pBI101-BpJMJ18pro::GUS(M. DNA marker DL5000; 1-7.PCR products of pBI101-BpJMJ18pro::GUS vector; 8.Negative control); C.PCR detection of GV3101-pBI101-BpJMJ18pro::GUS(M. DNA marker DL5000; 1-9.PCR products of transformants in Agrobacterium; 10.Negative control)

图5 BpJMJ18在白桦中的活性分析 A.白桦组培苗;B.顶芽;C.茎;D.第三叶片;E.根Fig.5 BpJMJ18 promoter action element diagram A.Birch tissue culture seed; B.Apical bud; C.Stemt; D.Stem; D.Leaf; E.Root
4 讨论
JMJ类家族蛋白含有JmjC保守结构域,编码JmjC结构域蛋白的基因在许多生物体中代表了一个大的基因家族,如:人类中有30个基因,小鼠中有30个基因,酵母中有12个基因[24]。在植物中,通过生物信息学分析发现,21个拟南芥基因和20个水稻基因编码JmjC结构域蛋白[25~26]。通过上述大量基因研究表明JMJ家族蛋白在不同的生物学过程中可能扮演一个重要的作用。因此,本研究从白桦基因组中鉴定出了一个编码JmjC结构域的基因BpJMJ18,并分析了该基因的组织特异性表达模式,结果表明它在各个组织部位中均有所表达,且在根和幼叶中的表达水平高于其他组织部位,上述结果说明BpJMJ18基因可能参与了植物的生长发育过程。由于启动子中的顺式作用元件对于基因的时空表达及表达量都具有重要的调控作用[27~28],我们克隆了JMJ18基因的启动子序列,通过在线软件分析发现,该序列具有多个TATA-box和CAAT-box核心启动元件,说明其具有典型启动子的特征。
启动子除具有典型的核心启动元件外,还有众多与基因功能相关的调节元件。因此,在相近基因的启动子序列中,应该存在很多一致的顺式作用元件。张俊飞等[1]克隆分析玉米JMJ15基因启动子发现,在启动子序列内含有多个光响应、激素响应和逆境响应等相关元件。汤小凤[29]克隆的杨树PtrJMJ25基因启动子中对光处理有很强的响应,存在光响应元件。本研究也得到了类似的结果,在BpJMJ18基因启动子序列内发现多个光响应元件(G-Box、Box4)和激素(P-box、TGA-element)、逆境响应(ABRE、CGTCA-motif)相关的元件。其中,ABRE和CGTCA-motif分别是与植物生长相关、逆境响应相关的元件,这些结果预示着BpJMJ18基因对于植物的生长发育具有重要的调节作用。此外,研究BpJMJ18启动子序列相关的顺式作用元件为揭示BpJMJ18基因功能具有重要的参考价值。因此本文主要围绕BpJMJ18基因启动子是否具有启动活性功能展开。
目前,能够准确分析启动子活性和组织表达特异性的方法是稳定遗传转化法,例如:Eun-HyeHong[26]等人通过稳定转化法将JMJC家族中AtJMJ3、AtJMJ4、AtJMJ6、AtJMJ7、AtJMJ8、AtJMJ9、AtJMJ10、AtJMJ11等基因的启动子转入拟南芥中,发现该家族基因均在拟南芥的种子、花、叶片、茎的分生组织和根中有所表达。同时观察GUS组织化学染色发现不同基因在相同组织表达部位也有所差异。Hongchun Yang[30]等人将AtJMJ18基因的启动子稳定转化到拟南芥中,GUS染色发现该基因在拟南芥的根韧皮部、茎、子叶、幼叶、成熟叶和花中均有表达,在根和叶片中表达更广泛。但是此方法操作复杂、周期较长且必须获得相应的转基因株系才能进行下一步的相关研究。相对于此方法而言,本文所使用的瞬时转化法能够在短时间内就可以分析哪些启动子序列是调节基因表达所必需的;它简单、方便,并且能够快速鉴定启动子的活性及相应的表达部位。本研究采用瞬时转化法将含有BpJMJ18启动子序列的植物表达载体转化到白桦中,并对瞬时侵染后的转基因植株进行GUS染色分析。结果表明,BpJMJ18基因能够驱动GUS报告基因在主根、侧根、根尖、叶片的维管束和嫩茎中均检测到特异表达并且在成熟茎中有较弱的表达,这和Hongchun Yang[31]等发现的拟南芥根的韧皮部、茎、子叶、幼叶、成熟叶和花中均有所表达的研究结果类似。综上研究结果说明白桦BpJMJ18基因的启动子序列具有典型的高等植物启动子特征,能够驱动GUS基因在瞬时转化的白桦中特异定位表达,表明该基因的启动子具有启动活性,并且存在组织特异性。
综上所述,本研究利用PCR技术克隆白桦BpJMJ18基因启动子,通过顺式作用元件预测分析及瞬时转化启动子驱动报告基因表达对BpJMJ18探其功能提供了新思路,为进一步的研究BpJMJ18基因对白桦生长发育方面的影响奠定理论基础。对于BpJMJ18基因启动子的研究发现它在植物生长发育过程中可能参与了不同的生物学过程,具体的功能还需要进一步的实验验证。
