棘白菌素类抗真菌药物预防侵袭性念珠菌血症有效性与安全性的Meta分析
2020-07-09李莎戴立波姚海涛孔旭东
李莎 戴立波 姚海涛 孔旭东


摘 要目的:系統评价棘白菌素类抗真菌药物预防侵袭性念珠菌血症的有效性及安全性,为临床治疗提供循证参考。方法:计算机检索PubMed、Embase、Medline、Cochrane图书馆、中国期刊全文数据库、中文科技期刊数据库、万方数据,检索时限为建库起至2019年7月,收集棘白菌素类药物(试验组)对比常规抗真菌药物(两性霉素B及三唑类抗真菌药,对照组)预防侵袭性念珠菌血症有效性和安全性的随机对照试验(RCT),对符合纳入标准的临床研究进行资料提取并采用Cochrane系统评价员手册5.0.2进行质量评价后,采用Rev Man 5.2 统计软件对突破性侵袭性真菌感染率、真菌感染死亡率、全因死亡率及因不良反应停药的发生率进行Meta 分析。结果:共纳入7项RCT,合计3 219例患者。Meta 分析结果显示,试验组患者突破性侵袭性真菌感染发生率[OR=0.58,95%CI(0.40,0.85),P=0.004]、真菌感染死亡率[OR=0.68,95%CI(0.51,0.92),P=0.01]和因不良反应停药的发生率[OR=0.52,95%CI(0.40,0.67),P<0.001]均显著低于对照组,差异均有统计学意义;两组患者全因死亡率比较,差异无统计学意义[OR=0.84,95%CI(0.67,1.05),P=0.13]。结论:与两性霉素B及三唑类抗真菌药比较,棘白菌素类药物用于预防侵袭性念珠菌血症可降低突破性侵袭性真菌感染发生率、真菌感染死亡率和因不良反应停药的发生率。
关键词 棘白菌素;预防;侵袭性念珠菌血症;随机对照试验;有效性;安全性;Meta分析
中图分类号 R978.5 文献标志码 A 文章编号 1001-0408(2020)01-0104-06
DOI 10.6039/j.issn.1001-0408.2020.01.18
ABSTRACT OBJECTIVE: To systematically evaluate the efficacy and safety of echinococcins in the prevention of invasive candidiasis, and to provide evidence-based reference for clinical treatment. METHODS: Retrieved from PubMed, Embase, Medline, Cochrane library, CJFD, VIP and Wanfang database, randomized controlled trials (RCTs) about the effectiveness and safety of echinococcins (trial group) versus conventional fungal drugs (amphotericin B and triazole antifungal agents, control group) in the prevention of invasive candidiasis were collected during database establishment to Jul. 2019. After data extraction of clinical studies met inclusion criteria and quality evaluation with Cochrane system evaluator manual 5.0.2, Meta-analysis was performed for breakthrough invasive fungal infection rate, fungal infection mortality rate, all-cause mortality rate and the incidence of drug withdrawal due to adverse reactions by using Rev Man 5.2 statistical software. RESULTS: Totally 7 RCTs were included, involving 3 219 patients. Results of Meta-analyses indicated that the incidence of breakthrough invasive fungal infection [OR=0.58,95%CI (0.40,0.85),P=0.004], fungal infection mortality rate[OR=0.68,95%CI (0.51,0.92),P=0.01] and the incidence of drug withdrawal due to adverse reactions [OR=0.52,95%CI (0.40,0.67),P<0.001] in trial groups were significantly lower than control group, with statistical significance. There was no statistical significance in the all-cause mortality rate [OR=0.84,95%CI (0.67,1.05),P=0.13]. CONCLUSIONS: Compared with amphotericin B and triazole antifungal agents, echinococcins used for the prevention of invasive candidiasis can reduce the incidence of breakthrough invasive fungal infection, fungal infection mortality rate and the incidence of drug withdrawal due to adverse reactions.
KEYWORDS Echinococcins; Prevention; Invasive candi- diasis; Randomized controlled trials; Efficacy; Safety; Meta- analysis
免疫功能受損患者发生侵袭性念珠菌菌血症的风险极高,高危人群包括血液系统恶性肿瘤患者、实体器官移植或造血干细胞移植(Hematopoietic stem cell transplantation,HSCT)受者及使用过化疗药物的患者,尤其是使用过广泛损害胃肠道黏膜药物的患者,感染早期诊断存在困难,延迟启动治疗会造成不良结局,因此,需早期预防真菌感染[1-2]。Cornely OA等[3]调查了13个欧洲癌症中心267例侵袭性念珠菌菌血症患者,结果显示白色念珠菌和非白色念珠菌导致的菌血症比例相等,非白色念珠菌中最常见的是热带念珠菌、光滑念珠菌和近平滑念珠菌;在实体肿瘤患者中,光滑念珠菌分离株的比例最高,而热带念珠菌和克柔念珠菌分别是血液系统恶性肿瘤或接受过造血干细胞移植的患者中分离出的最常见病原菌。根据美国感染病学会(IDSA)2016年发布的《念珠菌病临床实践指南》[4],对于中性粒细胞正常或减少的患者,当不太可能存在氟康唑耐药菌感染(如光滑念珠菌或克柔念珠菌)的非危重患者,初始预防可选用氟康唑,考虑到克柔念珠菌一律对氟康唑耐药,光滑念珠菌分离株很可能会对氟康唑和伏立康唑交叉耐药,可选择棘白菌素类药物,如果患者对其他抗真菌药不耐受、利用度有限或耐药,则可选择两性霉素B脂质制剂。但临床实践中,存在唑类药物预防效果不满意、两性霉素B的最低抑菌浓度值较高,增加剂量的同时也会引发严重的肾损伤等限制[5],发生侵袭性念珠菌菌血症的高危人群最佳的预防用药方案目前仍存在争议,因此,本研究对棘白菌素类药物预防侵袭性念珠菌血症的随机对照试验(Randomized controlled trial,RCT)进行系统评价,以为临床提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外公开发表的RCT,无论是否采取盲法,语种限制为中、英文。
1.1.2 研究对象 纳入研究的患者均为侵袭性念珠菌血症的高风险人群,包括HSCT术后、实体器官移植术后及粒缺伴发热的患者[3,6-7],且年龄≥16岁。患者性别、国籍不限,入组前均未确诊侵袭性念珠菌血症。
1.1.3 干预措施 对照组采用常规抗真菌药物治疗,包括两性霉素B(脂质体、脂质复合物)及三唑类抗真菌药物(氟康唑、伏立康唑、泊沙康唑);试验组接受棘白菌素类抗真菌药物(米卡芬净、卡泊芬净、阿尼芬净)治疗。
1.1.4 结局指标 结局指标分为主要指标及次要指标,以有效性指标作为主要指标,包括:①突破性侵袭性真菌感染率(Breakthrough invasive fungal infection, bIFI),突破性侵袭性真菌感染定义为预防用药期间发生了确定(Proven)、可能(Probable) 和可疑(Possible) 的系统性真菌感染;②真菌感染死亡率;③全因死亡率;以安全性指标作为次要指标:④因不良反应停药的发生率。
1.1.5 排除标准 ①非预防性应用抗真菌感染药物;②患者年龄<16岁;③重复发表及数据不全的文献。
1.2 检索策略
计算机检索PubMed、Embase、Medline、Cochrane图书馆、中国期刊全文数据库、中文科技期刊数据库、万方数据,检索时限均为建库起至2019 年7 月,并追溯纳入研究中的参考文献。已完成临床试验但未发表的文章结果通过 Clinical Trials. gov 进行检索。中文检索词包括:“棘白菌素”“米卡芬净”“卡泊芬净”“阿尼芬净”“真菌感染”“随机对照试验”;英文检索词包括:“Echinocandin”“Micafungin”“Caspofungin”“Anidulafungin”“Fungin infection”“Ramdon controlled trial”。运用通配符、逻辑符、范围算符等制订检索式。
1.3 资料提取和质量评价
1.3.1 资料提取 制订文献信息登记表采集信息。两名评价者经按统一规范的评价方法对纳入文献的全文进行独立评价,逐篇阅读初步纳入文献,填写单个文献信息采集表。提取的文献信息包括原文题目、发表年份、作者、研究对象、研究方法、干预措施、结局测量与评价、是否采用盲法、有无失访等。
1.3.2 质量评价 采用Cochrane 系统评价员手册5.0.2版推荐的工具评价纳入RCT 的偏倚风险,包括:① 随机方法;②分配隐藏;③盲法:对研究对象、治疗方案实施者、研究结果测量者采用盲法;④退出或失访:包括干预前基线水平测量值和干预后效应参数值、失访/退出情况以及是否对失访原因加以说明;⑤意向治疗分析(ITT):对于安全性问题、阴性结果是否进行报道;⑥其他偏倚来源:包括试验早停、基线不平衡等。针对每篇纳入文献,对上述6 项作出“是”(低度偏倚)、“否”(高度偏倚)和“不清楚”(缺乏相关信息或偏倚情况不确定)的判断。由两位评价者独立进行方法学质量评价,如有分歧,由第三方协助解决。
1.4 统计学方法
采用Rev Man 5.2统计软件进行统计分析,计数资料采用比值比(Odds ratio,OR)及其95%置信区间(CI)表示,并对纳入的研究结果进行异质性检验。当各RCT间无统计学异质性(P≥0.1,I 2<50%)时,采用固定效应模型合并效应量;反之,则分析异质性来源,对可能产生异质性的因素进行亚组分析;若研究间存在统计学异质性而无临床异质性或差异无统计学意义时,可采用随机效应模型合并效应量;如果两组间异质性过大或无法找寻数据来源时,采用描述性分析。本研究采用失安全系数法进行发表偏倚分析。本研究采用失安全系数(Nfs)法对各项指标进行发表偏倚分析。Nfs分析是指当Meta分析的结果有统计学意义时,为排除发表存在的偏倚,计算最少需要多少个未发表的研究报告(特别是阴性结果报告)才能逆转该Meta分析的结论。Nfs越大说明发表偏倚越小,结论被推翻的可能性越小,Meta分析结果越稳定。P=0.05或者P=0.01时,Nfs可用Nfs 0.05及Nfs 0.01表示。
2 結果
2.1 文献筛选结果
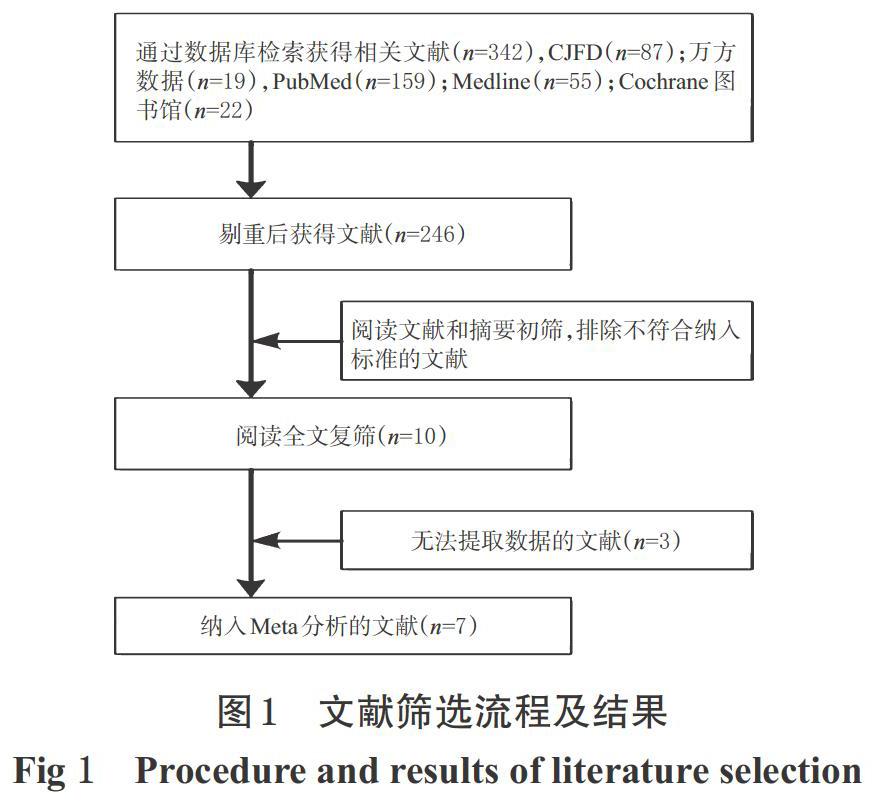
初步检索相关文献342篇,按照纳入与排除标准逐层筛选后,最终纳入7篇(项)RCT[8-14] ,合计3 219例患者。文献筛选流程及结果见图1。
2.2 纳入研究基本信息与质量评价结果
纳入的7项RCT均对患者的基线情况进行了报道,均在文中提及了“随机”,4项RCT[8-9,12-13]提及具体的随机方案,1项RCT[11]提及是否实行分配隐藏,4 项RCT[8-9,11,14]实施盲法,7项RCT[8-14]均对缺失结果数据或缺失原因进行描述。纳入研究的基本信息与质量评价结果详见表1、表2。
2.3 Meta分析结果
2.3.1 bIFI发生率 7项研究(3 219例患者)[8-14]报道了bIFI发生率,各研究结果间无统计学异质性(P=0.72, I 2=0),采用固定效应模型计算合并效应量,Meta分析结果显示,试验组患者bIFI发生率显著低于对照组,差异有统计学意义[OR=0.58, 95%CI(0.40,0.85),P=0.004]。将7项研究分为米卡芬净组及其他棘白菌素类药物组进行亚组分析。在米卡芬净组,5项研究(1 924例患者)[9-13]报道了bIFI发生率,各研究结果间无统计学异质性(P=0.79,I 2=0),采用固定效应模型计算合并效应量,Meta分析结果显示,试验组患者bIFI发生率显著低于对照组,差异有统计学意义[OR=0.47,95%CI(0.28,0.80),P=0.005];在其他棘白菌素类药物组,2项研究(1 295例患者)[8,14]报道了bIFI发生率,各研究结果间无统计学异质性(P=0.42,I 2=0),采用固定效应模型计算合并效应量,Meta分析结果显示,两组患者bIFI发生率比较,差异无统计学意义[OR=0.73, 95%CI(0.43,1.24),P=0.24]。bIFI发生率的Meta分析森林图见图2。
2.3.2 真菌感染死亡率 5项研究(3 052例患者)[8-11,14]报道了真菌感染死亡率,各研究结果间无统计学异质性(P=1.00,I 2=0) ,采用固定效应模型计算合并效应量, Meta分析结果显示,试验组患者真菌感染死亡率显著低于对照组,差异有统计学意义[OR=0.68,95%CI(0.51,0.92),P=0.01]。将5项研究分为米卡芬净组及其他棘白菌素类药物组进行亚组分析。在米卡芬净组,3项研究(1 757例患者)[9-11]报道了真菌感染死亡率,采用固定效应模型计算合并效应量, 各研究结果间无统计学异质性(P=0.97,I 2=0),Meta分析结果显示,两组患者真菌感染死亡率比较,差异无统计学意义[OR=0.70,95%CI(0.45,1.10),P=0.13];在其他棘白菌素类药物组,2项研究(1 295例患者)[8,14]报道了真菌感染死亡率,各研究结果间无统计学异质性(P=0.88,I 2=0),采用固定效应模型计算合并效应量, Meta分析结果显示,两组患者真菌感染死亡率比较,差异无统计学意义[OR=0.67,95%CI(0.44,1.00),P=0.05],但P值已接近有统计学意义的点。真菌感染死亡率的Meta分析森林图见图3。
2.3.3 全因死亡率 7项研究(3 219例患者)[8-14]报道了全因死亡率,各研究间无统计学异质性(P=0.90,I 2=0),采用固定效应模型计算合并效应量, Meta分析结果显示,两组患者全因死亡率比较,差异无统计学意义[OR=0.84,95%CI(0.67,1.05),P=0.13]。将7项研究分为米卡芬净组及其他棘白菌素类药物组进行亚组分析。在米卡芬净组,5项研究(1 924例患者)[9-13]报道了全因死亡率,各研究结果间无统计学异质性(P=0.79, I 2=0),Meta分析结果显示,两组患者全因死亡率比较,差异无统计学意义[OR=0.89,95%CI(0.66,1.20),P=0.44];在其他棘白菌素类药物组,2项研究(1 295例患者)[8,14]报道了全因死亡率,各研究结果间无统计学异质性(P=0.65,I 2=0),Meta分析结果显示,两组患者全因死亡率比较,差异无统计学意义[OR=0.79,95%CI (0.57,1.09),P=0.16]。全因死亡率的Meta分析森林图见图4。
2.3.4 因不良反应停药发生率 7项研究(3 219例患者)[8-14]报道了因不良反应停药发生率,各研究结果间无统计学异质性(P=0.17,I 2=34%),采用固定效应模型合并效应量,Meta分析结果显示,试验组患者因不良反应停药发生率显著低于对照组,差异有统计学意义[OR=0.52,95%CI([0.40,0.67),P<0.001]。将7项研究分为米卡芬净组及其他棘白菌素类药物组进行亚组分析。在米卡芬净组,5项研究(1 924例患者)[9-13]报道了因不良反应停药发生率,各研究结果间无统计学异质性(P=0.19,I 2=34%),采用固定效应模型合并效应量,Meta分析结果显示,试验组患者因不良反应停药发生率显著低于对照组,差异有统计学意义[OR=0.44,95%CI(0.31,0.62),P=0.19];在其他棘白菌素类药物组,2项研究(1 295例患者)[8,14]报道了因不良反应停药发生率,各研究结果间无统计学异质性(P=0.30,I 2=5%),采用固定效应模型合并效应量,Meta分析结果显示,试验组患者因不良反应停药发生率显著低于对照组,差异有统计学意义[OR=0.66,95%CI(0.44,1.00),P=0.05]。因不良反应停药发生率的Meta分析森林图见图5。
2.4 发表偏倚分析
本研究中bIFI发生率的Nfs 0.05=138.46,Nfs 0.01=61.25,真菌感染死亡率的Nfs 0.05=99.28,Nfs 0.01=45.36,因不良反应停药发生率的Nfs 0.05=432.05,Nfs 0.01=199.51。提示本研究所得的bIFI发生率、真菌感染死亡率和因不良反应停药发生率的结论发表偏倚较小。
2.5 敏感性分析
對于bIFI发生率、真菌感染死亡率、全因死亡率和因不良反应停药发生率的结局指标,将排除某一项研究再次进行Meta分析的结果与现有结果比较,结果均未发生翻转,说明本次Meta分析结果较为可靠。
3 讨论
在移植物植入前期,受者发生侵袭性念珠菌病的风险最高,念珠菌菌血症是侵袭性念珠菌病最常见的临床表现。在常规应用抗真菌预防治疗之前,侵袭性念珠菌感染的发生率为16%~18%。虽然约一半的侵袭性念珠菌感染由白色念珠菌导致,但与其他患者相比,移植物受者发生非白色念珠菌属如光滑念珠菌、热带念珠菌感染的风险也增加[15]。一项前瞻性队列研究显示,棘白菌素类药物作为一种预防侵袭性念珠菌感染的经验性抗真菌药物,米卡芬净、卡泊芬净和阿尼芬净之间的有效性和安全性没有显著性差异[16],棘白菌素类抗真菌药物主要优势在于对念珠菌属的杀菌活性,包括耐氟康唑的光滑念珠菌和克柔念珠菌,并且其引起肾毒性或严重药物相互作用的可能性相对较低。本次纳入的7项RCT结果表明,棘白菌素组bIFI发生率、真菌感染死亡率及因不良反应停药的发生率均较其他标准治疗组显著降低,为侵袭性念珠菌血症高风险患者预防用药提供了支持。
两性霉素B脂质体及三唑类抗真菌药物(氟康唑、伏立康唑)是目前指南推荐的用于肝移植及HSCT受者抗真菌预防的药物,但念珠菌种类如光滑念珠菌和克柔念珠菌对这些制剂的敏感性较低,甚至对氟康唑天然耐药[17],对于移植术后、脊髓发育不良以及长期中性粒细胞减少的患者,氟康唑不足以预防侵袭性霉菌感染(如曲霉菌病)[18]。移植患者常规使用免疫抑制剂如环孢霉素、他克莫司和西罗莫司,而氟康唑、伏立康唑与以上药物的相互作用使给药复杂化,在接受连续肾脏替代疗法的患者中,氟康唑会被显著清除,需要调整给药剂量[19]。虽然两性霉素B脂质体与两性霉素B去氧胆酸盐相比降低了肾毒性风险,但在肾功能不全的受者中,仍存在因肾功能而减少给药剂量的问题,导致其使用受到限制。因此,在肝移植或HSCT患者中,尤其在侵袭性念珠菌病的患病率很高(>5%)的重症监护病房内,高风险患者可以接受棘白菌素类药物进行预防[4]。
Ziakas PD等[20]报道,造血干细胞移植受体中,全身预防性抗真菌治疗可以降低中性粒细胞减少患者bIFI的发生风险,但总体死亡率没有改变。本研究结果显示,棘白菌素组与其他预防真菌感染药物组对比,全因死亡率无显著性差异。移植患者死亡的主要原因为感染性休克合并多器官衰竭和/或基础疾病恶化[19],预防性使用抗真菌药物可在一定程度上降低bIFI及真菌感染的发生率,但对最终导致患者死亡的原因无显著改善[21]。
棘白菌素类药物作用于真菌细胞壁的环脂肽,抑制 β-(1,3)-D-葡聚糖的合成,而人类及哺乳动物的细胞无细胞壁结构,因此这类药物对宿主的不良反应明显降低,但仍不能忽视其对肝功能的损害。本研究纳入的7项RCT的分析结果显示棘白菌素组因不良反应而停药的发生率低于对照组,但文中均提及棘白菌素类药物的不良反应,包括胃肠道反应、过敏反应、心脏毒性及实验室检查异常,包括:丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、嗜酸性粒细胞、血小板水平升高,胆红素血症、黄疸等,其中肝损伤为棘白菌素类药物的主要不良反应,临床应用时应密切监测。
本研究的局限性包括:(1)现有关于棘白菌素类药物预防侵袭性念珠菌血症的RCT较少,能够纳入评价分析的数量较少;(2)各RCT评价指标间存在差异;(3)本文未纳入符合标准的中文研究,可能导致研究结果中种族或人群的差异;(4)因阴性结果不易发表,可能导致结论的可靠性降低。同时,建议再次开展棘白菌素类药物预防侵袭性念珠菌血症临床课题研究时,注意以下几个方面:(1)课题设计更加严谨,尽可能描述随机方法、实施盲法、分配隐藏的具体方案;(2)报道时应详细描述各项结局指标,并报道观察病例有无失访等,以提高研究质量,为临床提供更可靠、有价值的参考。
综上所述,与两性霉素B及三唑类抗真菌药比较,棘白菌素类药物用于预防侵袭性念珠菌血症可降低突破性侵袭性真菌感染发生率、真菌感染死亡率和因不良反应停药的发生率。受纳入研究质量和方法学限制,该结论有待大样本、高质量研究证实。
参考文献
[ 1 ] GARBATI MA,ALASMARI FA,Al-TANNIR MA,et al. The role of combination antifungal therapy in the treatment of invasive aspergillosis: a systematic review[J]. Int J Infect Dis,2012,16(2):e76-81.
[ 2 ] KUBIAK DW, BRYAR JM, MCDONNELL AM, et al. Evaluation of caspofungin or micafungin as empiricantifungal therapy in adult patients with persistent febrile neutropenia: a retrospective, observational, sequential cohort analysis[J]. Clin Ther,2010,32(4):637-648.
[ 3 ] CORNELY OA, GACHOT B, AKAN H, et al. Epidemiology and outcome of fungemia in a cancer cohort of the infectious diseases group (IDG) of the european organization for research and treatment of cancer[J]. Clin Infect Dis,2015,61(3):324-331.
[ 4 ] PAPPAS PG, KAUFFMAN CA, ANDES DR, et al. Clinical practice guideline for the management of candidiasis: 2016 update by the infectious diseases society of America[J]. Clin Infect Dis,2016,62(4):e1-50.
[ 5 ] 魏曉晨,朱立勤,王春革.抗真菌药物预防肝移植术后侵袭性真菌感染的疗效与安全性的Meta分析[J].中国药房,2014,25(24):2238-2241.
[ 6 ] HUSAIN S,TOLLEMAR J,DOMINGUEZ EA,et al. Ch- anges in the spectrum and risk factors for invasive candidiasis in liver transplant recipients: prospective, multicenter, case-controlled study[J]. Transplantation,2003,75(12):2023-2029.
[7] TOMBLYN M, CHILLER T, EINSELE H, et al. Guidelines for preventing infectious complications among hematopoietic cell transplantation recipients: a global perspective[J]. Biol Blood Marrow Transplant,2009,15(10):1143-1238.
[ 8 ] WINSTON DJ, LIMAYE AP, PELLETIER S, et al. Randomized, double-blind trial of anidulafungin versus fluconazole for prophylaxis of invasive fungal infections in high-risk liver transplant recipients[J]. Am J Transplant,2014,14(12):2758-2764.
[ 9 ] KUSE ER,CHETCHOTISDKD P,DA CUNHA CA,et al. Micafungin versus liposomal amphotericin B for candidaemia and invasive candidosis: a phase Ⅲ randomized double-blind trial[J]. Lancet,2007,369(9572):1519-1527.
[10] SALIBA F, PASCHER A, COINTAULT O,et al. Randomized trial of micafungin for the prevention of invasive fungal infection in high-risk liver transplant cecipients[J]. Clin Infect Dis,2015,60(7):997-1006.
[11] VAN BURIK JA, RATANATHARATHOM V, STEPAN DE,et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation[J]. Clin Infect Dis,2004,39(10):1407-1416.
[12] HANSON KE, PFEIFFER CD, LEASE ED, et al. β-D- glucan surveillance with preemptive anidulafungin for invasive candidiasis in intensive care unit patients: a randomized pilot study[J]. PLoS one,2012,7(8):e42282.
[13] OYAKE T, KOWATA S, MURAI K, et al. Comparison of micafungin and voriconazole as empirical antifungal therapies in febrile neutropenic patients with hematological disorders: a randomized controlled trial[J]. Eur J Haematol,2016,96(6):602-609.
[14] WALSH TJ, TEPPLER H, DONOWITZ GR, et al. Caspofungin versus liposomal amphotericin B for empirical antifungal therapy in patients with persistent fever and neutropenia[J]. N Engl J Med, 2004,351(14):1391- 1402.
[15] TAPLITZ RA, KENNEDY EB, BOW EJ, et al. Antimicrobial prophylaxis for adult patients with cancer-related immunosuppression:ASCO and IDSA clinical practice guideline update[J]. J Clin Oncol, 2018, 36(30):3043- 3054.
[16] KUBIAK DW, BRYAR JM, MCDONNELL AM, et al. Evaluation of caspofungin or micafungin as empiric antifungal therapy in adult patients with persistent febrile neutropenia: a retrospective, observational, sequential cohort analysis[J]. Clinical Therapeutics,2010,4(32):637- 648.
[17] WINGARD JR, CARTER SL, WALSH TJ, et al. Randomized, double-blind trial of fluconazole versus voriconazole for prevention of invasive fungal infection after allogeneic hematopoietic cell transplantation[J]. Blood,2010,116(24):5111-5118.
[18] PAPPAS PG, ALEXANDER BD, ANDES DR, et al. Invasive fungal infections among organ transplant recipients: results of the transplant-associated infection surveillance network[J]. Clin Infect Dis,2010,50(8):1101- 1011.
[19] WANG J, ZHAN P, ZHOU R, et al. Prophylaxis with itraconazole is more effective than prophylaxis with fluconazole in neutropenic patients with hematological malignancies: a meta-analysis of randomized-controlled trials[J]. Med Oncol,2010,27(4):1082-1088.
[20] ZIAKAS PD, KOURBTI IS, VOULGARELIS M, et al. Effectiveness of systemic antifungal prophylaxis in patients with neutropenia after chemotherapy: a meta-analysis of randomized controlled trials[J]. Clin Ther,2010,32(14):2316-2336.
[21] VEKEMAN F, WEISS L, ARAM J, et al. Retrospective cohort study comparing the risk of severe hepatotoxicity in hospitalized patients treated with echinocandins forinvasive candidiasis in the presence of confounding by indication[J]. BMC Infect Dis,2018,18(1):438.
(收稿日期:2019-08-16 修回日期:2019-10-08)
(編辑:刘明伟)
