黄瓜实生苗与嫁接苗生长发育及光合荧光特性对自毒胁迫的响应差异
2020-07-08马宁陈碧杨华刘威黄兴昌肖雪梅颉建明
马宁 陈碧 杨华 刘威 黄兴昌 肖雪梅 颉建明


摘 要: 采用水培方式,以黄瓜嫁接苗与实生苗为试材,外源肉桂酸(CA)模拟自毒胁迫,分别从幼苗的生长发育、根系形态和光合荧光特性等方面,对比研究以黑籽南瓜为砧木的嫁接苗与黄瓜实生苗对自毒胁迫响应差异的生理机制。结果表明,第6天时,CA胁迫下黄瓜实生苗(NG-T)的株高和叶面积比对照(NG-CK)分别降低了32.96%和33.41%,而嫁接苗的株高、茎粗、叶面积受抑制程度轻,且长势明显优于实生苗;0.5 mmol·L-1 CA对黄瓜嫁接苗的根长和根尖数的抑制率为6.95%和7.30%,仅为黄瓜实生苗的18.66%和16.37%;CA胁迫下,嫁接能够稳定维持黄瓜幼苗体内的叶绿素含量;嫁接苗的蒸腾速率(Tr)、净光合速率(Pn)、气孔导度(Gs)、Fv/Fm、Fv/Fo和非光化学淬灭(NPQ)均高于实生苗,分别高出10.87%、156.86%、78.33%、5.58%、17.59%和38.07%。说明嫁接可促进黄瓜植株的生长,减轻自毒物质对光合系统的损伤,从而提高对自毒胁迫的耐受性。
关键词: 黄瓜;肉桂酸;嫁接;植株形态;光合荧光特性
中图分类号:S642.2 文献标志码:A 文章编号:1673-2871(2020)06-017-07
Abstract: In the experiment, hydroponics was used to study the difference physiological mechanism of the non-grafted and rootstock grafted cucumber seedling in response to autotoxic stress, using exogenous cinnamic acid(CA)to simulate autotoxic stress. The growth and development of seedlings, root morphology and photosynthetic fluorescence characteristics were compared between non-grafted and rootstock grafted cucumber. The results showed that on day 6(d), plant height and leaf area of non-grafted cucumber seedlings(NG-T)under cinnamic acid stress were 32.96% and 33.41% lower than those of control(NG-CK), while plant height, stem diameter and leaf areas of rootstock grafted seedlings were slightly inhibited, and growth vigor was significantly better than that of non-grafted seedlings. The inhibition rates of root length and root tip number of grafted seedlings under 0.5 mmol L-1 CA treatment were 6.95% and 7.30%, respectively, only 18.66% and 16.37% of the non-grafted cucumber seedlings, which indicated the resistance of grafted seedlings to CA stress was stronger. Under CA stress, grafting could keep the chlorophyll content of cucumber seedlings stable. The transpiration rate(Tr), net photosynthetic rate(Pn), stomatal conductance(Gs), Fv/Fm, Fv/Fo and non-photochemical quenching(NPQ)of grafted seedlings were increased than those of non-grafted seedlings by 10.87%, 156.86%, 78.33%, 5.58%, 17.59% and 38.07%, respectively. The results showed that grafting could promote the growth of cucumber plants, inhibit the damage of photosynthetic system caused by autotoxic substances, and improve the tolerance to autotoxic stress.
Key words: Cucumber; Cinnamic acid; Grafting; Plant morphology; Photosynthetic fluorescence characteristics
黃瓜(Cucumis sativus L.)是葫芦科一年生蔓性植物,生长周期短,市场需求量大,其设施栽培面积也在日益增大。但栽培中连作障碍普遍发生,致使黄瓜产量锐减和品质下降,同时抗病虫害的能力减弱,严重制约了黄瓜设施栽培的可持续发展。前人研究表明,导致连作障碍的因素主要有3个方面,一是根系分泌自毒物质,二是土壤营养失衡,三是土传致病菌的积累,其中植物自身释放的有毒物质可影响根系对矿质元素的吸收,增加致病菌的种类和数量[1-2],是导致连作障碍的重要因素。
许多蔬菜作物根系可分泌出酚酸类自毒物质,影响正常的生理代谢。黄瓜的自毒作用是由苯基羧酸类化合物引起的,包括苯甲酸和肉桂酸及其衍生物[3],这些自毒物质通过影响黄瓜幼苗的离子吸收和光合作用,抑制黄瓜生长,且具有剂量效应[4];同时会造成黄瓜根系氧化胁迫,引起膜质过氧化和质膜H+-ATPase活性的下降[5];促进枯萎病的发生。Ding等[6]报道指出,黄瓜根系分泌的苯丙烯酸对自身存在毒害作用,当质量分数超过0.05 mg·g-1时,可显著抑制黄瓜幼苗生长、根系活力与微生物活动,且浓度越高,抑制作用越强。同样地,大量外源添加自毒物质试验证实,自毒物质通过抑制作物根系生长、叶绿素合成及离子吸收能力,从而影响作物的生长发育,在黄瓜、豌豆、茄子、番茄等[7-10]作物中均有报道。
瓜类嫁接栽培在农业生产中已表现出抗病、抗逆、高产、优质的综合优良性状,得到了生产者的普遍认可。有研究证实,作为黄瓜嫁接砧木的黑籽南瓜不但不易产生自毒作用,其生长有时反而被其它瓜类的根系分泌物所促进[11]。陈绍莉等[12]通过添加外源自毒物质肉桂酸和香草醛,探讨了茄子实生苗和嫁接苗对自毒胁迫的生理响应差异,发现嫁接茄子的根系活力、抗氧化酶活性和渗透调节能力均高于非嫁接茄子。笔者基于嫁接技术在减轻设施黄瓜连作障碍中的应用,采用外源肉桂酸模拟自毒胁迫,以黄瓜嫁接苗和实生苗为试材,分别从生长发育、根系形态和光合作用等方面阐述嫁接提高黄瓜抗自毒胁迫的生理机制,为生产中应用嫁接技术克服黄瓜连作障碍提供科学依据。
1 材料与方法
1.1 材料
试验于2017年10月至2018年4月在甘肃农业大学园艺学院蔬菜栽培生理实验室进行。接穗:‘津研四号黄瓜,天津市宏丰蔬菜研究有限公司。砧木:黑籽南瓜,云南农作资源开发研究所。
1.2 试验设计与方法
选取健壮饱满且形态一致的黄瓜种子温汤浸种后,置于28 ℃人工气候箱黑暗条件下催芽。当黄瓜子叶大部分露出或完全褪掉种皮时,移入预先准备好的1 L圆台形水培盒(底径12.5 cm,顶径15.5 cm,高10 cm)内,采用日本山崎黄瓜专用营养液水培,在人工气候箱中进行。培养条件:温度25 ℃/19 ℃(昼/夜),白天光照强度为256 μmol·m-2·s-1,光周期14 h/10 h(昼/夜),湿度75%,营养液的电导率和pH分别为1.20 mS·cm-1、6.5。试验期间每2 d更换1次营养液。当砧木(黑籽南瓜)第1片真叶露心,接穗(黄瓜)子叶完全展开时采用插接法进行嫁接。待幼苗长至2叶1心时,选取长势一致的黄瓜嫁接苗(RG)与实生苗(NG),营养液中添加0.5 mmol·L-1 CA,以不加CA为对照。共如下4个处理:RG-CK(嫁接苗+营养液)、RG-T(嫁接苗+含0.5 mmol·L-1CA的营养液)、NG-CK(实生苗+营养液)、NR-T(实生苗+含0.5 mmol·L-1CA的营养液)。试验采用随机区组设计,每处理3个重复,每重复9株(每个水培盒种植3株)。CA采用无水乙醇助溶,浓度控制在0.1%(V/V),对照营养液中加入同等量的无水乙醇。分别于处理的0、2、4和6 d,测定不同处理黄瓜实生苗和嫁接苗的生长发育和光合特性,于处理的第6天,取样测定幼苗生物量、根系形态和叶绿素荧光等参数。
1.3 测定指标与方法
1.3.1 植株形态的测定 用直尺测量根茎连接处到生长点的高度作为株高;用游标卡尺测定子叶下1 cm处的茎粗;测量相同叶位功能叶的长与宽,根据公式计算总叶面积,叶面积=0.743×长×宽[13]。
1.3.2 根系形态的测定 用蒸馏水将待测根洗净,放入透明塑料盘中,加蒸馏水至根系完全浸没,并将其充分铺展,使用根系扫描仪(EPSON Scan,Canada)进行扫描,WinRHIZO Pro LA2400软件分析根系總长度、表面积、根体积和根尖数。
1.3.3 植株生物量的测定 用蒸馏水把黄瓜幼苗洗净,随后用滤纸将植株表面的水分擦干,分为地上部与地下部,分别测定鲜质量,然后置于烘箱105 ℃杀青30 min,再调至80 ℃烘干至恒重。
1.3.4 叶绿素含量的测定 于处理6 d后,各处理随机采取黄瓜幼苗从上向下数第2片功能叶。将叶片剪碎后混匀,取0.1 g放入25 mL具塞试管中,注入10 mL 80%的丙酮溶液,黑暗下浸泡提取,每4 h震荡1次,待叶片呈白色时,在440 nm、663 nm和645 nm处用UV-1800型分光光度计进行比色。使用公式Ca=12.71×A663-2.59×A645;Cb=22.88×A645-4.67×A663;Ca+b=20.29×OD645+8.02×OD663算得叶绿素a、叶绿素b含量和叶绿素a+b含量。
1.3.5 光合参数的测定 分别在处理的第0、2、4和6 d采用CIRAS-2型便携式光合仪(PP-system, UK),测定黄瓜幼苗从上向下数第2片功能叶的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)及蒸腾速率(Tr)。设置测定条件,内置LED光源的光量子通量密度(PFD):1 000 μmol·m-2·s-1,环境CO2浓度:380 μmol·mol-1,叶片温度:25 ℃,相对湿度:75%。
1.3.6 叶绿素荧光参数的测定 于处理第6天使用调制叶绿素荧光成像系统(MAXI Imaging-PAM,Walz,Effeltrich,Germany)测定黄瓜幼苗从上向下数第2片功能叶的叶绿素荧光参数。测定前,先将黄瓜幼苗进行30 min暗适应,使其反应中心处于完全开放状态,剪下完全展开的第2片功能叶,平铺在调制叶绿素荧光成像系统的测定平台上,在25 ℃下开始测定叶片的Fv/Fm、Fv/Fo、ΦPSII、NPQ和qP等叶绿素荧光参数。
1.3.7 快速光响应曲线的测定 在MAXI Imaging-PAM的Light Curve窗口设置光合有效辐射强度梯度依次为0、21、56、111、186、281、396、531、701、926、1 251 μmol·m-2·s-1,相邻光照强度之间间隔20 s,由此可以得到PSII相对电子传递速率(rETR)随光强PAR增加的变化趋势。
1.4 数据处理
使用Excel 2010软件进行数据整理及制图。采用IBM SPSS Statistics 22.0统计分析软件对数据进行独立样本t检验,显著性检验水平为P<0.05。
2 结果与分析
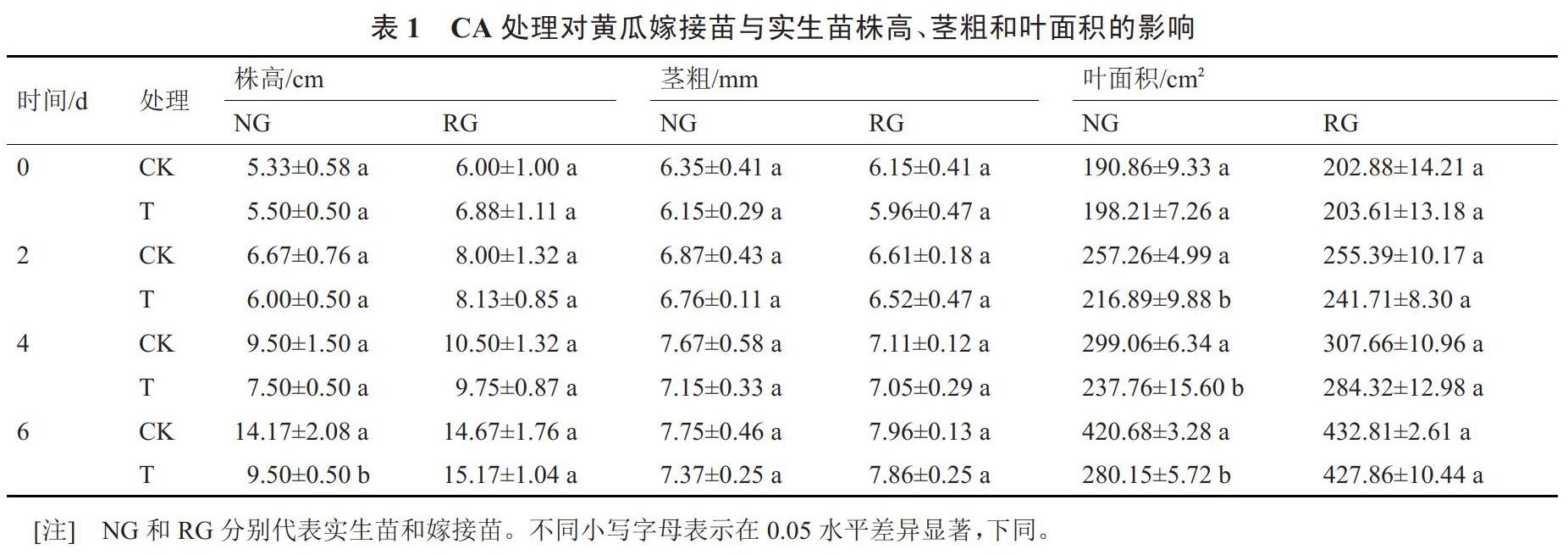
2.1 CA处理对黄瓜嫁接苗与实生苗生长发育的影响
由表1可以看出,0.5 mmol·L-1CA处理对NG幼苗生长有很强的抑制作用,在第6天时,NG-T的株高表现为被显著抑制的现象,NG-T的株高较NG-CK降低32.96%。但NG茎粗并没有被CA胁迫显著抑制。同上,第2天时,NG-T幼苗的叶面积比NG-CK显著减小15.69%。随着处理时间的延长,抑制作用越明显,在第6天时,NG-T的叶面积比NG-CK减小33.41%。而对于嫁接苗来说,0.5 mmol·L-1CA处理对幼苗株高、茎粗和叶面积均无显著影响,且嫁接苗的各项形态指标均优于实生苗。说明嫁接对CA胁迫有很好的缓解作用。
2.2 CA处理对黄瓜嫁接苗与实生苗根系形态的影响
由表2可知,0.5 mmol·L-1CA处理显著减少了黄瓜实生苗的根长、根尖数和根表面积,分别比对照降低37.24%、45.06%和6.12%;而根體积却显著增加40.19%。说明CA胁迫会对黄瓜根系产生很强的抑制作用。反观RG-CK与RG-T,0.5 mmol·L-1CA处理会使嫁接苗的各项根系指标下降,但差异不显著。说明嫁接苗对CA胁迫有很好的耐受性。嫁接砧木黑籽南瓜的黄瓜比实生黄瓜根系更发达,其根长、根表面积和根尖数分别是实生黄瓜的2.08倍、1.53倍和4.47倍,因此具有更强大的养分吸收能力以及对逆境的抵抗能力。
2.3 CA处理对黄瓜嫁接苗与实生苗生物量的影响
如图1-A所示,0.5 mmol·L-1CA处理显著降低了黄瓜实生苗的鲜物质积累量,NG-T的地上部和地下部的鲜物质积累量比NG-CK分别降低22.67%和28.93%,图1-C显示,0.5 mmol·L-1CA处理对其干物质量积累的影响没有达到显著水平。同时,由图1-B、1-D可知,CA胁迫对RG地上和地下部的干、鲜物质积累量的影响都没有表现出显著差异。说明CA处理可能会引起水分胁迫进而抑制植株生长,而嫁接可以缓解甚至解除CA处理引起的水分胁迫,从而保证植株的正常生长发育。
2.4 CA处理对黄瓜嫁接苗与实生苗叶绿素含量的影响
由图2-A可知,0.5 mmol·L-1CA处理可显著降低黄瓜实生苗叶片叶绿素含量,NG-T的叶绿素a、叶绿素b和叶绿素a+b较NG-CK分别降低35.86%、47.68%和39.78%。图2-B中,CA胁迫对RG叶绿素含量的影响无显著差异,表明CA胁迫通过影响实生苗叶片光合色素的积累,进而影响植株的光合强弱,而嫁接可有效缓解CA胁迫对植株光合色素合成的抑制。
2.5 CA处理对黄瓜嫁接苗与实生苗光合特性的影响
由表3可以看出,0.5 mmol·L-1CA处理可显著降低黄瓜实生苗的Tr、Gs和Pn,较对照分别降低了50.65%、49.55%和84.35%。在CA胁迫下,RG-T的Tr和Gs均降低,较RG-CK分别降低了7.96%和40.80%,而Pn却没有降低。与Tr、Gs和Pn不同的是,CA处理后,NG-T的Ci与对照相比显著升高了34.77%;而RG-T与RG-CK的Ci无显著差异,说明嫁接可有效缓解CA对黄瓜幼苗光合作用的胁迫。
2.6 CA处理对黄瓜嫁接苗与实生苗荧光参数的影响
光反应中心PSII的原初光能转化效率以最大光化学效率(Fv/Fm)表示,PSII实际光化学效率(ΦPSII)则反映吸收的光量子供给PSII反应中心的效率及开放反应中心的比例。由表4可以看出,0.5 mmol·L-1CA处理可以降低NG的NPQ,显著降低其Fv/Fm、Fv/Fo、ΦPSII和qP,分别比对照降低了4.27%、8.74%、21.07%和21.84%。而RG-T的NPQ和qP高于RG-CK,说明一定浓度CA胁迫时,嫁接会提高黄瓜叶片光合作用活性及光保护能力。对比NG-CK与RG-CK发现:RG-CK的Fv/Fm、Fv/Fo和NPQ均高于NG-CK,分别高出1.20%、8.32%、23.66%。RG-CK与RG-T之间各参数无显著差异。
2.7 CA处理对黄瓜嫁接苗与实生苗快速光响应曲线的影响
由图3可知,不同处理的黄瓜叶片随光合有效辐射强度(PAR)的增加,其相对电子传递速率(rETR)变化趋势保持一致,即先增加然后在光饱和状态下达到稳定。从图3-A可以看出,NG-CK的相对电子传递速率明显高于NG-T,而RG-CK与RG-T差异不明显(图3-B)。在光饱和状态下,RG-CK的电子传递速率较RG-T提高2.26%,较NG-CK提高8.32%,较NG-T提高22.09%,表明嫁接可以有效缓解CA处理对黄瓜幼苗叶片相对电子传递速率的抑制作用。
3 讨论与结论
自毒作用是一个农业中普遍存在的现象,并且是造成连作障碍的主要因素之一[14],其作用机理复杂,植物在接触、吸收化感物质后,导致生理生化过程紊乱。嫁接栽培在农业生产中已表现出抗病、抗逆、高产、优质的综合优良性状,在瓜类和茄果类园艺产品中得到广泛应用[15]。有研究表明,嫁接不仅可以防治土传病害,还可以提高产量、增强株苗的抗逆性,有效缓解黄瓜自毒造成的非生物胁迫[16]。本试验结果也表明0.5 mmol·L-1 CA处理后的黄瓜嫁接苗的光合生理特性及生物量的积累均优于同处理下的黄瓜实生苗。
前人研究表明,黄瓜和黑籽南瓜对外源CA的响应存在显著差异,外源CA处理对黄瓜植株生长产生抑制作用,而对黑籽南瓜植株生长无明显影响[17]。本试验对不同处理下黄瓜嫁接苗与实生苗的生长指标、根系形态及干物质的积累量进行测定,发现添加外源CA后,非嫁接黄瓜植株的株高、茎粗、叶面积增长及根系发育均低于对照植株,即外源CA对黄瓜幼苗的生长有很大的负面影响;而黄瓜嫁接苗的抑制程度较小。此结果与陈绍莉等[12]的一致,其研究表明较高浓度的CA(0.5~4.0 mmol·L-1)会显著降低自根茄的株高、茎粗及鲜样质量;较高浓度的CA(1~4 mmol·L-1)仍能促进嫁接茄的生长,只是促进效应有所减弱。
肖春兰等[18]研究发现,黄瓜的Tr、Pn、Ci和Gs在其根系浸提液、分泌物及肉桂酸和苯甲酸类衍生物的影响下均有不同程度的降低。导致光合作用下降的因素有气孔和非气孔因素,如果气孔限制因素占主导地位,在Pn和Gs下降的同时,Ci也相应下降;如果非气孔限制因素占主导地位,则Pn和Gs下降的同时,Ci却上升[19]。笔者发现,在不同浓度CA处理6 d后,黄瓜幼苗叶片Pn、Tr和Gs显著降低,而Ci则上升,表明是非气孔因素阻碍了CO2的利用,导致胞间CO2的积累,从而影响其光合能力,这与Allen和Ort研究一致[20]。贾联红[21]研究表明用嫁接西瓜茎叶、自根西瓜的根和茎叶的水浸液处理西瓜幼苗,当浓度为10 g·L-1时,Pn、Gs和Ci开始变小,随浓度的增高,Pn、Gs和Ci降低,表明西瓜残体水浸液通过影响Pn、Gs和Ci来阻碍西瓜幼苗的光合作用。本试验中0.5 mmol·L-1 CA 处理后的黄瓜嫁接苗只表现出Tr和Gs下降,这可能是因为物种的差异性和胁迫物质的差异导致的,同时,我们试验是在气候箱中以水培方式进行的,这可能是造成Tr下降的因素之一。
植物叶绿素主要通过叶绿素荧光、光合电子传递和热耗散3个途径吸收耗散光能,这3种途径间存在密切的此消彼长的相关性,叶绿素荧光变化可以反映光合作用和热耗散的情况[22]。卜瑞方[23]研究表明,与对照相比,2 mmol·L-1处理2周后显著降低了黄瓜幼苗叶片的NPQ和qP,添加Si显著增加了CA胁迫下NPQ和qP。CA处理显著降低了黄瓜幼苗叶片Fv/Fo,添加Si显著增加了CA胁迫下PSII潜在活性。本试验结果表明,0.5 mmol·L-1 CA处理后的黄瓜实生苗的Fv/Fm、Fv/Fo、qP和ΦPSII较对照显著降低,表明CA胁迫会降低PSII的原初光能转换效率,同时使PSII的潜在活性变弱,甚至导致光合系统受损[24]。与实生苗相比,嫁接增强了叶片的Fv/Fm和NPQ,提高了其光保护能力及原初光能转换效率,从而降低了外源CA胁迫对光合系统的损伤程度。通过增加非辐射性热耗散光系统能够消耗PSII吸收的过剩光能,防止PSII反应中心由于吸收过剩光能导致的光氧化损伤。0.5 mmol·L-1CA处理降低了黄瓜实生苗叶片NPQ,使叶片PSII的潜在热耗散能力下降,导致PSII在CA胁迫下更易遭受光抑制和光氧化;嫁接增加了CA处理下的黄瓜苗叶片的NPQ,提高了PSII的潜在热耗散能力,在CA胁迫下,能够减轻因PSII吸收过剩的光能而造成的光抑制和光破坏,从而起到保护PSII免受或减轻光抑制和光氧化的作用。0.5 mmol·L-1CA 处理显著减小了黄瓜实生苗叶片的qP值,说明自毒胁迫减少了参与CO2固定的电子数量,阻碍叶片暗反应正常进行,最终导致光合效率低于嫁接苗[25]。与0.5 mmol·L-1 CA处理嫁接苗相比,同处理下黄瓜实生苗叶片中叶绿素含量低,使电子传递速率、光能转化效率、和qP值等大幅度下降,导致光能向化学能转化的过程受抑制,与前人研究一致,说明嫁接可以减轻自毒胁迫对黄瓜幼苗光合系统的损伤程度。
黄瓜实生苗与嫁接苗对肉桂酸引起的自毒胁迫表现出不同的生长和生理响应。CA胁迫后黄瓜实生苗的生长发育、生物量的积累及光合能力均受到显著抑制,而嫁接苗受到的抑制作用较小或无显著差异。叶绿素荧光成像分析结果表明,嫁接通过保护PSII免受或减轻CA胁迫引起的光抑制和光氧化,从而保证植株正常的生长发育。
参考文献
[1] 杨建霞.日光温室黄瓜连作障碍研究及防治对策[J].甘肃农业,2005(11):209.
[2] 孙光闻,陈日远,刘厚诚.设施蔬菜连作障碍原因及防治措施[J].农业工程学报,2005,21(S2):184-188.
[3] INDERJI T,DUKE S O.Ecophysiological aspects of allelopathy[J].Planta,2003,217(4):529-539.
[4] YU J Q,YE S F,ZHANG M F,et al.Effects of root exudates and aqueous root extracts of cucumber(Cucumis sativus L.)and allelochemicals,on photosynthesis and antioxidant enzymes in cucumber[J].Biochemical Systematics and Ecology,2003,31(2):129-139.
[5] 呂卫光,张春兰,袁飞,等.有机肥减轻连作黄瓜自毒作用的机制[J].上海农业学报,2002,18(2):52-56.
[6] DING J,SUN Y,CIAO C L,et al.Physiological basis of different allelopathic reactions of cucumber and figleaf gourd plants to cinnamic acid[J].Journal of Experimental Botany,2007,58(13):3765-3773.
[7] 吴凤芝.外源酚酸对黄瓜自毒作用的生理生化机制研究[D].哈尔滨:东北农业大学,2002.
[8] 高旭,张古文,胡齐赞,等.自毒物质肉桂酸对豌豆幼苗生长及叶绿素荧光特性的影响[J].中国蔬菜,2013(8):44-49.
[9] 陈绍莉,周宝利,王茹华,等.嫁接对茄子根系分泌物中肉桂酸和香草醛的调节效应[J].应用生态学报,2008,19(11):2394-2399.
[10] 王茹华,曲光峰,张启发,等.肉桂酸对番茄的化感效应研究[J].中国蔬菜,2014(3):29-32.
[11] 喻景权,杜尧舜.蔬菜设施栽培可持续发展中的连作障碍问题[J].沈阳农业大学学报,2000,31(1):124-126.
[12] 陈绍莉,周宝利,尹玉玲,等.茄子自毒物质胁迫下嫁接对其生长及土壤生化特性的影响[J].园艺学报,2010,37(6):906-914.
[13] 裴孝伯,李世诚,张福墁,等.温室黄瓜叶面积计算及其与株高的相关性研究[J].中国农学通报,2005(8):80-82.
[14] YU J Q,SHOU S Y,QIAN Y R,et al.Autotoxic potential of cucurbit crops[J].Plant and Soil,2000,223(1/2):149-153.
[15] 王崇启,刘淑梅,侯丽霞,等.蔬菜嫁接专题报道(四)茄子嫁接苗的应用现状及改进方案[J].中国蔬菜,2013(7):15-18.
[16] BAZIRAMAKENGA R,SIMARD R R,LEROUX G D.Effects of benzoic and cinnamic acids on growth,mineral composition,and chlorophyll content of soybean[J].Journal of Chemical Ecology,1994,20(11):2821-2833.
[17] 朱春侠,姜伟,刘文,等.黄瓜嫁接育苗的研究进展[J].北方农业学报,2019,47(2):115-118.
[18] 肖春兰.黄瓜和黑籽南瓜幼苗对肉桂酸响应差异的生理机制研究[D].杭州:浙江大学,2006.
[19] WEIR T L,PARK S W,VIVANCO J M.Biochemical and physiological mechanisms mediated by allelochemicals[J].Current Opinion in Plant Biology,2004,7(4):472-479.
[20] 劉俊祥,孙振元,巨关升,等.重金属Cd2+对结缕草叶片光合特性的影响[J].核农学报,2009,23(6):1050-1053.
[21] 贾联红.嫁接西瓜化感效应的研究[D].四川雅安:四川农业大学,2012.
[22] 马洪英,杨小玲,仝雅娜,等.4个水果型黄瓜叶片叶绿素荧光特性的比较研究[J].天津农业科学,2019,25(10):19-22.
[23] 卜瑞方.硅缓解黄瓜种子萌发和幼苗生长自毒作用的机理研究[D].兰州:甘肃农业大学,2016.
[24] ALLEN D J,ORT D R.Impact of chilling temperatures onphotosynthesis in warm climate plants[J].Trends Plant Science,2001,1(6):36-42.
[25] 杨广东,朱祝军,计玉妹.不同光强和缺镁胁迫对黄瓜叶片叶绿素荧光特性和活性氧产生的影响[J].植物营养与肥料学报,2002,8(1):115-118.
