猕猴桃园生草对土壤微生物多样性的影响
2020-07-06林峰杨殿林王华玲王慧刘红梅刘惠芬
林峰 杨殿林 王华玲 王慧 刘红梅 刘惠芬


摘要:探讨生草对猕猴桃园土壤微生学特性的影响。采用Biolog生态板技术,研究自然留养杂草(CK)、黑麦草/白三叶复合种植(2种草)、黑麦草/白三叶/早熟禾/红三叶复合种植(4种草)、黑麦草/白三叶/早熟禾/红三叶/紫羊茅/毛苕子/波斯菊/百日草(8种草)4种生草处理模式对猕猴桃园土壤化学性质、土壤酶活性和土壤微生物群落功能多样性的影响。结果表明,4种草处理能够显著提高土壤有机碳和全氮含量以及土壤碱性磷酸酶活性。培养96 h时,生态板的平均颜色变化率(AWCD)排序为4种草处理>8种草处理>2种草处理>CK。2种草处理的土壤微生物群落功能多样性指数、优势度指数和均匀度指数均低于对照,而4种草和8种草处理则均高于对照,但各处理间无显著差异。主成分分析结果表明,4种生草处理模式下土壤微生物的碳源利用能力存在较大差异,4种草和8种草处理对土壤微生物碳源利用能力较高。
关键词:猕猴桃园;生草;Biolog-Eco微平板;功能多样性;土壤微生物
中图分类号: S154.3 文献标志码: A 文章编号:1002-1302(2020)10-0293-05
收稿日期:2019-05-21
基金项目:中国农业科学院丹江口水源涵养区绿色高效农业技术创新集成与示范项目(编号:CAAS-XTCX2016015)。
作者简介:林 峰(1992—),男,安徽合肥人,硕士,研究方向为生物多樣性与生态农业。E-mail:1659200412@qq.com。
通信作者:刘红梅,博士,副研究员,研究方向为生物多样性与生态农业,E-mail:liuhongmei@caas.cn;刘惠芬,博士,教授,研究方向为饲草种质资源的评价与新品种选育,E-mail:paula913@126.com。
果园生草是近年来在国内兴起的果园管理新模式[1],该模式已在苹果园、梨园、葡萄园等果园中得到应用。果园生草改变了过去人们对果园的传统清耕管理方式,克服了传统清耕方式导致的水土流失、地力退化和生物多样性降低等一系列生态环境问题。有研究表明,生草能够增加果园生物多样性,提高土壤养分含量和酶活性[2-3],增加细菌多样性[4],提高土壤微生物对碳源的利用能力[5]。果园生草是实现果树产业提质增效及农业可持续发展的途径之一。
土壤微生物是果园生态系统的重要组成部分,是土壤质量变化的重要指示指标。土壤酶参与土壤生物化学过程,是土壤微生物作用于生物化学过程的媒介,常用来表征土壤微生物的群落活性[6]。果园生草后,土壤微生物种群数量明显提高,有利于改善果树土壤根际微生物环境[7]。果园生草种植草的种类不同,对果园土壤微生学特性的影响效果也不同。庞建光等的研究表明,在桑园行间种植毛叶苕子能显著提高土壤细菌、真菌和放线菌数量[8]。惠朱梅等的研究表明,在葡萄园行间种植白三叶和紫花苜蓿对土壤肥力提高的效果优于种植高羊茅[9]。杜毅飞等的研究表明,种植白三叶和小冠花的土壤微生物活性高于种植鸡脚草[5]。良好的土壤微生物学特性有助于果园生态系统的稳定,有利于果树产量和品质的提高。
猕猴桃(Actinidia chinensis Planch)为多年生落叶藤本植物,是重要的经济作物之一。生草栽培对猕猴桃园土壤养分、酶活性及微生物多样性的影响尚不清楚。为此,本研究采用Biolog生态板法研究4种生草处理对猕猴桃园土壤理化性质、酶活性和微生物群落功能多样性的影响,以期为猕猴桃园土地的合理化利用和科学管理提供理论依据。
1 材料与方法
1.1 试验地概况
试验区位于湖北省十堰市农业科学院柳陂试验基地猕猴桃果园,海拔高度为230 m,地理位置为 110°43′47″E、32°49′6″N,属亚热带季风气候。年平均气温为16 ℃,≥10 ℃有效积温为5 139 ℃,无霜期224~225 d,生长期平均气温为22.6 ℃,年日照时数为 1 655~1 958 h,年降水量为800~900 mm,气候温和,日照充足。土壤为黄棕壤,偏碱性。
1.2 试验设计与样品采集
选择试验基地5年生猕猴桃园(行距3 m,株距5 m)进行生草试验。于2018年3月进行播种。设4个生草处理:(1)自然留养杂草处理(对照,CK);(2)黑麦草(Ryegrass)、白三叶(White clover)2种草复合种植;(3)黑麦草、白三叶、早熟禾(Poa pratensis)、红三叶(Red clover)4种草复合种植;(4)黑麦草、白三叶、早熟禾、红三叶、紫羊茅(Festuca rubra)、毛苕子(Vicia villosa)、波斯菊(Cosmos bipinnata)、百日草(Zinnia elegans Jacq)8种草复合种植。每个处理3次重复,小区面积为60 m×15 m,小区间设1.5 m隔离带。
2018年7月采用“S”形取样法进行土壤样品的采集,每个小区选取10个点,去除表面植被后,用直径为3 cm的土钻,取0~20 cm土层的土壤样品,将同一小区土壤样品混合均匀,去除根系和土壤入侵物,然后采用四分法选取1 kg土样并将其分成2份,将其中一份迅速装入无菌封口袋,放入冰盒中带回实验室,存放于4 ℃低温条件下,用于测定土壤微生物群落功能多样性和速效养分含量;另一份土样带回室内,让其自然风干,研磨过筛后用于土壤理化因子的测定。
1.3 测定方法
土壤pH值采用玻璃电极法(土水比1 ∶ 2.5)测定,土壤全氮含量采用凯氏定氮法测定,土壤铵态氮、硝态氮含量采用氯化钾溶液提取-流动分析仪(AA3,德国)测定,土壤速效磷含量采用碳酸氢钠提取-钼锑抗比色法测定,土壤有机碳含量采用重铬酸钾外加热法测定,上述测定方法参照鲍士旦主编的《土壤农化分析》[10]。
土壤酶活性采用酶试剂盒和分光光度计测定。
土壤微生物群落功能多样性[11]的测定:称取相当于10 g烘干土壤的新鲜土壤样品,加入90 mL灭菌生理盐水(浓度为0.85%),用封口膜将瓶口封好。在摇床上振荡30 min后,摇匀,静置10 min后,取上清用灭菌生理盐水稀释至 1 000 倍。将 150 μL 稀释液加入到Biolog-Eco微平板的96个孔中,每个处理重复3次。将Biolog-Eco微平板放在生化培养箱中培养,28 ℃条件下连续培养7 d后,在Biolog微孔板读数仪(BIOLOGInc.,USA)上每 24 h 读数1次。Biolog数据采用Garland等提出的微平板每孔平均颜色变化率(AWCD)来表示[12],AWCD具体计算公式如下:
AWCD=∑(Ci-R)/n。
式中:Ci为每个有培养基孔的光密度值;R为对照孔的光密度值;n为Biolog-Eco微平板上供试碳源的种类数,其值为31,重复3次。
用Shannon指数(H)、Simpson优势度指数(D)和Shannon均匀度指数(E)来表征土壤微生物群落代谢功能多样性。采用培养96 h时Biolog-Eco平板孔的吸光值来计算土壤微生物群落功能多样性指数,计算公式分别为
H=-∑pi×lnpi;
D=1-∑p2i;
E=H/lnS。
式中:Pi为第i孔相对吸光值与整个平板相对吸光值总和的比率;S是有颜色变化的孔的数目。
1.4 數据统计与分析
采用Excel 2010软件对数据进行统计分析,采用SPSS 16.0统计软件进行单因素方差分析和主成分分析,采用最小显著差数(One-way ANOVA)法进行差异显著性检验,采用Duncans法进行多重比较。
2 结果与分析
2.1 生草栽培对土壤化学性质的影响
由表1可见,3种生草种植对土壤pH值、铵态氮含量和速效磷含量均无显著性影响。种植8种草处理的土壤有机碳含量显著高于CK、2种草处理和4种草处理(P<0.05),其中2种草、4种草处理的有机碳含量显著高于对照处理(P<0.05),分别比对照提高34.98%和41.02%。种植4种草处理土壤全氮含量显著高于自然留养杂草处理(CK)(P<0.05),比CK提高了21.57%;种植2种草和种植8种草的处理土壤全氮含量与对照无显著差异。
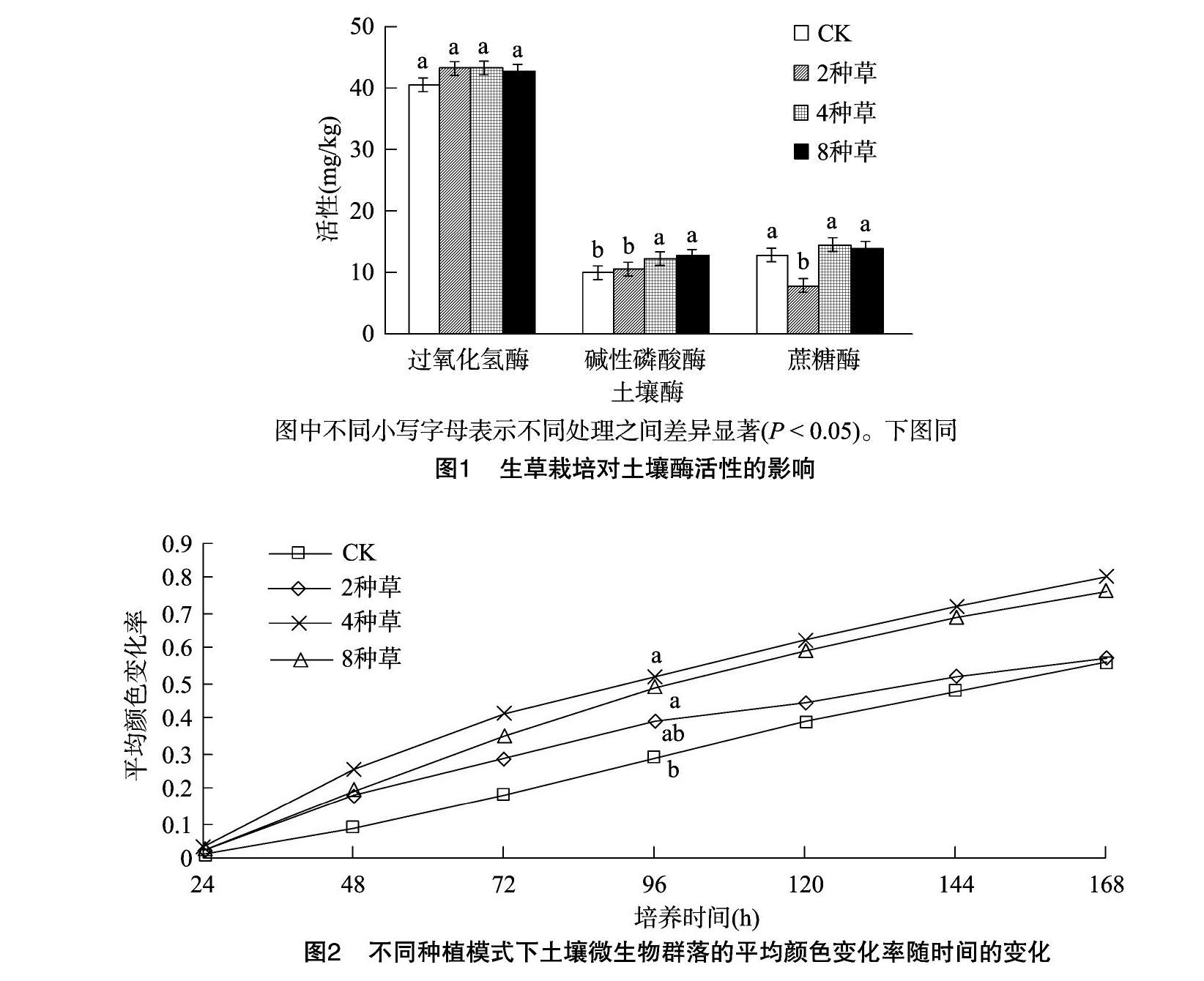
2.2 生草栽培对猕猴桃园土壤酶活性的影响
生草栽培后土壤过氧化氢酶、碱性磷酸酶、蔗糖酶活性变化见图1。由图1可见,2种草、4种草、8种草处理的土壤过氧化氢酶活性均高于CK,大小关系表现为4种草处理>2种草处理>8种草处理>CK,4种草、2种草、8种草处理较CK的增幅分别为6.78%、6.41%、5.57%,但各处理间无显著差异。4种草、8种草处理可显著提高碱性磷酸酶活性(P<0.05),2种草处理的碱性磷酸酶活性与CK相比无显著差异,大小表现为8种草处理>4种草处理>2种草处理>CK,8种草、4种草、2种草处理较CK的增幅分别为23.10%、18.64%和1.30%。4种草处理和8种草处理的蔗糖酶活性高于CK,增幅分别为8.97%和6.63%,但无显著差异;2种草处理显著降低了蔗糖酶活性(P<0.05)。
2.3 不同生草栽培处理下微生物群落的平均颜色变化率变化特征
Biolog-Eco微平板每孔平均颜色变化率反映了土壤微生物利用单一碳源的能力,是土壤微生物活性及群落功能多样性的重要指标[13]。由图2可知,在培养24 h内,各生草栽培处理AWCD值均较小,说明在培养24 h内土壤微生物对碳源基本未利用。随着培养时间的增加,不同生草处理的AWCD值均呈增长的趋势,表明土壤微生物利用碳源的能力在不断增加。AWCD值增长速率在不同种草处理下大不相同,说明不同处理间微生物对碳源的利用能力有较大差异。培养96 h后,AWCD值排序为4种草处理>8种草处理>2种草处理>CK。根据方差分析,4种草、8种草处理与CK之间具有显著差异(P<0.05),2种草处理与CK之间无显著差异。整体来看,培养期内土壤微生物的碳源利用能力在2种草、4种草、8种草处理下均高于CK。
2.4 生草栽培对土壤微生物群落多样性指数的影响
不同种草处理下土壤微生物群落的功能多样性指数见表2,可以看出,Shannon指数、均匀度指数、优势度指数均在4种草处理下达到最大值。4种草、8种草处理的Shannon指数与CK相比分别提高 10.20% 和9.58%,但是各处理间均无显著性差异;优势度指数和均匀度指数值在4种草、8种草处理间相同,与CK相比均提高1.03%和1.80%。2种草处理的Shannon指数、优势度指数、均匀度指数均低于CK。总体来说,4种草处理的土壤微生物群落多样性优于其他2种生草处理。
2.5 土壤微生物群落碳源利用的主成分分析
利用培养96 h时的AWCD值,对4种草处理土壤微生物对31种碳源底物利用情况进行主成分分析。在31个因子中共提取3个主成分因子,累积方差贡献率达到98.99%。选取累积方差贡献率达到82.20%的前2个主成分PC1和PC2,分析微生物群落功能多样性,其中第1主成分PC1贡献率为5266%,第2主成分PC2贡献率为29.54%。由图3可见,不同生草处理的PC值在PC轴上出现了明显的分布差异,整体可分为3类,4种草处理为一类,8种草处理为一类,2种草处理和自然留养杂草处理为一类,说明生草处理的不同明显影响了土壤微生物对碳源的利用能力。在PC1轴上,4种草处理分布在正方向上,得分系数为1.75;8种草处理、2种草处理、CK分布在PC1轴负方向上,得分系数为-0.41~-0.65。在PC2轴上,8种草处理分布在正方向上,得分系数为1.63;4种草处理、2种草处理、CK分布在负方向上,得分系数为 -0.22~-0.99。说明4种草处理和8种草处理土壤微生物的碳源利用能力较高。
3 讨论
果园生草增加了植物种类和根系分泌物,提高了生物量积累。已有研究表明,果园生草能增加土壤有机质含量[14]。本研究表明,黑麦草/白三叶复合种植、黑麦草/白三叶/早熟禾/红三叶复合种植和黑麦草/白三叶/早熟禾/红三叶/紫羊茅/毛苕子/波斯菊/百日草复合种植的土壤有机碳含量均显著高于自然留养生草对照。李祥彬在蜜柚园生草后发现,土壤化学性质发生了显著变化,其中,在0~60 cm土层,土壤有机质含量显著提高[15]。周民生等的研究表明,獼猴桃园生草可以提高土壤有机质含量,且豆科牧草优于禾本科牧草,主要是由于种植豆科牧草可通过固氮作用提高土壤全氮含量[16]。本研究中黑麦草/白三叶复合种植与对照之间土壤全氮含量无显著差异,黑麦草/白三叶/早熟禾/红三叶复合种植能显著提高土壤有机碳、全氮含量。Qian等在苹果园中种植白三叶和小冠花后,土壤全氮含量显著提高,种植黑麦草与清耕处理之间无显著差异[17]。
土壤酶活性反映土壤微生物活性和生化反应强度[18]。土壤蔗糖酶参与土壤碳循环转化,其活性反映土壤碳转化强度。过氧化氢酶分解土壤中产生的过氧化氢,反映生物呼吸强度。本研究表明,黑麦草/白三叶复合种植、黑麦草/白三叶/早熟禾/红三叶复合种植、黑麦草/白三叶/早熟禾/红三叶/紫羊茅/毛苕子/波斯菊/百日草复合种植均能提高土壤过氧化氢酶和碱性磷酸酶活性。徐凌飞等的研究表明,生草栽培提高了梨园土壤过氧化氢酶和蔗糖酶活性[19]。Qian等的研究表明,苹果园生草提高了脲酶和碱性磷酸酶活性[17]。本研究与其研究结果一致,其主要原因是种植禾本科和豆科牧草,增加了土壤有机质含量,微生物可利用的营养物质增多,从而增加了土壤酶活性[20]。
土壤微生物多样性是评价土壤生态系统稳定性的重要生物学指标[21-22]。本研究中,不同生草处理的AWCD值随着培养时间的延长呈增加趋势,即土壤微生物利用碳源代谢活性随着培养时间的延长呈增加趋势。在培养期内,黑麦草/白三叶复合种植、黑麦草/白三叶/早熟禾/红三叶复合种植和黑麦草/白三叶/早熟禾/红三叶/紫羊茅/毛苕子/波斯菊/百日草复合种植的AWCD值高于自然留养杂草对照,分析原因可能是生草栽培改善了土壤水热状况,提高了土壤养分含量,更有利于微生物的生存与繁殖。这与杜毅飞等在苹果园生草的研究结果[5]一致。在培养96 h时,不同生草处理的土壤微生物碳源利用能力存在明显差异,表现为4种草处理>8种草处理>2种草处理>CK。本研究主成分分析结果表明,4种生草处理在PC1和PC2轴明显分开,说明4种生草处理土壤微生物的利用碳源能力不同。这是因为不同生草处理所产生的凋落物和根系分泌物数量和质量不同,凋落物和根系分泌物在分解过程中释放的有机物质有很大差异,因此为微生物提供的营养物质不同。前人研究认为,不同植物根系产生的碳源类型不尽相同,从而导致土壤微生物群落组成不同[23]。本研究中,黑麦草/白三叶/早熟禾/红三叶复合种植和黑麦草/白三叶/早熟禾/红三叶/紫羊茅/毛苕子/波斯菊/百日草复合种植的Shannon指数、优势度指数和均匀度指数均高于自然留养杂草对照,说明这2种生草处理模式的土壤微生物群落功能多样性指数高于自然生草处理。
综上可见,猕猴桃园生草栽培为果园土壤输入了杂草凋落物和根系分泌物,改变了土壤理化性质,引起了土壤酶活性和土壤微生物群落组成发生变化。但由于本研究处理时间较短,只是初步反映了猕猴桃园生草栽培土壤微生物学性状变化,因此,还需要进一步在较长时间范围内观测揭示猕猴桃园生草的土壤生态过程。
4 结论
本研究表明,猕猴桃园生草能够改变土壤微生态环境,提高土壤过氧化酶和蔗糖酶活性。4种生草处理模式土壤微生物对碳源的利用差异很大,其中黑麦草/白三叶/早熟禾/红三叶复合种植土壤微生物对碳源的利用能力最高,其次是黑麦草/白三叶/早熟禾/红三叶/紫羊茅/毛苕子/波斯菊/百日草复合种植。
参考文献:
[1]曹 铨,沈禹颖,王自奎,等. 生草对果园土壤理化性状的影响研究进展[J]. 草业学报,2016,25(8):180-188.
[2]王根旺,宋 曦. 陇东黄土高原地区杏园土壤综合肥力对人工生草模式的响应及其环境解释[J]. 干旱地区农业研究,2018,36(4):29-39.
[3]孙计平,张玉星,李英丽,等. 生草对梨园土壤微生物、酶活性和腐殖质含量的影响[J]. 果树学报,2016,33(增刊1):129-135.
[4]钱雅丽,梁志婷,曹 铨,等. 陇东旱作果园生草对土壤细菌群落组成的影响[J]. 生态学杂志,2018,37(10):3010-3017.
[5]杜毅飞,方凯凯,王志康,等. 生草果园土壤微生物群落的碳源利用特征[J]. 环境科学,2015,36(11):4260-4267.
[6]Alvarez S,Guerrero M C. Enzymatic activities associated with decomposition of particulate organic matter in two shallow ponds[J]. Soil Biology and Biochemistry,2000,32(13):1941-1951.
[7]高 军. 地面覆盖方式对苹果园土壤水分及微生物群落的影响[J]. 甘肃农业科技,2017(2):41-42.
[8]庞建光,朱 铮,武 龙. 桑园生草对土壤养分、微生物及桑葚品质的影响[J]. 河北大学学报(自然科学版),2017,37(3):267-273.
[9]惠竹梅,李 华,龙 妍,等. 葡萄园行间生草体系中土壤微生物数量的变化及其与土壤养分的关系[J]. 园艺学报,2010,37(9):1395-1402.
[10]鲍士旦. 土壤农化分析[M]. 3版.北京:中国农业出版社,2000.
[11]刘红梅,赖 欣,宋晓龙,等. 转双价基因(Bt+CpTI)棉种植对根际土壤微生物群落功能多样性的影响[J]. 中国农学通报,2012,28(36):231-236.
[12]Garland J L,Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J]. Applied and Environmental Microbiology,1991,57(8):2351-2359.
[13]袁颖红,樊后保,刘文飞,等. 模拟氮沉降对杉木人工林(Cunninghamia lanceolata)土壤酶活性及微生物群落功能多样性的影响[J]. 土壤,2013,45(1):120-128.
[14]王耀锋,邵玲玲,刘玉学,等. 桃园生草对土壤有机碳及活性碳库组分的影响[J]. 生态学报,2014,34(20):6002-6010.
[15]李祥彬. 生草对蜜柚园生态环境及果树生长发育的影响[D]. 福州:福建农林大学,2017:20-24.
[16]周民生,蒋迎春,罗前武,等. 猕猴桃园生草栽培草种筛选试验[J]. 中国果树,2009(5):29-32.
[17]Qian X,Gu J,Pan H J,et al. Effects of living mulches on the soil nutrient contents,enzyme activities,and bacterial community diversities of apple orchard soils[J]. European Journal of Soil Biology,2015,70:23-30.
[18]馬忠明,杜少平,王 平,等. 长期定位施肥对小麦玉米间作土壤酶活性的影响[J]. 核农学报,2011,25(4):796-801,823.
[19]徐凌飞,韩清芳,吴中营,等. 清耕和生草梨园土壤酶活性的空间变化[J]. 中国农业科学,2010,43(23):4977-4982.
[20]付学琴,刘琚珥,黄文新. 南丰蜜橘园自然生草对土壤微生物和养分及果实品质的影响[J]. 园艺学报,2015,42(8):1551-1558.
[21]van der Heijden M G A,Wagg C. Soil microbial diversity and agro-ecosystem functioning[J]. Plant and Soil,2013,363(1/2):1-5.
[22]钱 玮,陈宏伟,胡翠英,等. 苏州不同果园土壤原核微生物的群落结构和多样性[J]. 江苏农业科学,2018,46(22):276-279.
[23]Grayston S J,Wang S Q,Campbell C D,et al. Selective influence of plant species on microbial diversity in the rhizosphere[J]. Soil Biology & Biochemistry,1998,30(3):369-378.
