厌氧条件下香草酸降解菌的分离与鉴定
2020-07-06赵晴雨陆依琳袁茜刘曹彤彭学
赵晴雨 陆依琳 袁茜 刘曹彤 彭学


摘要:以香草酸作为唯一碳源,在厌氧条件下从江苏徐州奎河河底淤泥中分离和筛选出具有降解香草酸能力的菌株C1和C2,根据其菌落特征及生理生化分析,得出菌株C1的最适温度为40 ℃,最适pH值为7;菌株C2的最适温度为25 ℃,最适pH值为5,初步确定2种菌株降解香草酸的机制。通过16S rDNA序列分析得出,菌株C1与产气克雪伯菌(Klebsiella aerogenes)的相似度为99.7%;菌株C2与重氮营养菌(Phytobacter diazotrophicus)的相似度为 99.5%。菌株C1、C2的成功分離为利用厌氧微生物治理环境污染问题的研究提供了一个新方向。
关键词:木质素;香草酸;厌氧菌;革兰氏染色;PCR扩增;系统进化树
中图分类号:X703.5;S182 文献标志码: A 文章编号:1002-1302(2020)10-0269-04
收稿日期:2019-04-18
基金项目:江苏师范大学科研创新计划校立项目(编号:2018YXJ341)。
作者简介:赵晴雨(1994—),女,江苏徐州人,硕士研究生,主要从事环境微生物学研究。E-mail:779491190@qq.com。
通信作者:彭 学,博士,教授,主要从事环境微生物学研究。E-mail:pengxueinchina@aliyun.com。
自然界中广泛存在许多芳香族化合物,苯环是其中分布最广的化学单元,具有苯环结构的化合物有很大的毒性,同时有可能致畸和致突变[1]。木质素是其中含量最丰富的芳香族化合物,其与纤维素和半纤维素构成植物骨架的主要成分。木质素十分稳定,不易降解,是由苯丙烷单元结构与醚键和碳碳键组成的无定型芳香族化合物,它的分解与碳循环相关[2]。同时,木质素是造纸工业废弃物以及城市生活垃圾中的一种难降解物质,采用化学试剂进行废弃物降解时,会造成严重的环境污染。木质素是木质的主要成分之一,自然界中木质素的降解都依赖真菌与细菌的共同作用,高分子木质素被真菌的胞外酶分解成低分子芳香族化合物,然后土壤细菌将其完全降解为二氧化碳[3],但其降解速度极慢,再加上人类活动因素,导致木质素的堆积量远远超过自然界的自我降解量[4-8]。
木质素结构复杂,其代谢途径和有关的酶和基因还未研究清楚,目前研究较为明确的主要是鞘氨醇单胞菌SYK-6对木质素的代谢途径[9]。通过前人研究香草酸代谢途径发现,红球菌RHA1可降解β-芳基醚木质素模型物,3-(3′-甲氧基-4′-羟苯基)-3-酮基-丙醇和草酸为主要产物,副产物为香草酸。同时能降解联苯木质素模型物生成中间代谢产物5-羧基香草酸,经脱羧形成香草酸。该菌中vdh基因和van A基因分别编码香草醛脱氢酶和香草酸去甲基化酶。研究发现,在敲除vdh基因后红球菌RHA1不能在以香草醛为单一碳源培养基上生长但能在以香草酸为单一碳源培养基上生长[10]。
研究清楚木质素的代谢网络,对于构建木质素降解菌的酶系统十分重要,不仅有利于进一步了解碳素循环,还有助于将木质素转化为有工业价值的中间代谢产物。研究木质素的生物降解途径是解决这类环境问题的关键。香草酸是自然界中普遍存在的芳香族化合物,是很多人工化合物的重要中间代谢产物,也是较为常见的环境污染物之一。目前,香草酸的厌氧降解少见报道。对厌氧环境中香草酸降解菌进行研究,不仅能够更好地了解芳香族化合物的碳素循环,还有利于水环境污染的治理。关于香草酸的微生物降解途径已有一些研究报道,但关于厌氧微生物的研究较少,本试验以香草酸为唯一碳源,从江苏省徐州市奎河河底淤泥中分离筛选出能够分解香草酸的厌氧微生物,再通过16S rDNA序列测定和系统发育树构建鉴定菌种,测定其生理生化性质,从而进一步了解厌氧菌对香草酸的降解机制。
1 材料与方法
1.1 材料
1.1.1 试验材料 徐州奎河河泥。
1.1.2 试验试剂 NH4Cl、Na2SO4、MgSO4·7H2O、K2HPO4·3H2O、Fe(NH4)2(SO4)2·6H2O、CaCl2、结晶紫、草酸铵、番红染液、甘油、无水乙醇、95%乙醇、LB肉汤粉。细菌基因组DNA抽提试剂盒、DNA maker、DNA loading buffer。
1.2 试验方法
1.2.1 菌株分离 菌株分离以0.2%香草酸为唯一碳源,在厌氧工作站(95% N2和5% H2)中先富集培养,然后平板涂布,采用三区划线法获得单一菌株,得到菌株后采用甘油保藏法于-80 ℃长久储存。该试验所有菌株的培养均在厌氧工作站中完成。
1.2.2 菌种鉴定
1.2.2.1 革兰氏染色 采用经典革兰氏染色法进行鉴别性染色,于显微镜下观察颜色反应,紫色为阳性菌,红色为阴性菌。
1.2.2.2 16S rDNA测定 提取菌株全基因组DNA,以全基因组DNA为模板进行16S rDNA PCR反应,冰浴条件下加以下成分于250 μL离心管中。反应体系如下:27.8 μL ddH2O、5 μL 10×PCR Buffer、5 μL dNTP Mix、4 μL 0.2 mmol/L MgCl2、3 μL 10 mmol/L 引物 1(27F,5′-AGAGTTTGATCCTGGCT-3′)、3 μL 10 mmol/L 引物 2(1 492R,5′-GGTTACCTTGTTACGACTT-3′)、2 μL模板DNA、0.2 μL Taq DNA聚合酶。混匀后,将离心管放入PCR仪,95 ℃预变性 5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸 90 s,30个循环;72 ℃保温10 min。取PCR扩增产物,与DNA loading buffer以体积比为 1 ∶ 1 混匀,以5 μL DNA Maker为对照进行琼脂糖凝胶电泳,检测PCR能否成功扩增出目的条带。将纯化后的16S rDNA送到生工生物工程(上海)股份有限公司测序,通用引物为27F(5′-AGAGTTTGATCCTGGCT-3′)和1 492R(5′-GGTTACCTTGTTACGACTT-3′)。
1.2.3 最适温度 挑取单菌落于含3 mL LB培养基的试管中,培养至D600 nm值为1.0左右,分别取100 μL菌液于含100 mL LB培养基的三角瓶中,使D600 nm值在0.05~0.10之间。每3个三角瓶为1组平行,同时放置于温度为20、25、30、35、40、45、50 ℃的摇床(200 r/min)内培养,8 h后测D600 nm值并绘制最适温度生长的曲线。
1.2.4 最适pH值 挑取单菌落于含50 mL液体营养培养基的三角瓶中,培养至D600 nm值为1.0左右。加100 μL菌液于含3 mL不同pH值液体营养培养基的试管中,使D600 nm值在0.05~0.10之间。每3支试管作为1组平行,同时放置于2个菌种最适温度的摇床(200 r/min)上培养24 h,测D600 nm值。pH值梯度为4、5、6、7、8、9、10。
1.2.5 生理生化反应 挑取单菌落于含3 mL液体营养培养基的试管中,培养至D600 nm值为1.0左右,将菌液移至1.5 mL离心管内,6 000 r/min离心 2 min,弃上清。用相同体积的无菌水重悬菌体,继续6 000 r/min离心2 min,弃上清。加1 mL无菌水于沉淀中制成菌悬液。取微量生化反应管用砂条割开,滴加3~4滴菌悬液,置2个菌种最适温度下孵育24 h,观察生化管内培养液颜色变化。
2 结果与分析
2.1 菌株形态特征
以0.2%香草酸作为唯一碳源、河底淤泥为样品在厌氧工作站中筛选香草酸降解菌,共筛选获得2种菌株,分别命名为菌株C1、C2。其中菌株C1单菌落形态具有较小、圆形、乳白色、不透明、边缘整齐等特征,该菌株革兰氏染色后,在油镜下观察呈红色短小棒状(图1),可以确定该菌株属于革兰氏阴性菌。而菌株C2单菌落呈现较小、淡黄色、不透明、边缘整齐等特征,革兰氏染色后为短杆状的革兰氏阳性菌(图2)。
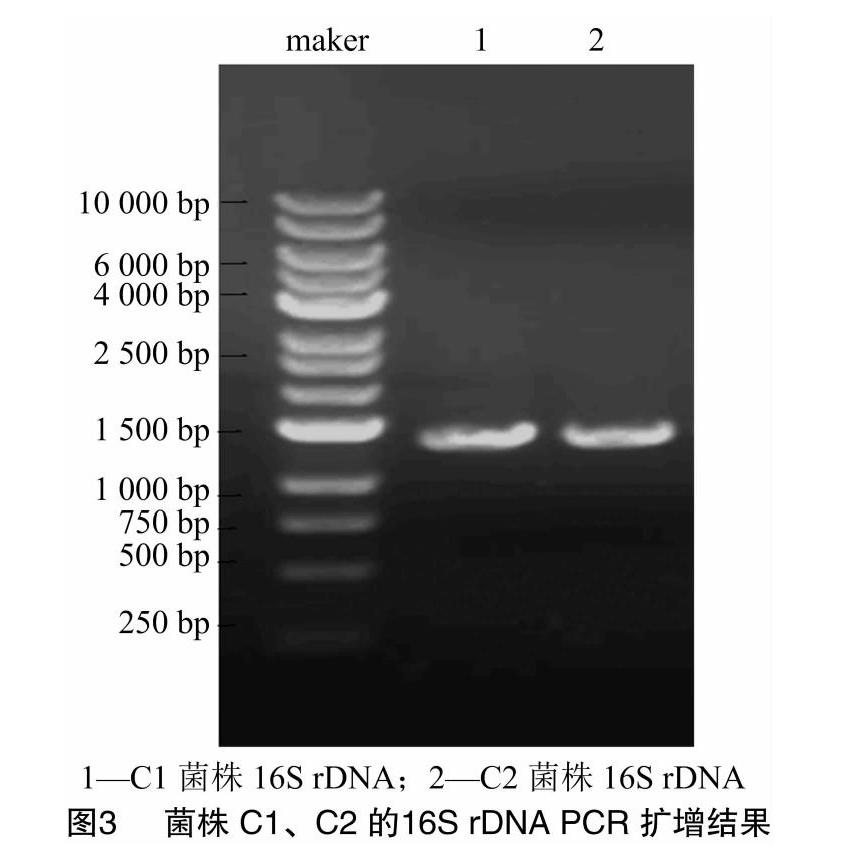
2.2 菌株16S rDNA电泳结果
分别以菌株C1、C2的全基因组DNA为模板,27F、1 492R为引物进行16S rDNA的PCR扩增,获得片段大小为1 500 bp左右,条带明亮单一(图3)。
2.3 测序结果及系统进化树的构建
菌株C1、C2的16S rDNA PCR产物经测序后获得相应序列,将测序结果提交到模式菌株数据库(http://www.ezbiocloud.net/eztaxon/identify),检索与所测序列相近的已知菌株,并利用MEGA 7软件绘制系统进化树。由图4可知,菌株C1与产气克雷伯菌(Klebsiella aerogenes)的相似度最高,为997%,产气克雷伯菌(K. aerogenes)是一种兼性厌氧菌[11],常见于肠道内容物或土壤等中,目前还没有相关降解木质素的报道。菌株C2与重氮营养菌(Phytobacter diazotrophicu)P. diazotrophicus最相似,相似度为99.5%,目前关于菌株的研究不是很多。
2.4 最适温度
从图5可以看出,菌株C1在20~50 ℃均有生长,且 40 ℃ 下培养的生长情况优于 20、25、30、35、45、50 ℃,而在50 ℃下几乎不生长。因此,菌株C1的最适温度为40 ℃左右。菌株C2在20~30 ℃有较好生长,25 ℃左右D600 nm值最高,40~50 ℃生长较缓慢,因此,菌株C2的最适温度为25 ℃左右。
2.5 最适pH值
从图6可以看出,菌株C1可以在pH值4~10的条件下生长,且在pH值为5~9条件下生长繁殖情况较好,强酸强碱条件下不能生长,菌株C1的最适pH值为7左右。而菌株C2在pH值4~10生长情况无明显变化,酸性条件下生长更旺盛,推断其最适pH值为5左右。
2.6 生理生化特征
利用微量生化反应管对降解菌C1、C2的部分生理生化特性进行分析,接菌孵育24 h,根据生化管内培养液颜色变化可知降解菌C1的生长情况。由表1可知,菌株C1能利用大部分糖类物质,如果糖、蔗糖、乳糖、麦芽糖、棉子糖、山梨糖、D-核糖、甘露糖等,此外还能够利用一些氨基酸和有机酸,如精氨酸、赖氨酸、鸟氨酸、丙二酸盐、尿素等。菌株C2只能利用部分糖类物质如果糖、蔗糖、麦芽糖、D-核糖、甘露糖等,以及部分有机酸如丙二酸盐、七叶苷、β-半乳糖苷,但不能利用如精氨酸、赖氨酸、鸟氨酸。
3 讨论与结论
通过对奎河河底淤泥中微生物的厌氧分离筛选,获得菌株C1、C2 等2种香草酸降解效率较高的菌株,通过对2种菌株的研究比较发现,菌株C1可降解的底物较C2更丰富,并且菌株C1适应环境的能力更强,其菌株活性在较大的温度范围及pH值范围内都较高,因此菌株C1更利于深入研究。
微生物降解环境有害物质一直都备受研究者关注,目前关于木质素的降解途径并不是非常完善,研究微生物对香草酸的代谢途径有助于进一步了解微生物对木质素的降解。通过本研究可以初步了解部分厌氧微生物对香草酸的降解能力,为研究厌氧微生物对香草酸的降解奠定一部分理论基础。同时,深入研究菌株C1可能会为降解香草酸和木质素提供帮助,将其开发为环境有益降解菌,有助于缓解环境中木质素和香草酸的大量累积导致的污染。但是本研究还只是初步的探究试验,并未获得相关降解基因和降解酶的信息,后续工作还很多,很值得期待。
参考文献:
[1]郑金来,李君文,晁福寰. 苯胺、硝基苯和三硝基甲苯生物降解研究進展[J]. 微生物学通报,2001,28(5):85-88.
[2]谢长校,孙建中,李成林,等. 细菌降解木质素的研究进展[J]. 微生物学通报,2015,42(6):1122-1132.
[3]张 辉. 木质素降解酶系研究新进展[J]. 天津农业科学,2006, 12(3):8-12.
