植物生长调节剂对罗浮山黄精繁殖的影响
2020-07-06廖建良周泽鑫
廖建良 周泽鑫

摘要:以黄精种子作为试验材料,研究了不同植物生长调节剂浸种、浸种时间对黄精种子萌发的影响,以筛选适合黄精种子萌发的植物生长调节剂;用黄精的地下根茎作为组织培养的材料,以筛选出合适的培养基。结果表明,GA3、6-BA和IAA这3种植物生长调节剂都能对黄精种子的萌发起到明显的促进作用。其中GA3对黄精种子萌发的促进作用要优于6-BA和IAA,在GA3质量浓度为150 mg/L,浸种时间为24 h时,其发芽率与发芽势最大,分别为 90.00%、64.67%。24 h的浸种效果要优于12 h。在黄精植物组织培养中,最佳的消毒灭菌方式为先用75%乙醇溶液浸泡15 s、后再用0.1% HgCl2溶液浸泡20 min。理想的芽分化诱导培养基为MS+3.0 mg/L 6-BA+0.5 mg/L IAA、MS+3.0 mg/L 6-BA+0.5 mg/L IBA。最优的增殖培养基为MS+4.0 mg/L 6-BA+0.2 mg/L IAA,增殖系数达到 2.1,且不定芽长势良好。
关键词:黄精;植物生长调节剂;快速繁殖;组织培养
中图分类号:S567.23+9.043 文献标志码: A 文章编号:1002-1302(2020)10-0168-05
收稿日期:2019-03-26
基金项目:广东省科技计划(编号:2017A020213031);惠州市科技项目(编号:2016X0427042);惠州学院植物学课程群优秀教学团队(编号:TD2016003);广东省植物学精品共享课程[编号:粤高校(2017)24号];惠州学院项目(编号:hzu201703)。
作者简介:廖建良(1965—),男,广东紫金人,硕士,教授,研究方向为药用植物学。E-mail:chxnljl@163.com。
黄精为百合科(Liliaceae)黄精属(Polygonatum)多年生草本植物,具有药用、食用、观赏和美容等价值。黄精的种类很多,按形状不同,可分别为“大黄精”“鸡头黄精”“姜形黄精”。黄精主要含多糖、低聚糖、黄酮、蒽醌、皂苷、木脂素等化合物,以其根茎入药,性平、味甘,为滋补上品,具有滋阴润燥、补肾益精、降血脂、降血糖、降血压、提高人体免疫力、抗衰老等功效[1-5]。因此,在研制新药和开发保健品等方面黄精具有广阔前景。由于人们对黄精的需求日益增加,野生黄精资源已远不能满足当今生产需要,人工规模化种植成为黄精资源获得的发展趋势。黄精的繁殖方式为有性繁殖(种子繁殖)和无性繁殖(根茎繁殖)2种[6-7],但其种子成熟后具较长的休眠期,且种子在自然条件下发芽率极低,播种后第1年出苗率也低,从播种到收成的生长历程长达5~6年,黄精生长缓慢,药材稀缺,黄精市场需求量日益增加[8-9]。而植物生长调节剂能打破种子休眠期,促进种子活性,提高种子发芽率等,植物生长调节剂具有较强的针对性,很少的量就能达到明显的效果[10-16]。目前植物生长调节剂应用于黄精繁殖的报道鲜少,所以本试验主要探讨植物生长调节剂对黄精萌发的促进作用,找出适合广东省惠州栽培黄精的最适浓度和浸种时间,以黄精根茎为组培材料,研究其组培过程中适合的培养基与合适的消毒方法。
1 材料与方法
1.1 试验材料、试验地点和时间
从广东省惠州市罗浮山基地采集黄精果实和黄精苗,果实去除果皮,将新鲜的种子清洗干净并在室内阴凉处晒干水分,黄精苗移栽至大棚。研究地点在广东省惠州市博罗石湾农业推广中心组培室及大棚,试验时间为2017年7月至2018年5月。
1.2 试验方法
1.2.1 種子处理试验
1.2.1.1 不同植物生长调节剂处理 选取颗粒饱满的黄精种子分别浸泡在50、100、150、200 mg/L的IAA(吲哚乙酸)、GA3(赤霉素)、6-BA(6-苄氨基嘌呤)溶液中,分别处理12、24 h,再用蒸馏水漂洗 5 min 后,将其均匀置于垫有2层充分吸湿滤纸的培养皿中,于25 ℃的培养箱和黑暗条件下进行发芽培养,每个处理50粒种子,3次重复。
1.2.1.2 对照组处理 清水浸泡种子12、24 h做对照试验,置于垫有2层充分吸湿滤纸的培养皿中,于25 ℃的培养箱中在黑暗条件下进行发芽培养,每个处理50粒,3次重复。
1.2.1.3 发芽数据统计 种子萌发试验在25 ℃的培养箱中在无光条件下进行,试验期间每天观察种子发芽情况,以60 d为种子发芽期限,30 d统计发芽势,60 d时所得数据为最终的发芽率,胚根突破种皮即可视为发芽。
发芽率=60 d时种子总发芽数/总体种子数×100%;
发芽势=30 d时种子总发芽数/总体种子数×100%。
1.2.2 黄精组培试验
1.2.2.1 不同消毒处理下的灭菌效果 切去健康黄精苗的叶片和根系,将黄精根茎中带有小芽的那部分切下,放入锥形瓶中。在流水条件下用牙刷将其带芽根茎上的杂质刷洗干净,后放入含有洗衣粉的水中浸泡10 min,再流水冲洗30 min。转移至超净工作台,并尽可能剃除其表面的黑斑。用75%乙醇溶液浸泡消毒15、30 s,接着用无菌水冲洗3次,每次3 min,再用0.1% HgCl2溶液深入灭菌10、15、20 min。在无菌水中不断晃洗3次,每次 3 min。将灭完菌的黄精根茎置于无菌培养皿中,再切去其与乙醇以及0.1% HgCl2接触的伤口和块茎上已坏死的组织,将其接种于MS培养基中,每瓶接种1个外植体,每个处理5瓶,重复3次,20 d后统计其污染率。
1.2.2.2 不同植物生长调节剂组合对黄精不定芽的诱导效果 将黄精外植体按照最佳效果进行灭菌处理后,将其移至5种不同诱导培养基中,每瓶 1~2个芽,每个处理10瓶,10个芽为1个重复,重复3次,进行诱导培养、观察,30 d后统计其诱导情况。
诱导率=诱导出的芽个数/接种的外植体数×100%。
1.2.2.3 不同植物生长调节剂对黄精不定芽增殖的影响 待诱导培养基中诱导出不定芽且不定芽的数量足够后,将含有分化出不定芽的块茎切去芽苗,并切成1 cm3左右的小块,接入不同激素组合的增殖培养基中,每瓶1~2个芽,每个处理10瓶,10个芽为一个重复,重复3次,30 d后统计增殖情况。
增殖系数=(萌发总芽数-接种时的芽数)/接种时的芽数。
1.2.2.4 组织培养培养基及培养条件 以MS培养基为基本培养基,加入25 g/L的蔗糖、7 g/L的卡拉胶,再根据试验的需求添加不同质量浓度的6-BA(6- 苄氨基嘌呤)、GA3(赤霉素)、NAA(萘乙酸)、IAA(吲哚乙酸)等激素,调节其pH值为5.8~6.0,配完后装入培养瓶中,灭菌,灭菌条件为 121 ℃、131 kPa、20 min。灭菌完后将其放置于冷凝室降温,当其温度为室温时可接种,材料接完后置于(温度保持在25 ℃左右)恒温培养室中培养,光照时间12 h/d,光照度2 100~2 500 lx。
2 结果与分析
2.1 不同质量浓度的GA3对黄精种子萌发的影响
从表1可以看出,浸种时间和GA3的质量浓度都对黄精种子的萌发有影响,并且浸种时间24 h的效果要优于12 h。随着GA3质量浓度的增加,黄精种子的发芽率和发芽势呈现出先升高后降低的趋势。GA3质量浓度为0~150 mg/L时,随着GA3质量浓度的增加,黄精种子的发芽率和发芽势也随之增大。当GA3质量浓度为150 mg/L且浸种时间为24 h时,黄精种子萌发的发芽率与发芽势最大,分别为90.00%、64.67%。超过150 mg/L后,GA3对其萌发的促进作用随质量浓度的增加而降低,但依旧高于CK组。总之,在0~200 mg/L之间,对比CK组,GA3对黄精的萌发具有明显的促进作用。
2.2 不同质量浓度的6-BA对黄精种子萌发的影响
由表2可知,6-BA对黄精种子的萌发也具有促进作用,并且不同质量浓度和不同的浸种时间对其萌发的影响都不同,总体上看,浸种时间24 h的效果要优于12 h。随着质量浓度的升高,黄精种子的发芽率和发芽势呈现一个先增加后减少的趋势。6-BA质量浓度为0~100 mg/L时,随着6-BA质量浓度的增加,黄精种子的发芽率和发芽势也随之增大。在6-BA的质量浓度达到100 mg/L、浸种时间为24 h时,黄精种子的发芽率和发芽势最大,分别为84.67%、60.67%。当质量浓度超过100 mg/L后,6-BA对其萌发的促进作用随质量浓度的增加而降低,但依旧高于CK组。
2.3 不同质量浓度的IAA对黄精种子萌发的影响
由表3可知,IAA对黄精种子的萌发也具备一定的促进作用,并且不同质量浓度和不同浸种时间对其萌发的影响都不同。随着质量浓度的升高,黄精种子的发芽率和发芽势呈现一个先增加后减少的趋势。IAA质量浓度为0~100 mg/L时,随着IAA质量浓度的增加,黄精种子的发芽率和发芽势也随之增大。在IAA质量浓度达到100 mg/L时,黄精种子的发芽率和发芽势最大,分别为80.67%、56.67%。当质量浓度超过100 mg/L后,IAA对其萌发的促进作用反而随质量浓度的增加而降低,并且在200 mg/L时,与对照组差异不大。IAA对黄精种子萌发的促进作用较明显。
2.4 不同消毒处理对黄精外植体的灭菌效果
由表4可知,0.1% HgCl2溶液浸泡时間越久,污染率越低,外植体的存活率也越高。0.1% HgCl2溶液浸泡时间为10 min、75%乙醇溶液为15 s时,污染率最高,为53.3%左右,而0.1% HgCl2溶液浸泡时间为10 min、75%乙醇溶液为30 s时,存活率最低,为33.3%左右。随着75%乙醇溶液时间的增加,存活率不具有明显增加的趋势。从表4的5组处理中,处理3的效果最佳,因此,选择其为最佳的消毒灭菌方式。
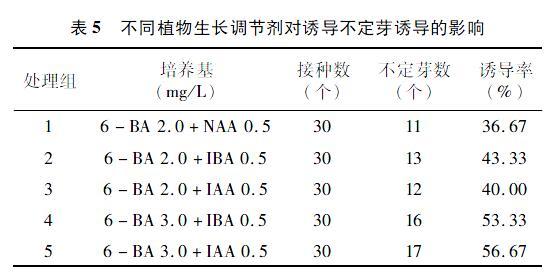
2.5 不同植物生长调节剂对诱导不定芽的影响
由表5可知,NAA、IBA、IBA这3种植物生长调节剂均可诱导芽的萌发,其中IAA和IBA的效果差异不大,出芽个数大致相同。在6-BA均为2 mg/L时,6-BA与IBA组合的诱导率和6-BA与IAA组合的诱导率高于6-BA与NAA组合的诱导率,所以IAA 0.5 mg/L和IBA 0.5 mg/L均适合黄精不定芽的诱导。随着6-BA质量浓度的增加,不定芽的个数明显增加,可看出3 mg/L的6-BA比2 mg/L的 6-BA在试验中诱导不定芽的个数更多,也就是在一定范围内,6-BA质量浓度的增加有利于黄精诱导出更多不定芽。因此,MS+3.0 mg/L 6-BA+0.5 mg/L IAA、MS+3.0 mg/L 6-BA+0.5 mg/L IBA均可作为黄精的诱导培养基。
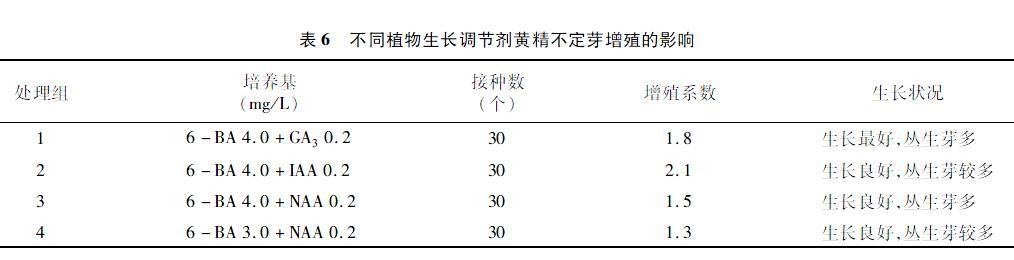
2.6 不同植物生长调节剂黄精不定芽增殖的影响
由表6可知,4种不同植物生长调节剂配比的培养基增殖产生的不定芽生长状况均不错,其中 4.0 mg/L 6-BA+0.2 mg/L GA3的培养基生长状况最好, 但其增殖系数在6-BA质量浓度相同的情况下不是最高,由此可看出GA3有利于不定芽的生长,对不定芽的分化增殖效果也不低,但并不是最佳培养基。对比前3个处理组,4.0 mg/L 6-BA+0.2 mg/L IAA培养基的效果最佳,而NAA的效果最差,因此,适宜的增殖培养基为MS+4.0 mg/L 6-BA+0.2 mg/L IAA。在6-BA质量浓度相同时,IAA的增殖系数最大,效果最好,IAA对黄精不定芽的增殖效果要优于GA3和NAA。从表现性状上看,高质量浓度的6-BA对黄精不定芽分化起着很重要的作用。
3 结论与讨论
