烟草赤星病菌AabHLH1基因的克隆及功能分析
2020-07-04杨然李珊珊毛胜洁刘琛常秦杜立家徐后娟
杨然 李珊珊 毛胜洁 刘琛 常秦 杜立家 徐后娟


摘要:碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)转录因子是真核生物中高度保守的一类转录因子,参与调控多种植物致病真菌的生长发育、外界胁迫应答反应和致病力等过程。本研究从烟草赤星病菌链格孢中克隆了一个bHLH1类型转录因子基因,命名为AabHLH1。该基因编码区全长1 650 bp,无内含子,编码蛋白含549个氨基酸。利用同源重组方法获得了该基因的插入突变体M1,M1菌落在PDA上呈浅褐色,边缘白色;气生菌丝较野生菌株(WT)稍弱,镜检可见部分菌丝弯曲明显,产孢量降低,且分生孢子萌发时间推迟,萌发率较WT降低56.12%;黑色素含量降低,毒素致病力明显降低,致病性明显减弱。由此可见,AabHLH1基因参与调控链格孢的生长、产孢和孢子萌发、黑色素和毒素产生以及致病性等过程。
关键词:烟草赤星病菌;碱性螺旋-环-螺旋;转录因子;产孢;致病性
中图分类号:S572.035.3:Q781 文献标识号:A 文章编号:1001-4942(2020)01-0024-07
Abstract Basic helix-loop-helix (bHLH) transcription factor is highly conservative in eukaryotes which regulated fungal growth and development, external stress responses, pathogenicity and other processes. In this study, a transcription factor gene of type bHLH1 was cloned from Alternaria alternata and named AabHLH1. It had a total length of 1 650 bp with no intron and encoded a protein with 549 amino acids. AabHLH1 insertion mutant was obtained by homologous recombination method and named M1. The colony of M1 was light brown with white edge, and the aerial hypha was slightly weaker than that of WT. Microscopic observation showed that the mycelia of M1 was sometimes curved. The spore yield of M1 reduced, and the spore germination time was delayed with the germination rate 56.12% lower of that of WT. The melanin content, toxin virulence and pathogenicity of M1 were also reduced significantly. It could be concluded that the AabHLH1 gene was involved in the regulation of colony growth, sporulation and germination, production of melanin and toxin, and pathogenicity.
Keywords Alternaria alternata; bHLH; Transcription factor; Sporulation; Pathogenicity
链格孢(Alternaria alternata)是一种在自然界中广泛分布的真菌,其寄主范围广,对环境和基质的适应性强,既是重要植物病原菌又是常见的腐生菌。其侵染烟草引起的赤星病是烟草生产上一种重要的叶部病害,条件适宜时可引起暴发性危害,导致烟叶品质下降,香气质差,香气量少,刺激性和杂气增加,已成为优质烟叶生产的一大障碍[1]。据报道,该病发生严重时对烟叶产量的损失可达到30%,而对产值损失率最高可以达到90%[2]。
碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)转录因子广泛存在于动物、植物和真菌中,是真核生物中高度保守的一类转录因子,该类转录因子结构域含有两个功能分化的区域——碱性区域(basic region)和螺旋-环-螺旋区域(helix-loop-helix,HLH)[3]。其中碱性区域位于N端,约10~15个氨基酸组成,对 DNA 结合起着重要作用[4];螺旋-环-螺旋区域由约40个氨基酸组成,其中环的长度在不同蛋白中不同[5]。在動物和植物中,已报道的bHLH转录因子多参与调控生长发育和细胞活性等过程[6,7]。在真菌中有关bHLH转录因子的研究,除了在稻瘟病菌[8]中有系统研究、曲霉属7个bHLH转录因子基因功能[9]被报道外,在其它植物致病真菌中的报道较少,截止到目前链格孢尚未见bHLH家族转录因子的研究报道。
链格孢共有12个bHLH类型转录因子,本研究从链格孢菌中克隆并鉴定了bHLH1的同源基因并命名为AabHLH1,利用同源重组方法获得了该基因的插入突变体,通过表型分析揭示了该基因与色素、菌丝形态、分生孢子产生、营养生长及致病性的调控关系,为阐明bHLH转录因子的功能提供了科学依据。
1 材料与方法
1.1 供试菌株、烟草品种和质粒
供试链格孢野生型菌株YS-16(Alternaria alternata YS-16),由本实验室从烟草赤星病病叶上分离,并通过分子生物学鉴定。
供试烟草品种为红花大金元,于山东农业大学温室培养。
本试验所用克隆载体pMD18-T购自宝日医生物技术(北京)有限公司,质粒pUCATPH和pCB1532由Dr. Baek(Yeungnam University)惠赠。
1.2 质粒、基因组DNA、RNA的提取及cDNA的合成
链格孢菌全基因组DNA的提取采用改良的CTAB法,参照张晓祥等[10]的方法。总RNA的提取使用Invitrogen公司的Trizol试剂盒,cDNA的合成利用Prime ScriptTMⅡ 1st Strand cDNA试剂盒(TaKaRa,中国)。质粒的提取参考生工生物工程(上海)股份有限公司的SanPrep柱式质粒DNA小量抽提试剂盒。
1.3 AabHLH1基因的克隆及序列分析
以真菌转录因子数据库中芸薹生链格孢的bHLH转录因子基因AB10294(http://ftfd.snu.ac.kr/tf.php?a=summary0_dv&ref_id=1257&spe_id=2780)为查询序列,在NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中查找链格孢的同源基因,并分别以YS-16的基因组DNA和cDNA为模板,进行PCR验证。所用引物由生工生物工程(上海)有限公司合成,引物序列见表1。结构域预测采用 Smart Server (http://smart.embl-heidelberg.de/)。
1.4 AabHLH1基因插入及回补
AabHLH1基因插入突变载体的构建参照Cho等[11]的线性最小元素法(linear minimum element,LME)。具体如下:以CF/CR为引物,以链格孢YS-16的基因组DNA为模板,PCR扩增316 bp片段;利用SacⅠ和KpnⅠ酶切该片段,连入同样酶切的pUCATPH,得到AabHLH1基因的插入突变载体pUCATPH-AabHLH。以M13F/M13R为引物,以测序正确的pUCATPH-AabHLH为模板,PCR扩增得2 815 bp片段用于链格孢的原生质体转化。
链格孢原生质体的制备、转化参照Xu等[12]的方法,转化子验证采用PCR和Southern结合策略。
Southern blot分析:分别提取野生菌株和插入突变菌株的DNA,经限制性内切酶BamHⅠ酶切后进行凝胶电泳,以来自于质粒pUCATPH的引物Hph1/Hph2扩增产物为探针,分别进行Southern blot分析。Southern blot具体步骤参照罗氏DIG High Prime DNA标记及杂交检测试剂盒Ⅱ说明书。
AabHLH1基因的回补利用CF/CR为引物,以YS-16的基因组DNA为模板,扩增AabHLH1基因编码区以及自身启动子区域片段(2 650 bp),酶切后该片段和带有氯嘧磺隆抗性的质粒pCB1532进行T4连接,得到回补载体pCB1532-AabHLH1,测序正确后转化到AabHLH1基因插入突变体的原生质体,利用200 μg/mL潮霉素B和5 μg/mL氯嘧磺隆进行初步筛选,并利用反转录PCR,以SF/SR为引物鉴定AabHLH1基因的表达。
1.5 AabHLH1基因插入突变体的生物学表型测定
1.5.1 菌落表型观察及生长测定 分别从链格孢野生菌YS-16(WT)、AabHLH1基因插入突变体(M1)及其回补菌株(C1)的菌落边缘取直径9 mm的菌丝块,接种到PDA和MM培养基上,置25℃光照培养箱内培养7 d,观察菌落形态并测量菌落直径。每个菌株设3个平行,试验重复3次。
1.5.2 菌丝及孢子形态观察 取25℃光照培养5 d的PDA和水琼脂培养基的平板,在各试验菌株菌落边缘挑取少量菌丝分别制作玻片,显微镜下观察菌丝及孢子的形态及孢子萌发情况。参照Gai等[13]的方法,计算各试验菌株在水琼脂培养基上的分生孢子产量。试验重复3次。
1.5.3 黑色素含量测定 分别刮取在25℃、PDA平板上生长10 d的各试验菌株菌丝0.25 g,参照杨一艳等[14]的方法,进行黑色素的提取和含量测定。菌丝中黑色素含量(y,mg/g)计算公式为:y=(x+0.0114)/0.0495,式中,x为459 nm处的吸光值。试验重复3次。
1.5.4 毒素致病力测定 毒素的制备和致病力测定参照郭永峰[15]的方法,采用幼苗浸根法进行毒素致病力测定,以灭菌蒸馏水处理为对照。试验重复3次。
1.5.5 致病性分析 采用离体叶片接种法进行不同菌株的致病性分析,分别在PDA上培养5 d的WT、M1和C1菌落边缘打取直径为9 mm菌碟,接種到清洗干净的红花大金元叶片上,28℃保湿光照培养,观察叶片发病情况。每个菌株做3个重复。
2 结果与分析
2.1 AabHLH1基因克隆及生物信息学分析
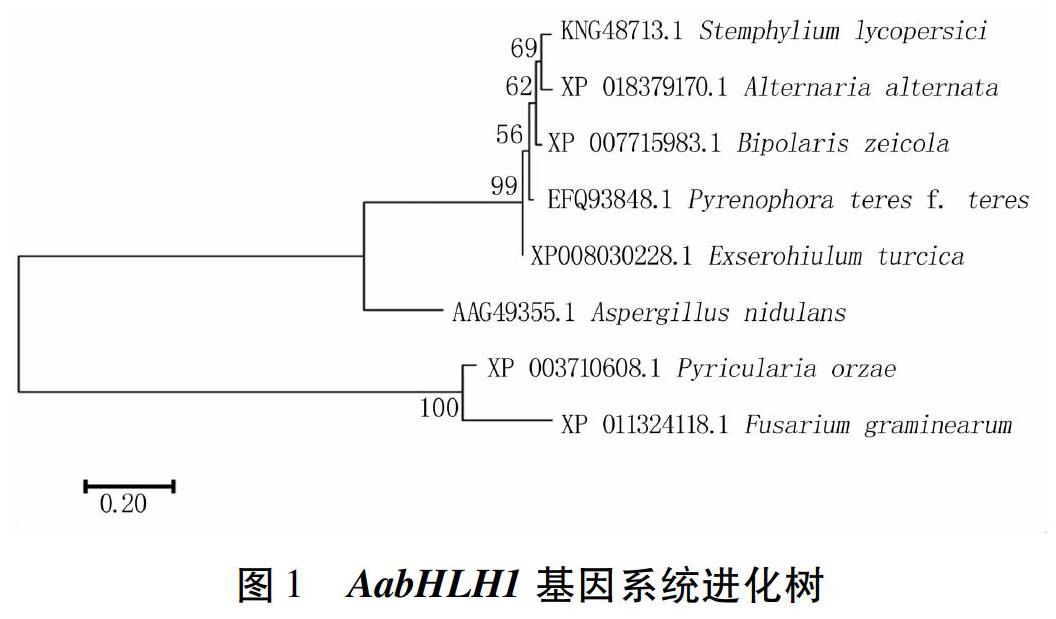
通过PCR扩增获得了AabHLH1基因的DNA和cDNA,测序结果显示AabHLH1基因全长1 650 bp,无内含子,编码一个含549个氨基酸的蛋白。系统进化树显示AabHLH1与番茄匍柄霉(Stemphylium lycopersici)相似度最高(图1)。
2.2 AabHLH1基因的敲除、鉴定及回补体的鉴定
AabHLH1基因突变载体pUCATPH- AabHLH1构建如图2所示,即用限制性内切酶SacⅠ和KpnⅠ将AabHLH1基因编码区316 bp片段进行双酶切(图2a),连入同样酶切的质粒pUCATPH,得到pUCATPH-AabHLH1(图2b)。
AabHLH1基因插入突变体的鉴定采用PCR和Southern blot相结合的方法进行,对4株转化子进行PCR验证,仅有1株(M1)可以扩增到目的条带,大小分别为884 bp和2 254 bp(图2c、图2d),测序分析这两个片段,证明同源重组发生。Southern blot结果(图2e)显示,M1的gDNA杂交后得到单一条带,而WT则没有,证明pUCATPH在转化子中成功插入,且是单拷贝。
对M1回补的验证采用RT-PCR方法,提取在潮霉素B和氯嘧磺隆双筛选标记上生长的菌株,利用来自于AabHLH1基因的SF/SR为引物进行RT-PCR,结果(图2f)表明成功扩增得到1 652 bp片段,测序正确,证明该基因成功表达。
2.3 菌落形态观察及生长速度测定
在PDA上,链格孢WT气生菌丝发达,菌落呈灰白色,而AabHLH1基因插入突变体M1气生菌丝稍弱,菌落中间为浅褐色,边缘白色;M1回补菌株C1基本恢复WT性状。在MM上,和WT及C1相比,M1菌丝较稀疏,但菌落形态与WT和C1无明显差异。生長速度分析显示,AabHLH1基因缺失影响到菌落的生长,在PDA和MM上,M1菌落直径比WT分别减少了15.21%和11.76%(图3)。
2.4 菌丝、产孢和孢子萌发观察
显微观察WT、M1和 C1的菌丝形态,结果如图4(A)所示。在PDA和水琼脂(WA)上, M1和WT类似,都出现了链格状菌丝,但M1中部分菌丝出现弯曲现象,在WA中菌丝弯曲数量增多,程度增加。
进一步比对WT、M1和 C1的产孢量以及孢子萌发速度,结果如图4(B)和表2所示。AabHLH1基因缺失影响到链格孢的产孢和孢子萌发过程,M1的孢子产量比WT和C1明显减少,分别减少了50.31%和50.47%,孢子萌发率分别降低了56.12%和56.57%(表2)。而且M1的孢子萌发晚,速度低,WT在处理后4 h时大部分孢子都已萌发,而M1则未见孢子萌发;处理后8 h,M1始见萌发孢子,随着处理时间延长至24 h,WT孢子萌发率达98%,而M1仅为43%。回补后萌发率回升,萌发缺陷消失,表明AabHLH1参与链格孢调控产孢及孢子萌发过程。
2.5 黑色素含量
分析了AabHLH1基因缺失对链格孢黑色素含量的影响,结果如表3所示。可以看出,突变体M1黑色素含量明显降低,为3.644 mg/g,比WT降低了26.80%。回补菌株黑色素含量为4.998 mg/g,与野生菌无明显差异。表明AabHLH1基因参与调控链格孢的黑色素合成。
2.6 毒素致病力
比较了AabHLH1基因插入突变体M1与WT、C1的毒素致病力差异,结果如图5所示。可以看出,毒素处理1 d后,WT毒素浸根的烟苗开始发病,所有叶片均出现发黄现象,心叶蜷缩;而M1处理的烟苗叶片开始发黄,心叶开始萎蔫但没有蜷缩;浸根2 d后,WT处理烟苗叶片蜷缩严重且全部变黄,根茎部发黑,而使用M1毒素浸根处理的烟苗仅出现叶片发黄现象,未见明显叶片蜷缩及根茎部发黑现象。C1毒素处理烟苗和WT类似。表明AabHLH1参与调控链格孢的毒素产生过程。
2.7 致病性分析
进一步比较了突变体M1与WT以及C1的致病性,结果如图6所示。可以看出,三个菌株接种的烟叶均发病,但发病程度差别较大。在WT和C1接种的叶片上,接种菌落在接种点继续扩大,气生菌丝在叶片扩展,病斑蔓延至整个叶片区域;而M1接种后病斑区域较小,叶片发黄。由此可见,AabHLH1基因参与调控链格孢的致病性。
3 讨论与结论
目前,关于真菌中bHLH转录因子的研究已有报道,但由于该类转录因子在不同真菌中数目不同,如在稻瘟菌中有9个bHLH转录因子[8],链格孢中则有12个;且同一真菌中bHLH转录因子序列同源性较低,导致已经报道的该类转录因子功能差异较大。如在粗糙脉孢霉(N. crassa)中,转录因子CHC-1参与了CO2介导的产孢负调控过程,另外还调控了碳代谢、鞘脂合成、细胞壁合成和钙信号传导相关基因的表达[16]。在构巢曲霉(A.nidulans)中,Stu A调控分生孢子梗的形态、有性生殖及应激反应;AnBH1可能为致死基因,DevR是产生分生孢子所必需的[17]。在米曲霉(A. oryzae)中,SclR促进菌核的形成,且其编码的蛋白质是维持米曲霉正常的菌株形态和细胞功能所必需的;EcdR与分生孢子梗早期分化有关,并且可以通过与SclR互作形成异二聚体影响彼此的功能[18]。本研究以链格孢bHLH转录因子家族的基因AabHLH1为对象,构建了AabHLH1基因的打靶载体,以PEG介导的原生质体转化的方法进行转化,成功筛选得到了AabHLH1基因插入突变体,并构建了回补体。与野生型链格孢相比,突变体菌落为浅褐色,气生菌丝稍弱,生长速度较慢;镜检发现部分菌丝出现弯曲现象,孢子产量下降,萌发率降低,萌发时间推迟;黑色素含量降低;致病力明显降低,推测AabHLH1突变体的产孢量显著下降及孢子萌发率降低在一定程度上影响了病菌的侵染过程,造成了致病力减弱。有关AabHLH1基因对致病性的具体调控机制还有待进一步研究。
参 考 文 献:
[1] 刘洋, 赵正雄. 对烟草赤星病防治的分析与思考[J]. 作物杂志, 2010(3): 87-90.
[2] 余清. 烟草赤星病对烟叶产量产值损失率估计研究[J]. 安徽农业科学, 2011, 39(6):3341-3344,3389.
[3] 耿晶晶. 甜橙bHLH家族转录因子发掘及CsbHLH18抗寒功能鉴定与作用机制解析[D]. 武汉:华中农业大学, 2018.
[4] 李欣, 李影, 曲子越, 等. bHLH转录因子在茉莉酸信号诱导植物次生产物合成中的作用及分子机制[J]. 植物生理学报, 2017, 53(1):4-11.
[5] 王勇, 陈克平, 姚勤. bHLH转录因子家族研究进展[J]. 遗传, 2008, 30(7): 821-830.
[6] 劉文文, 李文学. 植物bHLH转录因子研究进展[J]. 生物技术进展, 2013, 3(1): 7-11.
[7] 王勇,姚勤,陈克平. 动物bHLH转录因子家族成员及其功能[J].遗传, 2010, 32(4): 307-330.
[8] 曹慧娟. 稻瘟病菌和bHLH家族转录因子功能分析[D]. 杭州:浙江大学, 2015.
[9] 庄淼, 金锋杰. 曲霉属bHLH转录因子的研究进展[J]. 微生物学通报, 2018, 45(10): 2243-2253.
[10] 张晓祥,王玲,寿路路. 一种快速提取小麦基因组DNA的改良CTAB方法[J]. 中国农学通报, 2012, 28(36): 46-49.
[11] Cho Y, Davis J W, Kim K H, et al. A high throughput targeted gene disruption method for Alternaria brassicicola, functional genomics using linear minimal element (LME) constructs[J]. Molecular Plant-Microbe Interactions, 2006, 19(1):7-15.
[12] Xu H, Wang Y, Zhao P, et al. A cAMP-dependent protein kinase gene, aapk1, is required for mycelia growth, toxicity and pathogenicity of Alternaria alternata on tobacco[J]. Journal of Phytopathology, 2011, 159(4): 208-216.
[13] Gai Y, Liu B, Ma H, et al. The methionine biosynthesis regulator AaMetR contributes to oxidative stress tolerance and virulence in Alternaria alternata[J]. Microbiological Research, 2019, 219: 94-109.
[14] 杨一艳, 李明锐, 包龙丽, 等. 真菌菌丝黑色素提取条件的研究[J]. 安徽农业科学, 2012, 40(29): 14161-14162.
[15] 郭永峰. 烟草赤星病抗性鉴定的新方法——毒素抗性鉴定法[J]. 中国烟草,1995(3): 44-47.
[16] Sun X, Zhang H, Zhang Z, et al. Involvement of a helix-loop-helix transcription factor CHC-1 in CO2-mediated conidiation suppression in Neurospora crassa[J]. Fungal Genetics & Biology, 2011, 48(12): 1077-1086.
[17] Caruso M L, Litzka O, Martic G, et al. Novel basic-region helix-loop-helix transcription factor (AnBH1) of Aspergillus nidulans counteracts the CCAAT-binding complex AnCF in the promoter of a penicillin biosynthesis gene[J]. Journal of Molecular Biology, 2002, 323(3): 425-439.
[18] Jin F J, Nishida M, Hara S, et al. Identification and characterization of a putative basic helix-loop-helix transcription factor involved in the early stage of conidiophore development in Aspergillus oryzae[J]. Fungal Genetics & Biology, 2011, 48(12): 1108-1115.
