热活化介孔水生苔藓植物化石对水溶液中Cd(Ⅱ)的去除效应*
2020-07-01杨田丽UCHEOmeoga王文磊胡云楚
贺 任 杨田丽 吴 毅 谢 勇 刘 勇 UCHE Omeoga 王文磊,3# 胡云楚,3
(1.中南林业科技大学理学院,湖南 长沙 410004;2.中南林业科技大学林学院,湖南 长沙 410004;3.中南林业科技大学应用化学研究所,湖南 长沙 410004)
持续的工业活动,如电镀、采矿、工业冶炼、印染和生产镍镉电池等,将镉带入水体和土壤生态系统[1]。由于镉的生物累积性和不可生物降解性,水体和土壤生态系统中镉的原位固化和去除已成为一个环境热点问题。目前,水体中镉的处理方法主要包括膜处理法、化学沉淀法、离子交换法、反渗透法、生物处理法和吸附法[2]。吸附法被认为是去除Cd(Ⅱ)的最具有研究前景的方法之一[3]。探索无机天然矿物的环境属性并利用其环境自净化属性,挖掘其治理污染和修复环境的潜在功能日益成为当前研究的热点[4-5]。碳酸盐类矿物与生态环境具有良好协调性并能直接修复环境[6]。自然界中分布最广泛的方解石已被广泛应用于研究重金属离子的吸附。其他最新研究表明,蛇纹石、白云石也是有效的金属吸附剂[7-9]。

表1 CT(SD)和CT(SX)的化学组成及其质量分数
上水石是碳酸盐矿物的介孔水生苔藓植物化石,是由地质时期生活的地衣、苔藓等植物通过被岩石掩埋后长期石化形成。上水石外表面可观察到天然孔隙和管道结构。碳酸盐类矿物的通道结构和孔隙结构能最大程度地提高其比表面积和界面活性,从而用于污染控制和环境恢复[10-11]。CHEN等[12]介绍了对重金属离子具有高吸附性的功能化介孔材料,可增加材料的表面积,增强表面的活性基团。本研究采用热活化技术改性上水石,探讨热活化前后上水石的特征变化和吸附能力,同时考察了热活化后上水石对Cd(Ⅱ)的吸附动力学、吸附热力学及吸附机理。
1 材料与方法
1.1 热活化上水石的制备
上水石取自中国山东省和山西省,分别编号为CT(SD)和CT(SX)。通过在陶瓷研钵中研磨获得粒状上水石后,将其均匀铺在容积为30 mL的瓷坩埚中,再将坩埚放入马弗炉(YFX7/10Q-GC)中,以加热速率10℃/min从室温升至300、450、600、750 ℃,分别热活化2 h。当坩埚降至室温时,将其从马弗炉中取出,热活化后上水石分别编号为CT(SD)-T、CT(SX)-T(其中,T为热活化温度,℃)。
所有化学品和试剂均为分析纯。以CdCl2·2.5H2O配制Cd(Ⅱ)溶液。
1.2 热活化上水石的表征
X射线荧光光谱分析(XRF)仪(PANalytical-Axios,荷兰)检测上水石化学组成,结果如表1所示。
激光粒度分析(LPSA)仪(BT-9300ST)研究上水石的粒度分布情况。结果表明,CT(SD)的累计粒度分布达到10%、50%、90%时所对应的粒径(d10、d50、d90,μm)分别为2.30、21.98、78.62 μm,CT(SX)的d10、d50、d90分别为1.58、13.03、47.31 μm。
同步热分析仪(Netzsch STA449F5,德国)研究上水石的热分解,热重分析(TG)-示差扫描量热仪(DSC)图谱见图1。TG-DSC曲线中,750 ℃附近时出现明显的重量损失峰值,减重约20%,这是由于碳酸根在750 ℃时受热分解释放出CO2造成的。
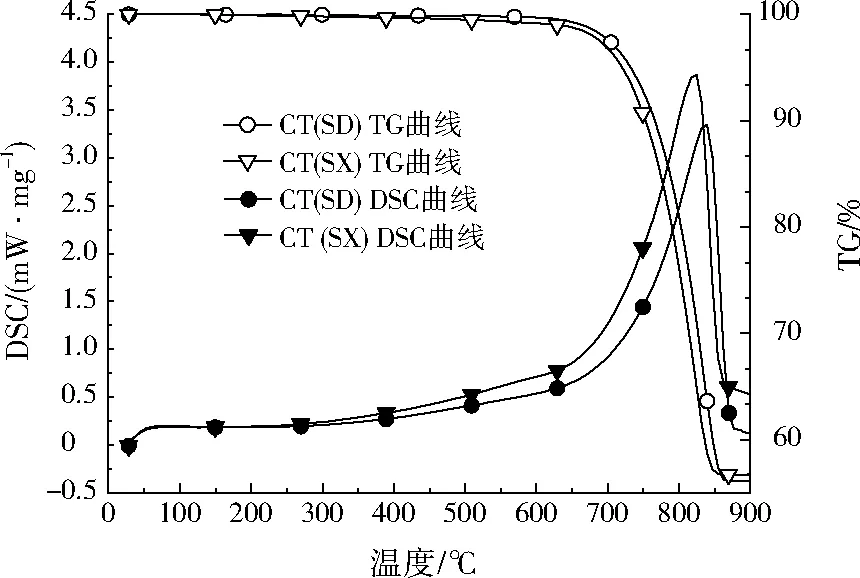
图1 CT(SX)和CT(SD)的TG-DSC图谱Fig.1 TG-DSC profiles of CT(SX) and CT(SD)
全自动多站比表面、微孔和介孔孔隙分析仪(BelSorp-Max,日本)对CT(SD)和CT(SX)的表面积和孔径分布进行测定,测定条件是在-196 ℃下通过N2静态吸附法来测量,结果如表2所示。CT(SX)具有较高的BET比表面积(556.6 m2/kg)和大孔径(20.09 nm)。
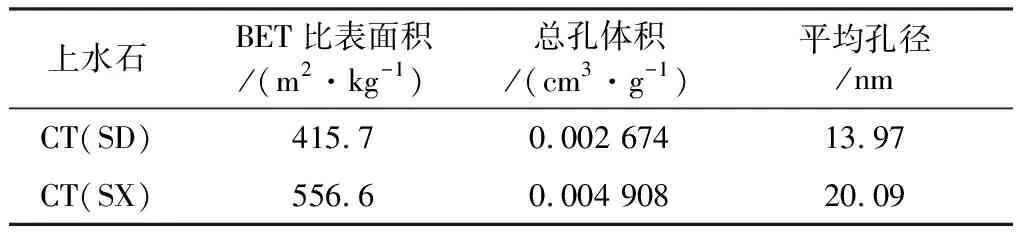
表2 CT(SD)和CT(SX)的比表面积、总孔体积及平均孔径
X射线粉末衍射(XRD)仪(Bruker D8 Advance,德国) 分析上水石的物相组成。场发射扫描电子显微镜(SEM)(Ultra 55,德国)分析实验中使用样品的形态。X射线光电子能谱(XPS)仪(Axis Ultra,英国)分析,用Al靶Kα射线做单色化处理,在25 ℃下的高真空环境中使用。
1.3 吸附实验
Cd(Ⅱ)吸附动力学实验是在25 ℃下用50 mL 150 mg/L Cd(Ⅱ)溶液,在250 mL锥形瓶中称取0.2 g吸附剂进行。实验在恒温磁力搅拌器(Lauda E219,德国)中进行。将反应溶液的pH保持在6.0,且以转速150 r/min进行吸附实验。通过原子吸收光谱仪(Thermo Solaarm6,美国)测量样品的Cd(Ⅱ)浓度[13]。吸附量(qt,mg/g)的计算公式为:
(1)
式中:C0和Ct分别为溶液中Cd(Ⅱ)的初始和平衡质量浓度,mg/L;V为溶液体积,L;m为吸附剂质量,g。
为探究Cd(Ⅱ)初始浓度和热活化温度的影响,通过批量的吸附平衡实验研究热活化前后Cd(Ⅱ)在上水石上的吸附等温线。先分别移取50、100、150、200 mg/L Cd(Ⅱ)溶液150 mL,再取0.2 g吸附剂加入到Cd(Ⅱ)溶液中,调节pH至6.0。然后将吸附样品置于恒温磁力搅拌器下吸附12 h,并在吸附实验后对溶液进行pH的检测,结果仍为6.0。另外,对上水石的XRF和XRD检测表征可看出,上水石中以CaCO3、SiO2等难溶性盐或氧化物为主要成分。对吸附后溶液进行了电感耦合等离子体(ICP)仪(5300DV Perkin-Elmer,美国)分析。结果显示,除镉外,其他元素含量非常低。因此,样品在水相体系中吸附Cd(Ⅱ)过程中,上水石本身的镉离子释放非常低,对实验的影响可忽略不计。
2 结果与分析
2.1 热活化温度对上水石的结构表征
2.1.1 XRD分析
由图2(a)可见,CT(SD)属于方解石(粉末衍射标准谱图文件(PDF) 81-2027#),其衍射峰与(012)、(104)、(006)、(110)、(113)、(202)、(018)、(024)、(112)、(119)和(300)面有关。由图2(b)可见,CT(SX)属于白云石(PDF 89-1304#),XRF的结果进一步证实了这一点,即CT(SX)中CaO含量高于CT(SD)(见表1)。与CT(SD)相比,它具有结晶良好的结构,且与CT(SD)有大体一致的衍射峰。热活化前后样品的衍射峰无明显差别,这表明,热活化没有改变样品的物相组成。
2.1.2 SEM分析
随热活化温度的升高,上水石表面结构发生了明显变化。天然的上水石具有良好的孔隙和较大的比表面积,其表面伴有许多介孔;CT(SD)-750和CT(SX)-750的表面完全是一种塌陷的、不平整的结构,形成界面缺陷,趋于形成颗粒化结构(见图3),这样能提供更多的吸附活性位点来有效提高其吸附能力。
2.2 吸附实验结果
2.2.1 吸附动力学
由图4可见,0~120 min,吸附量迅速增加;120
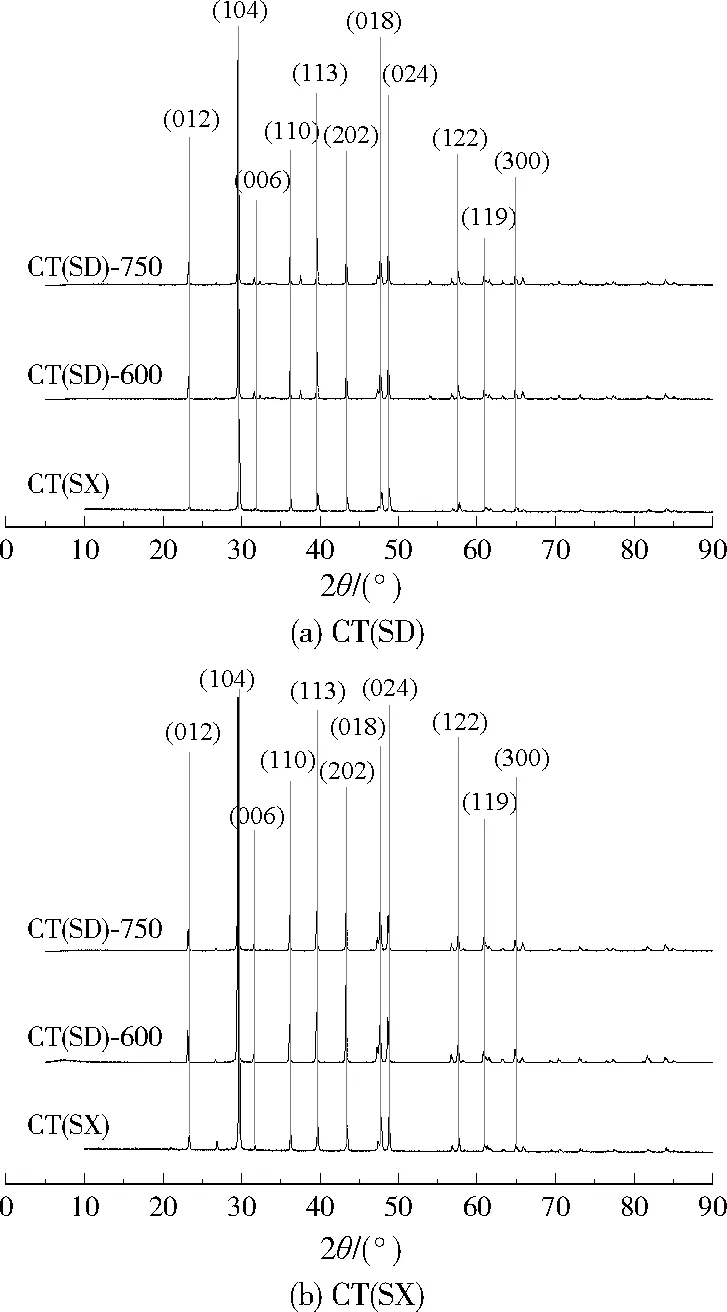
图2 热活化前后CT(SD)和CT(SX)的XRD图谱Fig.2 XRD patterns of CT(SD) and CT(SX) before and after thermal activity

图3 CT(SD)-750和CT(SX)-750的SEM照片Fig.3 SEM images of CT(SD)-750 and CT(SX)-750
min后,时间延长对Cd(Ⅱ)的吸附量没有明显的改变,说明达到动态吸附平衡。720 min时,Cd(Ⅱ)在CT(SD)、CT(SD)-750、CT(SX)和CT(SX)-750上的吸附量为最大吸附量,分别达到11.30、37.20、7.80、24.65 mg/g。
采用准一级动力学模型(见式(2))、准二级动力学模型(见式(3))和韦伯-莫里斯动力学模型(见式(4))对热活化前后上水石吸附Cd(Ⅱ)进行动力学拟合,拟合后参数见表3。上水石对Cd(Ⅱ)的吸附动力学特征更符合准二级动力学模型,CT(SD)、CT(SD)-750、CT(SX)和CT(SX)-750吸附Cd(Ⅱ)的R2分别为0.998 8、0.997 8、0.993 0、0.960 4,这表明上水石吸附Cd(Ⅱ)是化学吸附,而不是扩散、离子交换或颗粒内扩散,这也可能是Cd(Ⅱ)吸附的限速步骤[14]。同时,用准二级动力学模型预测的平衡吸附量计算值与实验值具有较高的一致性,这表明在固/液界面存在较强的由电子交换产生的化学力。
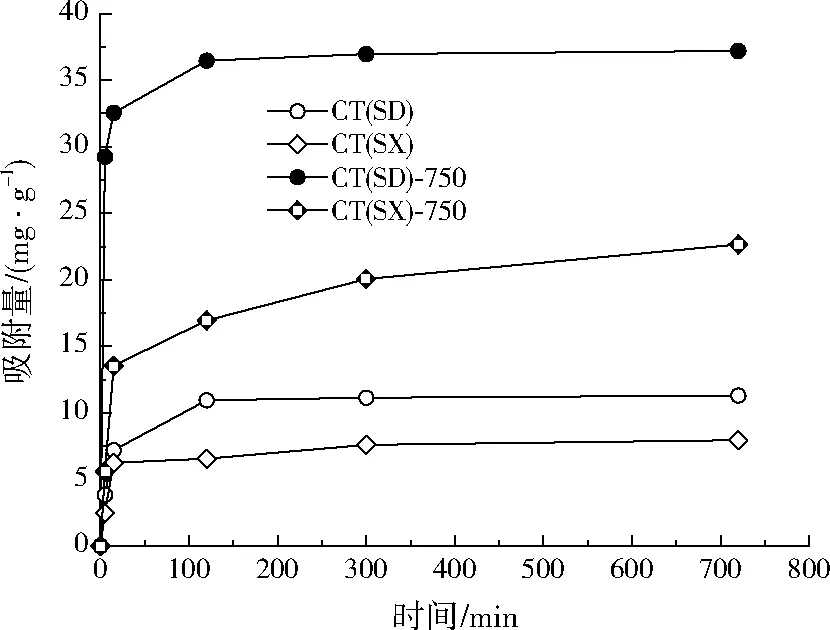
图4 热活化前后上水石对Cd(Ⅱ)吸附动力学影响Fig.4 Kinetic models of Cd(Ⅱ) adsorption onto different calcareous tufa samples
qt=qe(1-e-k1t)
(2)
(3)
qt=Kidt0.5+C
(4)
式中:qe为平衡吸附量,mg/g;k1为准一级方程的速率常数,min-1;t为时间,min;k2为准二级方程的速率常数,g/(mg·min);Kid为粒子内扩散速率常数,mg/(g·min0.5);C为截距。
2.2.2 吸附热力学
采用Langmuir模型(见式(5))和Freundlich模型(见式(6))对热活化前后上水石吸附Cd(Ⅱ)进行热力学拟合,拟合后参数见表4。Langmuir模型假定在具有相同结合位点的吸附剂表面上形成单层吸附质;Freundlich模型预测多层吸附在非均相吸附质表面上。Langmuir模型拟合结果说明,上水石经750 ℃热活化后,吸附量显著提高。Langmuir模型能更好拟合上水石对Cd(Ⅱ)的吸附。这可能更多地归因于上水石表面活性位点的均匀分布、吸附后上水石表面存在Cd(Ⅱ)的单层覆盖[15]。
(5)

(6)
式中:Ce为平衡质量浓度,mg/L;qmax为最大吸附量,mg/g;KL为与吸附能有关的Langmuir常数,L/mg;KF为与吸附量有关的Freundlich参数,mg1-1/n·L1/n/g;n为与吸附强度有关的Freundlich参数。
2.3 吸附机理


图5 CT(SD)和CT(SX)在吸附Cd(Ⅱ)前后的XRD图谱Fig.5 XRD patterns for CT(SD) and CT(SX) at before and after Cd(Ⅱ) adsorption
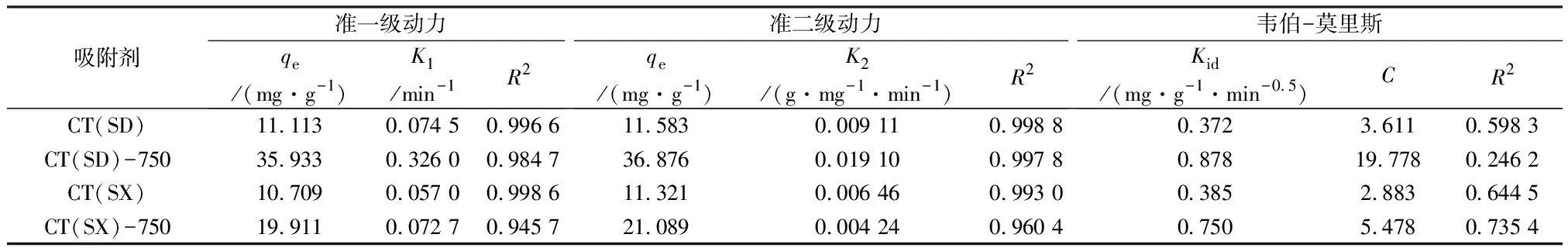
表3 吸附动力学参数

表4 吸附热力学参数
为进一步研究吸附后上水石的表面性质和吸附机理,进行了XPS分析。Cd(Ⅱ)吸附后CT(SD)-750和CT(SX)-750的XPS图谱中Cd3d分图谱见图6。吸附后CT(SD)-750和CT(SX)-750表面均检测到两个峰为CdO(404.4 eV)和Cd(OH)2(405.0 eV),相对应是CdCO3和Cd(OH)2[17]。CdO对应的峰面积高于Cd(OH)2,表明热活化后上水石表面CdO含量大于Cd(OH)2。因而可说明,在Cd(Ⅱ)吸附后,镉离子主要以CdCO3沉淀的方式存在于样品中,还有少部分的Cd(OH)2沉淀。结合XRD结果说明,热活化后上水石对Cd(Ⅱ)的吸附机理可归因于形成了CdCO3、Cd(OH)2和(Ca,Cd)CO3的表面沉淀。
CT(SD)和CT(SX)分别是以方解石和白云石为主要成分的介孔天然矿物。根据朱德强等[18]的研究,通过在土壤中添加方解石,可将土壤中的镉的存在形式由高活性状态的离子形式转化为迁移性较差的碳酸盐等其他结合态,并且在实验过程中方解石的添加不改变土壤的pH。这与本研究上水石对水体中Cd(Ⅱ)的吸附研究是一致的,因此将上水石应用于对土壤中镉的吸附及固化研究有着较好的应用前景。但其是否能在各类土壤中进行使用,如稻田,还要考虑其在根际、土壤及水体之间的迁移与转化过程,则需要进行进一步的探讨。
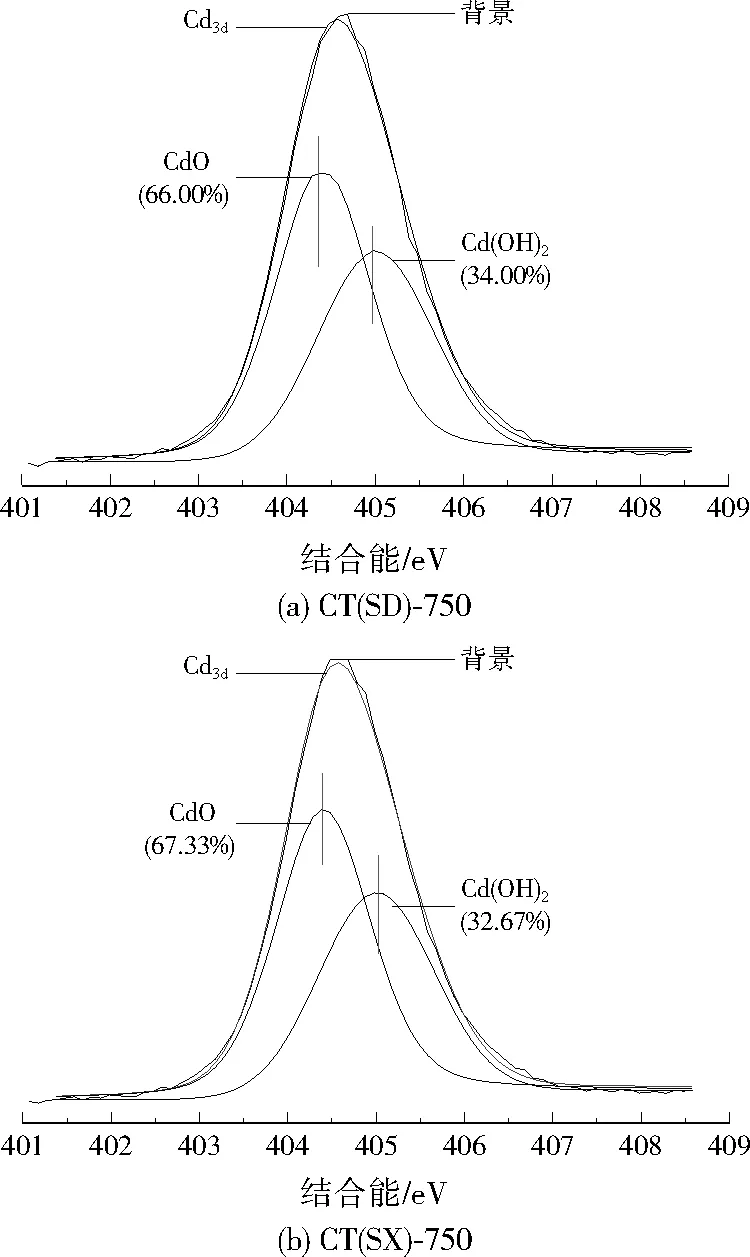
图6 Cd(Ⅱ)吸附后CT(SD)-750和CT(SX)-750的XPS图谱中Cd3d分图谱Fig.6 Cd3d spectra of CT(SD)-750 and CT(SX)-750 after adsorption of Cd(Ⅱ) in the XPS spectrum
3 结 论
(1) CT(SD)、CT(SX)的BET比表面积分别为415.7、556.6 m2/kg,平均孔径分别为13.97、20.09 nm。XRD显示,CT(SD)属于方解石,CT(SX)属于白云石,XRF的结果进一步支持了这个结论。SEM显示,热活化后上水石表面形成塌陷和不平整的结构。
(2) 上水石经750 ℃热活化后,吸附量显著提高。其中,CT(SD)-750和CT(SX)-750的最大吸附量分别为37.20、24.65 mg/g。上水石对Cd(Ⅱ)的吸附更符合准二级动力学模型,表明吸附速率由化学吸附控制。Langmuir模型能更好拟合上水石对Cd(Ⅱ)的吸附,反映了该吸附过程是单层吸附。
(3) XRD和XPS分析证明,Cd(Ⅱ)吸附后上水石表面生成了CdCO3和Cd(OH)2。热活化后上水石对Cd(Ⅱ)的吸附机理可归因于形成了CdCO3、Cd(OH)2和(Ca,Cd)CO3的表面沉淀。
