His-prescission蛋白酶基因在大肠杆菌中表达条件的优化
2020-07-01蔡莉王甫群
蔡莉,王甫群
(1.江阴职业技术学院环境与材料工程系,江苏江阴214405;2.无锡佰翱得生物科学有限公司,江苏江阴214431)
His-prescssion 蛋白酶是一种带有便于分离纯化的His 标签的蛋白酶,其上的His 标签将会在最后纯化分离中除去,留下的就是PreScission 蛋白酶。PreScission蛋白酶是一种遗传改造的融合蛋白,由人鼻病毒3C 蛋白酶(HCV3C)和GST 组成[1]。这种蛋白酶是专为蛋白酶的去除而设计,能同时实现蛋白酶的固定和pGEX-6P 载体(pGEX-6P-1、pGEX-6P-2 和 pGEX-6P-3)所产生的GST 融合蛋白的切割[2]。PreScission 蛋白酶能特异切割Glu和Gly残基之间的识别序列Leu-Glu-Val-Leu-Phe-Gln-Gly-Pro,在4℃左右酶活最高,所以酶切在4℃左右时进行,既可以保持目的蛋白的稳定性,又能达到最佳酶切效果。在5℃,50 mM Tris-HCl、150 mM NaCl、1 mM EDTA、1 mM DTT(pH 7.0)的反应体系中,一个单位酶 16 h 可切割 100 μg 待测 GST 标签蛋白,切割效率在90%以上[3]。
PreScission 蛋白酶作为在蛋白分离纯化过程中应用在亲和纯化时的酶切用酶,在生物医药领域具有很高的应用价值,其应用广泛,具有很高的生物科研价值和经济价值,如上海七海复泰生物科技有限公司生产的PreScission Protease100U 市场售价为750 元,进口的则更加昂贵。随着现代生物科技的不断发展与壮大,Pre⁃Scission 蛋白酶的应用范围与应用价值也会提高,其经济价值不可小觑。
1 材料与方法
1.1菌种
大肠杆菌感受态细胞,BL21(DE3)-T1R,北京天根生化科技有限公司;Rosetta2(DE3)、Origami2(DE3),上海拜力生物科技有限公司。
1.2 试剂及仪器
核酸蛋白测定仪,赛默飞世尔科技公司;双稳定电泳仪,北京六一仪器厂;干浴微量恒温器、脱色摇床,其林贝尔仪器制造有限公司;紫外分光光度计,上海优尼柯有限公司;双层试管摇床,上海智城分析仪器制造有限公司;生物洁净工作台,苏州安泰空气技术有限公司。
1.3质粒的提取及菌种的转化
①含His-prescisssion 基因的质粒的菌种复壮;②含His-prescisssion 基因的质粒的提取;③大肠杆菌菌种的转化。
1.4 His-prescission蛋白酶的表达及流程
(1)His-prescission蛋白酶的表达
本蛋白来源为大肠杆菌,属于初级代谢产物,大肠杆菌与本蛋白酶的生产关系为生产产物偶联型。该目的蛋白在表达过程中,在不加诱导剂前,可少量表达或不表达,加入适量的诱导剂后可大量表达。在37℃诱导表达时,可形成大量包涵体,在分离纯化过程可经复性加工使其恢复生物活性。
(2)His-prescission酶的表达流程(图1)
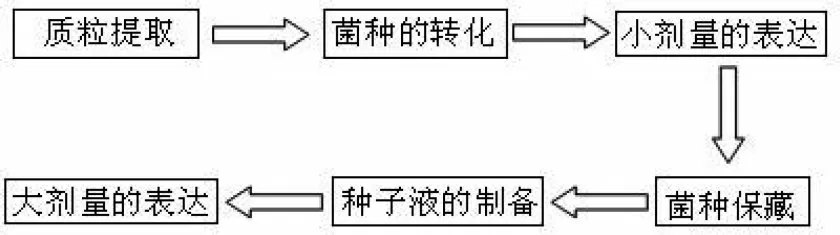
图1 His-prescission酶的表达流程图
1.5 分析方法
生物量的测定:取1 mL 发酵培养液至比色皿中,用紫外可见分光光度计于600 nm(OD600 nm)处测定吸光值。
发酵液中目的蛋白的测定:取1 mL 发酵培养液至比色皿中,用紫外可见分光光度计于600 nm(OD600 nm)处测定吸光值。根据经验公式:取样量=0.5/吸光值。将取好的样按SDS-PAGE 电泳的操作步骤完成蛋白样的制备及SDS-PAGE 电泳,看聚丙烯酰胺凝胶电泳图,根据目的蛋白条带的颜色深浅和条带的面积大小,判断目的蛋白的表达结果。
2 实验结果
(1)小剂量表达
在本试验中,分别选取BL21(DE3)-TIR、Rosetta2(DE3)、Origami2(DE3)三种感受态细胞作为重组基因His-prescission 的宿主菌,探讨重组基因在这3 种感受态的表达效果。

图2 转化BL21(DE3)和Rosetta2(DE3)、Origami2(DE3)蛋白表达结果
实验结果分析:His-prescission 蛋白酶的条带位置在 17.5 kDa 处,由图 2 转化 BL21(DE3)和 Rosetta2(DE3)、Origami2(DE3)蛋白表达结果可看出,以BL21(DE3)-T1R作为宿主菌,目的蛋白表达量最大,所以感受态BL21(DE3)-T1R 为表达His-prescission 蛋白酶的最佳宿主菌。感受态细胞Rosetta2(DE3)表达His-prescission 蛋白酶的表达量次之。感受态细胞Origami2(DE3)表达Hisprescission蛋白酶最少。
(2)大剂量表达
在9 个3 L 的大摇瓶上写好标签,每个摇瓶内加入600 μL 的 Kana 抗生素,将 20 mL 菌种加到 1 200 mL LB液体培养基内,使用橡皮筋扎紧封口膜,分别放入三个摇床培养,待生物量长至相应的诱导时机时,加入IPTG 诱导培养。培养结束后取200 μL的菌液稀释5倍后在600 nm下测OD值,取样跑SDS-PAGE[4-6]。
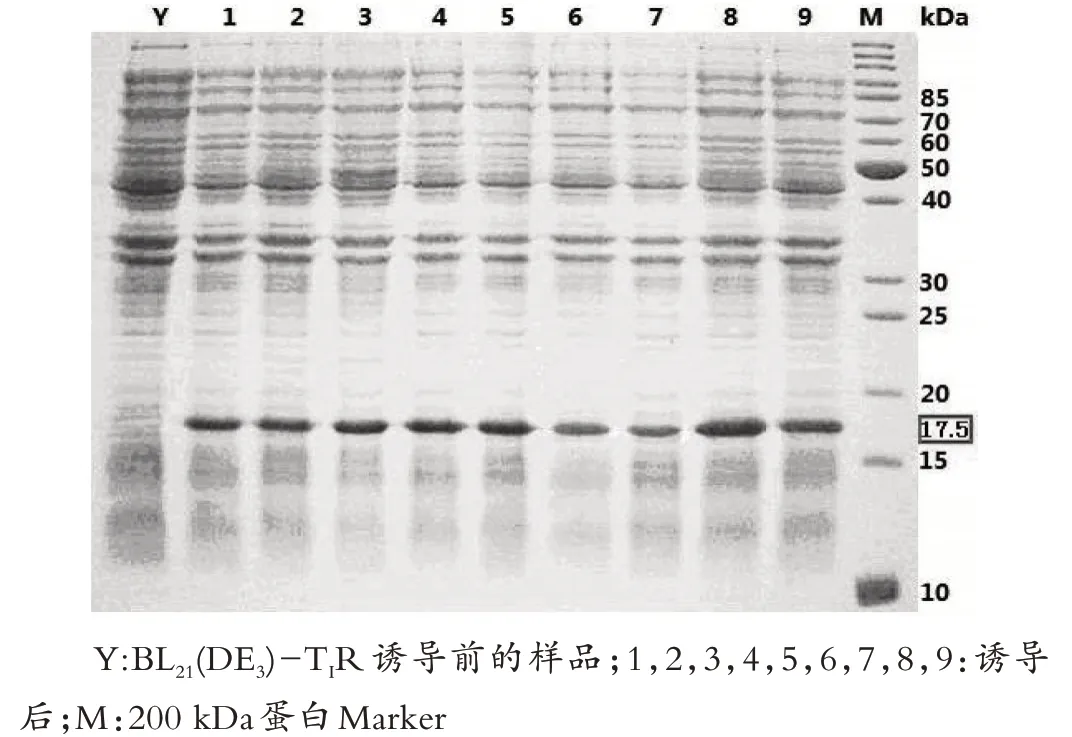
图3 正交试验蛋白表达结果
由实验结果分析表1,得出结论:
(1)当培养条件为摇瓶装液量为1 200 mL,接种量为20 mL,培养温度为37℃,摇床转速为130 rpm,诱导时机为1.0时加入IPTG 0.1 mM,诱导培养6 h后,培养基中菌体浓度最高。
(2)当培养条件为摇瓶装液量为1 200 mL,接种量为20 mL,培养温度为37℃,摇床转速为130 rpm,诱导时机为0.7时加入IPTG 0.1 mM,诱导培养6 h后,单位菌体内蛋白表达量最高。
(3)由此可以看到以两种结果分析得到诱导时机不同,所以将上述正交实验的生物量和蛋白表达量作了对比,如图4所示。
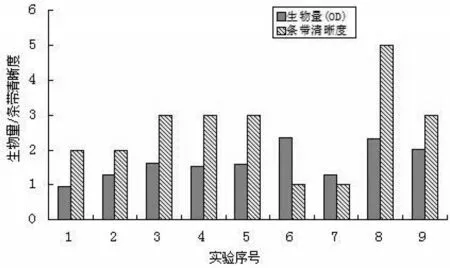
图4 正交实验的生物量和蛋白表达量对比
由图3、图4 可见,8 号的生物量和蛋白表达量都很高,8 号的培养条件是:摇瓶装液量为1 200 mL,接种量为20 mL,培养温度为37℃,摇床转速为130 rpm,诱导时机为0.7 时加入IPTG 0.1 mM,诱导表达6 h。故而表达His-prescission 蛋白酶在大肠杆菌中诱导表达的最佳诱导时机为0.7。
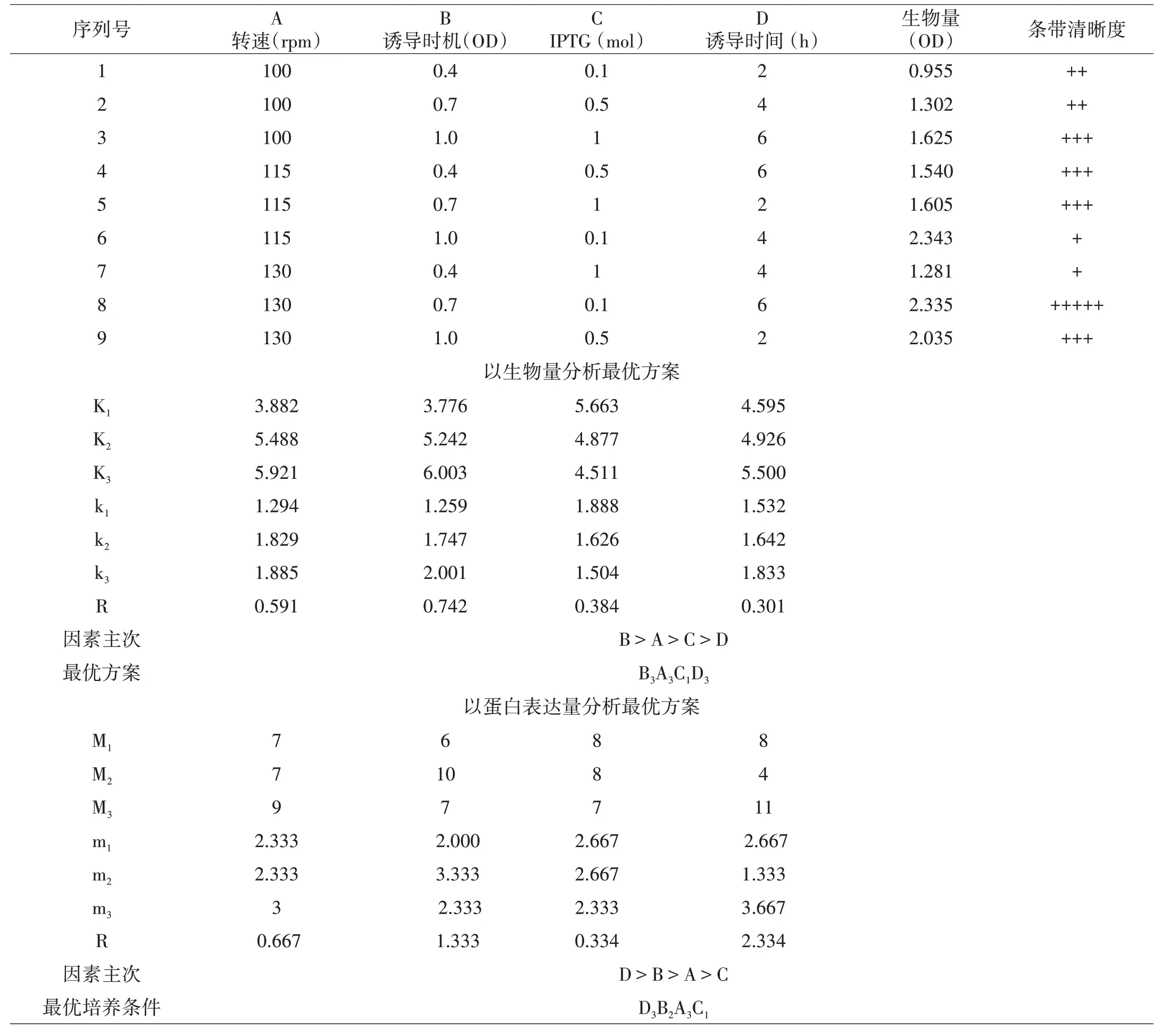
表1 正交实验结果分析表
3 总结
本文利用质粒提取试剂盒将含有His-prescission基因的质粒从宿主菌BL21(DE3)中提取出来,再分别转化到大肠杆菌感受态细胞BL21(DE3)-T1R、Rosetta2(DE3)、Origami2(DE3),以感受态细胞作为变量,试管装液量、摇床转速、培养温度、接种量、IPTG 加入量作为固定量,通过单因素实验得出大肠杆菌感受态细胞BL21(DE3)-T1R 为最佳宿主菌。然后采用正交实验,进一步探讨His-prescission 蛋白酶在大肠杆菌BL21(DE3)-T1R 中的最佳表达条件。在正交试验中,以摇床转速代替溶氧量,以IPTG 作为诱导剂,选择合适的诱导时机加入适量的诱导剂,诱导培养一段时间后检测其生物量和蛋白表达效果。以大剂量表达的方式,通过正交实验优化His-prescission蛋白酶在大肠杆菌中的最佳表达条件,最佳发酵工艺参数:培养基初始pH 7.0,摇床转速130 rpm,摇瓶装液量1 200 mL,接种量20 mL,培养温度37℃,OD 值达到0.7时,IPTG 0.1 mM/mL,诱导表达时间6 h。
