医用钛板表面涂层2-MPC对细菌生物膜形成的影响
2020-06-25李舟杨明坤何坤林王靖刘泯邑柯明池王业华
李舟,杨明坤,何坤林,王靖,刘泯邑,柯明池,王业华
(1.通江新区医院骨科,四川 巴中 636057;2.徐州医科大学附属医院骨科,江苏 徐州 221000)
随着现代医学的发展,内固定在临床使用越来越广泛,感染是骨科内固定术后较为严重的并发症之一[1]。它不仅影响骨折的愈合及患者术后的功能康复,难以治愈,并且极易形成慢性骨髓炎或感染性骨不连,甚至面临截肢的危险[2]。近年来,针对内固定感染的原因进行了诸多研究,发现细菌生物膜形成是内固定术后感染难以控制和反复发作的主要原因[3],如何预防内固定上细菌生物膜形成是研究的重点。2-甲基丙烯酰氧乙基磷酸胆碱(2-methacryloyloxyethyl phosphorylcholine,2-MPC)是近年来发现的一种新型材料,它是一种仿细胞膜结构的物质,具有较好的组织相容性且能抑制血小板、蛋白质、细菌等物质的黏附作用[4]。既往日本学者制作了含有和不含有2-MPC聚合物的涂层钢板与细菌共同培养,在培养过程中一半的标本接受了抗生素,结果在没有涂层的样品表面有细菌生物膜形成,而有涂层的样品表面未观察到生物膜的形成[5]。但是将2-MPC材料用于骨科钛合金内固定上预防细菌生物膜形成的效果尚未见报道。本研究拟通过化学接枝法将2-MPC涂层于医用钛板表面[6],探讨其对金黄色葡萄球菌细菌生物膜形成的影响。
1 材料与方法
1.1 主要实验材料及菌株生长条件
1.1.1 主要实验材料 采用医用钛板(Ti-6Al-4V,尺寸:10 mm×10 mm×2 mm,创生医疗器械有限公司);金黄色葡萄球菌ATCC25923(中国药品生物制品检定所);2-MPC(南京乐天然生物科技有限公司)。
1.1.2 菌株生长条件 将金黄色葡萄球菌标准菌株(ATCC25923)在有氧条件下置入胰蛋白胨大豆肉汤溶液中震荡过夜(130 r/min,37℃)培养24 h。取增菌液划线接种Baird-Parker平板37℃培养48 h、显色平板37℃培养24 h、血平板37℃培养24h。可疑菌落在Baird-Parker平板上菌落直径2~3 mm,颜色呈灰色到黑色,边缘为淡色,周围为一混浊带,在其外层有一透明圈。金黄色葡萄球菌的鉴定:(1)染色镜检,金黄色葡萄球菌为革兰氏染色阳性球菌,排列呈葡萄球状,无芽孢、无荚膜。(2)血浆凝固酶试验:挑取各平板上可疑菌落1个,分别接种到0.5 mL脑心浸液肉汤37℃培养24 h,取培养物0.3 mL接种到灭菌生理盐水溶解的冻干兔血浆瓶中,37℃培养,观察6 h,呈凝固体积大于原体积的一半被判为阳性结果。将经过检验的金黄色葡萄球菌挑取单个新鲜菌落,通过比浊仪将菌液调至最终菌液浓度1.5×106cfu/mL,备用。
1.2 实验方法
1.2.1 医用钛板表面2-MPC涂层的制备 将清洗干净的医用钛板浸入10 mmol/L KH550的甲苯溶液中3 h,使KH550吸附医用钛板表面,经甲苯和乙醇依次清洗,用氮气吹干后在110℃下固化1 h,将表面氨基化。表面氨基化后钛板浸入浓度为10 mg/mL的2-MPC乙醇溶液中,使表面产生的氨基与2-MPC的双键之间发生Michael加成反应(见图1)[7]。室温保持反应24h后,在无水乙醇中超声清洗3次,用氮气吹干后在40℃真空干燥24 h。2-MPC涂层钛板制备成功后高压蒸汽消毒后备用。
1.2.2 建立细菌生物膜模型 参考传统Brown平板法[8]将实验组(涂层2-MPC钛板)及对照组(单纯钛板)钛板各40块分别依序放入无菌6孔培养板中,1块/孔。沿培养孔侧壁缓慢加入已制备的金黄色葡萄球菌悬液,5 mL/孔,使钛板完全浸泡于金黄色葡萄球菌悬液中,并置于37℃恒温培养箱中连续培养。

图1 KH550吸附于钛板表面后与2-MPC发生Michael加成反应示意图[7]
1.2.3 噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)比色法测定细菌生物膜内活菌数 依据文献建立金葡菌(ATCC25923)菌液浓度与MTT法吸光度(A570)的标准曲线,得出曲线方程Y=-4.961×107+4.656 8×108X(R2=0.000)[9]。于体外培养24 h、48 h时分别于六孔板中移出两组钛板各10块,用无菌生理盐水冲洗去除表层浮游菌,置入无菌玻璃试管并加入2 mL的胰蛋白胨大豆肉汤溶液中,弱超声(f:50 Hz)处理7 min,37℃恒温培养24 h,每孔再加入5 mg/mL的MTT 10 μL,充分混匀,37℃恒温箱中反应4 h,每孔再加入100 μL二甲基亚砜,室温震荡混匀后在酶标仪上,OD570处读取酶标值,依标准曲线换算成活菌数。
1.2.4 扫描电镜观察 于体外培养24 h、48 h时分别于六孔板中移出实验组、对照组钛板各10块,用无菌生理盐水冲洗去除表层浮游菌,然后于质量浓度为2.5%的戊二醛溶液中固定,无水乙醇梯度脱水后,离子溅射仪喷金,应用扫描电镜观察单个视野下的细菌计数(放大5 000倍下观察),同时观察48 h时细菌生物膜形成情况(放大20 000倍视野)。

2 结 果
2.1 钛板表面形貌的扫描电镜观察 扫描电镜所采集图像显示单纯医用钛板表面纹理清晰,凹凸不平(见图2a),涂层2-MPC医用钛板表面平整光滑,钛板原有纹理消失(见图2b)。
2.2 钛板表面活菌计数 由标准曲线方程换算所得膜内活菌数,实验组24 h膜内活菌数为(1.49±0.91)×107cfu/mL,48h膜内活菌数为(5.60±1.71)×107cfu/mL;对照组24 h膜内活菌数为(23.01±2.23)×107cfu/mL,48h膜内活菌数为(45.31±4.46)×107cfu/mL。同一时间点实验组与对照组膜内活菌数比较差异有统计学意义(P=0.000)。
2.3 扫描电镜观察结果 依据文献[10]的方法对钛板表面细菌进行半定量评估,实验组24 h黏附金葡菌为“+”,48 h黏附金葡菌为“++”;对照组24h黏附金葡菌为“+++”,48 h黏附金葡菌为“++++”(共采集5个视野,“+”为每个视野中少于20个细菌,“++”为每个视野中有20~100个细菌,“+++”为每个视野中有100~200个细菌,“++++”为每个视野中超过200个细菌)。
对照组与实验组体外培养24 h后均观察到钛板表面有细菌黏附,但实验组钛板表面细菌黏附量明显少于对照组(P=0.000,见图3a~b);对照组与实验组体外培养48 h后钛板表面细菌黏附量较24 h时均增多,但实验组亦明显少于对照组(P=0.000,见图3c~d)。于20 000倍视野下观察实验组及对照组钛板表面细菌生物膜形态,可见对照组钛板表面黏附细菌胞周分泌大量多糖蛋白,纤维样网状结构,将细菌与细菌、细菌与钛板黏附在一起。而实验组钛板表面黏附细菌胞周仅分泌少量多糖蛋白,细菌与细菌、细菌与钛板之间无明显联系(见图4)。
a 普通钛板表面形貌特征 b 钛板表面接枝2-MPC后表面形貌特征
图2 实验组及对照组钛板表面形貌特征(扫描电镜,×5 000)

a 体外培养24 h对照组钛板表面的细菌量 b 体外培养24 h实验组钛板表面的细菌量
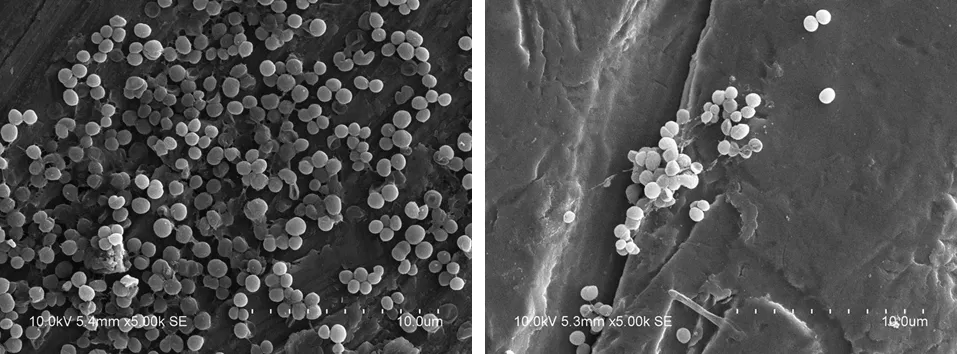
c 体外培养48 h对照组钛板表面的细菌量 d 体外培养48 h实验组钛板表面的细菌量图3 细菌在实验组及对照组钛板表面黏附量(扫描电镜,×5 000)
3 讨 论
内固定术后感染难以治愈的主要原因是内固定材料上细菌生物膜的形成[1]。细菌生物膜是细菌克隆产生的一层多糖-蛋白质复合物,是细菌在自然界的一种生存方式,是细菌避免受到宿主的防御反应和化学治疗药物的攻击的一道防御屏障[9]。细菌生物膜上细菌对抗生素的耐药性高于浮游菌状态下细菌耐药性[10],从而导致全身应用抗生素的效果不佳。
细菌通过黏附与聚集两个阶段在内固定材料表面形成细菌生物膜[11]。研究发现[12],细菌能黏附于大多数医疗器械、生物医学材料表面,并可在24~48 h内形成细菌生物膜。目前对已成熟稳定的生物膜尚无有效的治疗方法,因此采取相应措施干预内固定物表面细菌生物膜形成,是预防内固定术后感染的重要手段。
细菌黏附在内固定表面是细菌生物膜形成的起始步骤,如果能够抑制细菌在内固定材料表面的黏附,则可抑制细菌生物膜的形成[13]。但是目前抑制细菌黏附的方法不多,主要包括:(1)植入体内的内置物必须非常洁净,在植入时才从包装内取出,最大限度减少细菌的黏附;(2)设计能够抵抗细菌黏附的内置物材料,如在内置物材料内加入银离子;(3)在内置物材料表面涂层抗生素;上述方法效果均有限[14]。2-MPC是较早提出的仿细胞膜结构的物质[4],将其与憎水性丙烯酸酯类单体共聚得到具有亲水、亲油两亲性的共聚物。研究表明用2-MPC聚合物对生物材料表面进行仿细胞膜外层结构的修饰,可显著增加材料的生物兼容性,减少蛋白吸附及细胞黏附[15]。本研究中,我们通过化学接枝法将2-MPC涂层于医用钛板表面,扫描电镜观察可见涂层2-MPC钛板表面光滑平整,钛板原有凹凸不平纹理消失,说明应用化学接枝法将2-MPC涂至钛板表面是一种简单可行的方法。本研究中,我们发现对照组与实验组体外培养24 h后均观察到钛板表面细菌黏附,但实验组钛板表面细菌黏附量明显少于对照组(P=0.000),对照组与实验组体外培养48 h后钛板表面细菌黏附量较24 h时均增多,但实验组亦明显少于对照组(P=0.000)。这就说明2-MPC涂层于骨科内固定材料表面有抑制细菌黏附的作用。进一步通过扫描电镜20 000倍视野观察可见48 h时对照组钛板表面黏附细菌胞周分泌了大量多糖蛋白,纤维样网状结构形成,细菌与细菌之间形成紧密联系,而实验组钛板表面黏附细菌仅有少量多糖蛋白分泌,细菌间无明显联系。扫描电镜结果说明涂层2-MPC钛板能有效抑制细菌黏附进而减少细菌生物膜的形成。
2-MPC聚合物抑制细菌在钛板表面的黏附,进而减少细菌生物膜的形成,其机制目前还不清楚[16]。许多抗菌材料在体外实验均显示出较好的抗菌效果,但在体内的抗菌效果却并不太理想[17]。主要的问题是当材料被移植到体内,材料表面就会立即被纤维蛋白原、纤维蛋白、血小板等黏附,从而形成了细菌黏附的载体,细菌就能很轻易的形成菌膜,失去了体外明显的抗菌效果。2-MPC能有效抑制体内纤维蛋白、血小板等物质的黏附[18]。其可能机制是:2-MPC仿细胞膜结构能够有效的降低细菌胞外多糖的黏附作用,使细菌生物膜形成的初始黏附阶段受到抑制,进而大量的细菌无法通过胞外多糖黏附于一起,最终减少细菌生物膜的形成。
综上所述,涂层2-MPC钛板在体外实验中能有效抑制细菌在钛板表面的黏附,进而减少细菌生物膜的形成。但是在体内的应用还需进一步实验验证,目前看来,2-MPC材料应用于预防细菌生物膜的形成具有光明的应用前景。
