食品中乳酸菌定量检测方法研究进展
2020-06-17刘艳容舒永红杨佳玮顾慧丹
刘艳容,舒永红,杨佳玮,顾慧丹,杨 瑶,*
(1.南京市产品质量监督检验院,国家加工食品及食品添加剂质检中心,江苏南京 210019;2.南京师范大学食品与制药工程学院,江苏南京 210023)
乳酸菌(lactic acid bacteria,LAB)是一类能发酵糖产生乳酸的微好氧、厌氧或兼性厌氧的革兰氏阳性细菌[1]。乳酸菌很早就被人们应用到各种食品的生产中,如奶酪、泡菜、酸奶等。如今,随着乳酸菌健胃整肠、抑制致病菌、抗氧化、增强机体免疫等益生功能被不断揭示,乳酸菌在农牧业、食品乃至医药行业的应用更为广泛[2],而食品中乳酸菌的检测则成为相关食品生产企业及食品监督检测部门重要的工作内容。
2014年,由国际益生菌与益生元科学联合会(ISAPP)发布的关于益生菌的共识中突出强调了益生菌的3个核心特征,即足够数量、活菌状态、有益健康功能[3]。2018年我国修订的《益生菌类保健食品申报与审评规定(征求意见稿)》已采纳了这一概念。由于益生菌食品功效的发挥主要取决于活菌的作用,因此,食品中乳酸菌的活菌数量是该类食品检验的核心内容。目前我国产品标准规定发酵乳制品及活菌型乳酸菌饮料中乳酸菌活菌数不得少于1×106CFU/g(mL)[4-5],其检测方法标准为GB 4789.35-2016[6],采用的是平板计数法,但是该方法在实际应用中存在耗时长(一般为72 h)、工作量大和操作繁琐等缺点。随着分析检测技术的蓬勃发展,一些快速检测方法在食品中乳酸菌检验应用越来越广泛。2015年,国际标准化组织(ISO)颁布了采用流式细胞术测定乳及乳制品、发酵剂及发酵产品和益生菌制品中乳酸菌数量的方法标准[7],该方法检测时间短,大大提高了检测效率,但是检测特异性存在不足。
荧光定量PCR法(qPCR)作为快速、灵敏且特异性强的分子生物学检测技术已经广泛应用于食品微生物检验领域,在qPCR法基础上通过研发新型DNA染料建立的EMA-qPCR和PMA-qPCR法可有效区分活和死的微生物,是近些年来兴起的活菌检测技术,在食品乳酸菌活菌检测中的研究报道日益增多。本文综述了近年来国内外研究学者对食品中乳酸菌定量检测方法的研究进展,以平板计数法和流式细胞术为基础,重点阐述了荧光定量PCR法及前沿的 PMA-qPCR法在食品乳酸菌定量检测中的方法原理、应用现状和技术优势,引发研究者对该方法的深入思考,也为更好地开发荧光定量PCR技术在食品乳酸菌活菌检测中的应用提供参考。
1 平板菌落计数法
平板菌落计数法是一种统计菌落总数的常用微生物学方法,目前我国食品中乳酸菌的检测方法标准为GB 4789.35-2016[6],采用的就是平板计数法,具体方法如表1所示。

表1 现行国标GB 4789.35-2016检测食品中乳酸菌数量Table 1 Number of lactic acid bacteria in food detected by current national standard GB 4789.35-2016
平板菌落计数法作为最常用的也是现行国标中的检测方法,其中平板培养基成分、培养条件和接种方法等对计数结果的准确性有很大的影响,现有研究对培养基成分优化的研究报道最多。方改霞等[8]报道了向MRS培养基中加入适量硫酸多粘菌素和放线菌酮可抑制大肠菌群和致病菌等杂菌生长,从而增加对活菌型乳酸菌饮料中乳酸菌计数结果的准确性。蔡芷荷等[9]研究表明添加2.5 mg/100 mL莫匹罗星锂盐(Li-MUP)能明显区分保加利亚乳杆菌和嗜酸乳杆菌与双歧杆菌。蒋曙光等[10]开发了用于区分双歧杆菌和其他乳酸菌的显色培养基。黄宝莹等[11]研究表明含氧量对不同乳酸菌样品的计数结果影响较大。多篇文献[8,11-13]研究表明倾注法接种的乳酸菌生长情况更好,计数结果也较涂布法更为准确。
平板菌落计数法操作简便,结果直观准确。然而,该方法也存在弊端,主要表现在操作工作量大,此外,检验周期长(72 h左右)是最大的缺点,尤其对原本货架期较短的发酵乳制品的检测更为不利[14]。因此,快速检测食品中乳酸菌数量则是对食品企业及监管部门提出的更高要求。
2 流式细胞术
2.1 流式细胞术的检测原理
流式细胞术(Flow cytometry,FCM)是基于流式细胞仪的一种检测技术,当带有荧光标记的细胞进入仪器内液流系统时被鞘液包裹而形成单细胞悬液,单细胞悬液经过喷嘴进入光学检测系统,被激光激发而产生特异性荧光,荧光的强弱与细胞标记的荧光分子多少相关,从而可定量分析出细胞中DNA、RNA或者某蛋白质的含量以及细胞数量[15]。FCM在微生物学领域如菌体计数、活性判断、在线监测等方面的应用广泛[16]。
2.2 FCM定量检测乳酸菌
FCM在分析乳酸菌过程中通常与免疫荧光技术结合,荧光染料的选择对于检测的成败至关重要。Bunthof等[17]研究表明5(6)-羧基二乙酸荧光素琥珀酰亚胺酯(CFDA)和噻唑橙二聚体-1(TOTO-1)的联合使用更适用于多种乳酸菌检测。Bensch等[18]采用了SYBR Green I和碘化丙酸丙酯PI对植物乳杆菌发酵剂进行染色,准确地测定活细胞浓度。Salma等[19]报道了运用FCM和BOX/PI染料的组合测定葡萄酒中乳酸菌。熊涛等[20]运用CFDA和PI对细胞进行双染,通过荧光强度对比分析出细胞膜受损与未受损细胞的量。刘洋等[21]建立了FCM结合SYTO®24和碘化丙锭染色的乳酸菌检测方法。
除了染料的选择,样品的预处理方法也是FCM定量检测乳酸菌的关键影响因素。发酵乳是最常见的检测乳酸菌的食品,其主要成分为生乳,而生乳的成分复杂,含有多种微粒和胶体物质,检测的干扰因素多。Gunasekera等[22]报道先用酶法清除乳中的蛋白和脂粒,应用FCM在1 h内快速测定出牛奶中的总细菌。Bunthof等[23]通过优化原料的清洁处理方法提高了信噪比,并使乳中植物乳杆菌WCFS1的提取率保持较高水平且菌体活力不受此步骤的影响。王宁等[7]通过对生乳采用酶法消化蛋白质颗粒、高速离心脱脂的方式来消除大颗粒物质对流式检测的影响,并对菌体进行热处理,使其易于被荧光性染料PI染色。
如今FCM对食品中乳酸菌定量检测日趋成熟。2015年,国际标准化组织(ISO)已经颁布了FCM测定乳及乳制品、发酵剂及发酵产品和益生菌制品中乳酸菌数量的方法标准[7]。该标准通过对DNA、原生质体和膜电位三处进行染色的方法实现了对活性乳酸菌的准确计数,检测范围为104~108CFU/mL。国内杜耿记等[24]对29种商品乳的FCM检测结果与GB 4789.35-2010 国标方法对比显示出较高的一致性,且FCM检测单一样品仅需13 min。
2.3 FCM的优势与问题
FCM在检测过程中无需培养细菌,大大缩短了检测时间。此外,FCM检测具有更高的准确度,且能辨别活/死菌分别进行计数[21]。虽然国际上已确定FCM为检测发酵品中乳酸菌的标准方法,但是该方法仍存在一定的缺陷:仪器昂贵,运行操作费用高;染料对于待检菌株灵敏度的不同可能引起检测数据的不准确;对于复杂样品如生乳,需要进行前处理才能得到准确结果[7,22-23];不能特异性针对样品中的某一种或多个菌株分别进行检测。因此,关于FCM检测乳酸菌的研究仍旧需要优化和完善,如Geng等[25]将FCM与多克隆抗体结合建立了一种乳品中动物双歧杆菌的快速特异性计数方法。
3 荧光定量PCR法
3.1 检测原理
荧光定量PCR法(简称qPCR法)是通过荧光染料或荧光标记的特异性探针,对PCR产物进行标记跟踪,通过仪器和相应软件分析结果,对待测样品中的初始模板进行定量分析,包括SYBR Green染料和TaqMan荧光探针的方法(下文简称染料法和探针法)。
3.2 qPCR法检测食品中的乳酸菌
本文就我国近年来使用qPCR技术对食品中乳酸菌定量检测的研究方法列表见表2。实际操作中该方法主要受引物设计、DNA模板制备、qPCR反应条件等关键因素的影响。
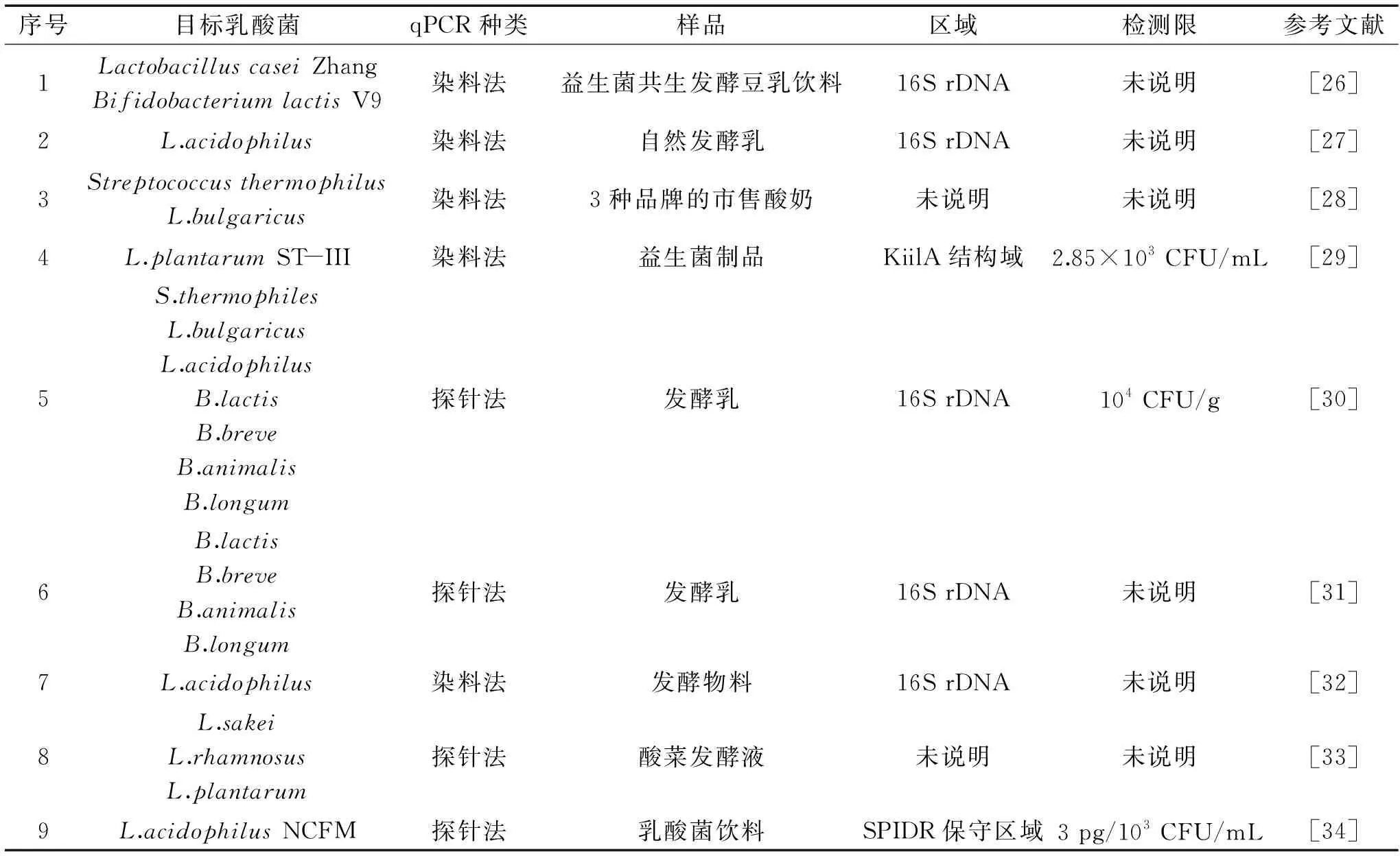
表2 qPCR技术检测食品中乳酸菌数量Table 2 Numbers of lactic acid bacteria in food detected by qPCR
3.2.1 引物及其设计 根据待测菌株的基因信息设计特异性引物,通过qPCR法,能够高效、灵敏和准确的检出目标微生物。目前特异性引物的设计主要是针对菌株16S rDNA可变区序列设计的,如其木格苏都等[26]报道通过对待测菌株16S rDNA区域设计引物,在益生菌共生发酵豆乳饮料中分别检测了LactobacilluscaseiZhang和BifidobacteriumlactisV9两种乳酸菌的数量。如果待检微生物具有独有基因,那么针对该基因序列设计引物将有助于提高检测的准确性,如陈臣等[29]报道利用L.plantarumST-III菌株独有的KilA结构域蛋白(YP_003924036.1)设计引物,检测限达到2.85×103CFU/mL。为了进一步提高qPCR法检测的特异性,有研究学者选择用探针法对复杂样品中的目标乳酸菌进行定量检验,如张娜娜等[34]通过增加设计一条探针引物,对乳酸菌饮料样品中的L.acidophilusNCFM菌株进行定量检测,检测的绝对灵敏度达到3 pg,相对灵敏度达到了103CFU/mL。
3.2.2 样品DNA提取 选择合适的DNA提取方法以获得高质量的模板DNA也是qPCR法成功的一个决定因素。由于含乳酸菌的食品样本如酸奶、乳酸菌饮料或奶酪等一般成分复杂,偏酸性且不均一,因此食品中乳酸菌DNA的提取需要先除杂[23]。由于乳酸菌是革兰氏阳性细菌,其细胞壁具有致密的肽聚糖层而不易破碎,因此,乳酸菌DNA的提取具有较大的难度,目前提取含乳酸菌的食品样本或乳酸菌菌液DNA主要采用酶解法、碱式提取法、试剂盒法等[31,35]。刘红娟等[36]利用溶菌酶破坏乳球菌KLDS4.0309、KLDS4.0311和乳杆菌KLDS1.0316、KLDS14-1的细胞壁。吴艳涛等[31]使用链霉蛋白酶E处理提取发酵乳中的双歧杆菌。臧凯丽等[37]采用球磨-CTAB法结合碱式提取法提取嗜酸乳杆菌基因组DNA。如今文献报道最多的提取乳酸菌DNA的方法是试剂盒法[27,30,38],该方法具有普遍的适用性。
3.2.3 qPCR反应条件 qPCR反应的重要条件包括模板DNA浓度、退火温度以及PCR的循环次数等。魏霜等[39]为了检测微生物肥料中的鼠李糖乳杆菌设计了DPO引物,同时探究了不同退火温度下该引物的特异性;张娜娜等[34]根据L.acidophilusNCFM的SPIDR保守区域设计特异性引物与探针,并对扩增温度进行优化,结果表明60 ℃扩增效率最高。
综上所述,qPCR法具有快速、准确、灵敏度高和重复性好等优点,在乳酸菌检测方面的研究报道较多。但是,由于活的乳酸菌数量才具有实际检测意义,因此无法对活/死菌进行区分是该方法的严重不足[40]。
4 PMA-qPCR法
4.1 检测原理
叠氮溴化乙锭(EMA)和叠氮溴化丙锭(PMA)是一类新型DNA高亲和力的光敏反应染料,染料嵌入双链DNA中在强烈的可见光下可形成共价连接的化学修饰,修饰后的DNA不能经PCR扩增[41]。由于EMA和PMA完全不能透过细胞膜,这一特性使得它们可以和qPCR法联合使用,进行选择性的扩增活细胞DNA,而不扩增死细胞(细胞壁和细胞膜已破损的细胞)DNA,大大提高了活菌检测的准确性,原理如图1所示[42]。有研究者发现,EMA处理会造成活菌的基因组DNA的损失,因此选用PMA染料的该类研究更多[43]。
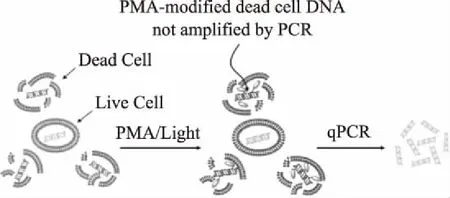
图1 利用PMA染料选择性检测活细胞的原理Fig.1 Principle of selective detection ofviable cells using PMA dye
4.2 PMA-qPCR法检测食品中的乳酸菌
目前PMA-qPCR技术已经广泛应用在食品、食品接触材料和水环境中的致病微生物的安全检测中[44-45]。自2009年García-Cayuela等[46]首次报道了利用PMA-qPCR技术检测发酵乳中的乳酸菌活菌数量之后,近几年相关报道逐渐增多,但国内的相关研究很少。本文将已报道的PMA-qPCR技术用于乳酸菌活菌数量检测的研究结果列于表3,并对该技术的关键因素控制展开讨论。
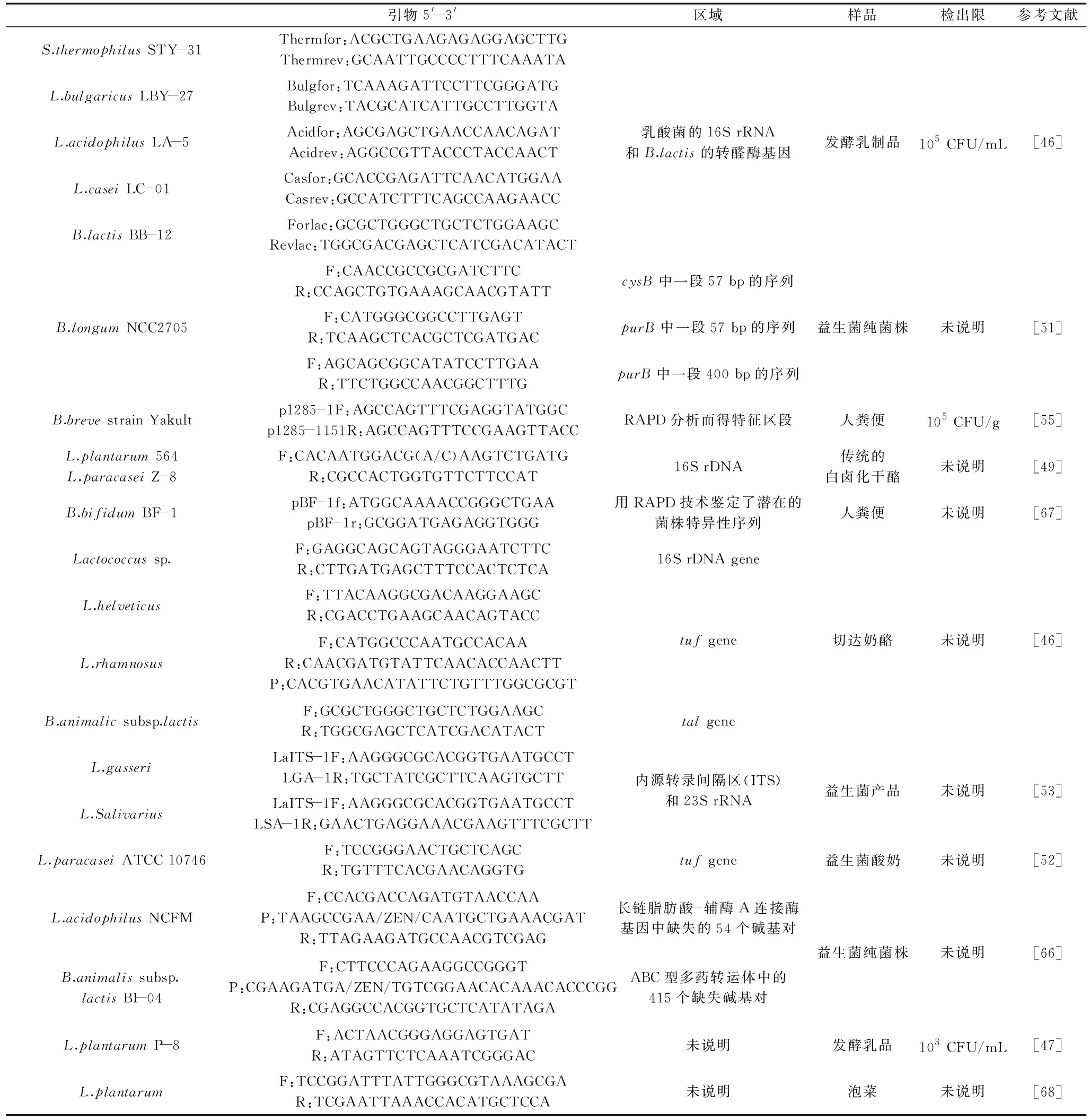
表3 PMA-qPCR技术检测乳酸菌食品Table 3 Lactic acid bacteria food detected by PMA-qPCR
4.2.1 引物及其设计 与常规qPCR技术相类似,目前PMA-qPCR技术检测单一乳酸菌的活菌数量已经在很多乳酸菌菌株中研究成功,如副干酪乳杆菌、保加利亚乳杆菌、嗜热链球菌和双歧杆菌BB12[46]等。我国张和平团队也报道了PMA-qPCR技术检测植物乳杆菌P-8的研究[47]。Desfossés-Foucault等[48]在定量检测鼠李糖乳杆菌时,还设计了一条探针引物以进一步确保对目标菌株计数的灵敏性和准确性。但是,由于在乳酸菌食品中,一般是多种乳酸菌混合添加的,因此,同时检测不同种乳酸菌的活菌数将更符合乳酸菌检验的实际需要。Zorica等[49]报道了利用设计的兼并引物,同时对Lb.plantarum564和Lb.paracaseiZ-8进行检测。Desfossés-Foucault等[46]报道了设计通用引物对契达奶酪中乳球菌属菌株进行活菌检测。此外,在肠道菌群的研究中,通过设计通用引物对肠道中双歧杆菌属、乳杆菌属等不同种属微生物进行定量检测可为乳酸菌食品中分类检测乳酸菌提供有利参考条件。
4.2.2 膜损伤菌的制备 膜损伤菌的制备直接影响到PMA染料与“死细胞”DNA的结合效率,是建立PMA-qPCR法检测标准曲线的关键环节。目前,膜损伤菌的制备方法报道有热致死法、玻璃珠破碎法、有机溶剂处理法、紫外线处理法和冻融法等多种[50],而在乳酸菌的研究中,大都采用热致死处理法,但热处理的具体条件不一致。Reimann等[51]采用56 ℃处理B.longumNCC2705。Scariot等[52]研究结果显示对副干酪乳杆菌60- ℃处理30 min效果最佳。Lai等[53]研究表明,在100 ℃热处理30 min的条件下,干酪乳杆菌死菌的DNA已不再被检出,而唾液酸乳杆菌死菌的DNA仍旧有少量被检出。
4.2.3 PMA染料的工作条件优化 PMA染料的工作条件具体包括PMA染料浓度、光反应时间和暗反应时间等因素[54],需要根据检测菌株特性、菌株数量和实际检测样品中活菌数量的不同而优化研究。García-Cayuela等[46]检测发酵酸奶中的双歧杆菌的PMA处理条件为浓度50 μmol/L,暗反应5 min和光反应15 min,而Fujimoto等[55]检测短双歧杆菌时PMA处理光反应2 min。Pinheiro等[56]检测粪肠球菌的最佳PMA工作条件为浓度100 μmol/L,暗反应5 min和光反应10 min。
5 数字PCR法
5.1 检测原理
数字PCR(dPCR)技术是一种核酸分子的绝对定量技术,主要分为基于芯片的dPCR(chip digital PCR,cdPCR)和基于微滴的dPCR(droplet dPCR,ddPCR)这两大类。其中cdPCR的主要原理是将反应体系通过微流控等技术均匀地导入到含有数万个小孔的芯片上,每个小孔作为一个反应室;而ddPCR则是将PCR反应体系均匀地分割成大量的乳液包裹的微小液滴,实现每个反应微滴只有单个或几个模板分子进行扩增[57-58]。由于dPCR是通过采集阳性信号与阴性信号的比例,按照泊松分布统计学方法直接确定原始反应体系中样品的数量,因此从原理上克服了传统PCR易受引物之间的相互干扰以及DNA样品的纯度等因素的影响的缺点,可实现对复杂样本模板的各自不同引物PCR检测[59]。
5.2 dPCR法在食品领域中的应用
目前,dPCR技术在食品领域中的应用研究日益增多[60]。Li等[61]利用dPCR技术与测序技术相结合,特异性检测食品样本中产溶血素的副溶血性弧菌,该研究结果比传统基于副溶血性弧菌分离的方法所得的结果更准确,降低了假阴性结果的风险。蔡教英等[58]利用dPCR技术精准定量转基因油菜中RF1基因含量,检测限和最低检测限分别为18拷贝/反应和3.7拷贝/反应。Floren等[62]报道了dPCR法对加工肉制品中牛、马和猪肉含量的精确定量,结果显示dPCR法在不同肉制品中的定量限和检测限分别为0.01%和0.001%,显著优于qPCR法。近年来dPCR法已纳入多项食品检测国家标准中,主要涉及转基因食品的检测[63-64]和食源性病原微生物的检测[65]。2018年Hansen等[66]报道了PMA结合基因芯片dPCR技术同时检测混菌样品中L.acidophilusNCFM和B.animalissubsp.lactisBl-04的活菌数量,得出的相对标准偏差分别为5%和4%,显著优于平板计数法(15%),可见该方法精确度高,稳定性强。目前,国内还未有dPCR技术应用于乳酸菌食品检测的文献报道,可以预见,随着dPCR技术的研究与推广,其在乳酸菌检测中的应用也会愈加广泛。
6 展望
食品中乳酸菌定量检测的核心是活菌检测。现行的国家标准采用平板计数法,该方法直观易行,是活菌检测的“金标准”,但是该方法最大的缺点是耗时长,不能满足食品行业快速检测的发展需要,开发快速检测方法势在必行。此外,平板计数法得到结果的准确性也存在一些争议。一些研究者指出平板计数法检测的是可培养的活菌,而实际样品中存在未能培养的活菌[69],这些活菌也可能对产品功效起作用,因此其数量也需要准确测量。
流式细胞术(FCM)的应用极大缩短了样品的检验时间,根据欧盟标准采用FCM对食品中乳酸菌活菌定量测定,检测时间约20~30 min,极大提高了检测效率。该方法的检测原理是针对标记的微生物直接计数,因此检测结果比依赖培养的平板计数法更为准确。但是FCM法的局限性在于不能特异性检测食品中特定乳酸菌,因此不适用于样品中存在污染杂菌等情况。此外,由于含乳酸菌食品常为发酵乳,样品成分复杂,检测背景高,会干扰检测结果的准确性。因此,FCM技术的发展需要结合特异性检验技术、预处理方法的优化及灵敏度更高的荧光染料的开发以增强该方法的适用范围及提高检测的准确度。
荧光定量PCR(qPCR)技术通过设计特异性引物有效地检验样本中的特定微生物,该方法快速、灵敏,在食品微生物检验中广泛应用,对食品中特定乳酸菌的检验研究报道有很多[61,70-71]。但是由于不能区分活/死菌,qPCR法在乳酸菌食品检验中遇到难题。近年来,随着EMA/PMA染料的开发,EMA/PMA结合qPCR法检测食品中特定活菌的研究报道日益增多,但该方法在食品乳酸菌检验的应用研究报道不多。通过本文对PMA-qPCR法的工作原理、操作步骤及应用实例的详细阐述,不难判断,选用PMA-qPCR法对食品中乳酸菌活菌定量分析是可行的,且该方法灵敏度高、检测时间短,符合快速检验的食品检测行业发展需求。但是,随着越来越多不同种类的益生菌开发并添加至食品中,对食品中多种乳酸菌的同时定量检测将成为乳酸菌食品的更高的检测要求,因此qPCR技术不仅需要结合PMA等染料的研发区分活/死菌,还需要结合更前沿的微流控、基因芯片等高通量检测技术(如dPCR技术)等,才能符合乳酸菌食品更高的检验要求。这将是对每一位乳酸菌检验研究的工作者的挑战。
综上所述,国内外对食品中乳酸菌的活菌检验的研究不断发展,涌现出基于不同工作原理下的检测方法,主要有平板计数法、FCM法及荧光定量PCR法。本文综述了各方法的工作原理、研究现状及发展动态,总结了各自的优缺点,为把握食品中乳酸菌活菌定量检测的行业方向提供依据。可以预见,随着多学科交叉,更多检测技术将不断深入研究与完善,对食品中乳酸菌“快速”和“精准”检测的目标不久将会实现。
