基于Nrf2/HO-1信号通路的夜关门提取物对谷氨酸诱导小鼠海马细胞HT22损伤的保护作用及机制研究
2020-06-15郭丰黄山李斌
郭丰 黄山 李斌


中圖分类号 R285 文献标志码 A 文章编号 1001-0408(2020)11-1303-06
DOI 10.6039/j.issn.1001-0408.2020.11.04
摘 要 目的:基于核因子2(Nrf2)/血红素加氧酶1(HO-1)信号通路研究夜关门提取物对谷氨酸诱导小鼠海马细胞HT22损伤的保护作用及机制。方法:采用谷氨酸(5 mmol/L)建立HT22细胞损伤模型后,以水溶性维生素E为阳性对照(50 ?mol/L),采用MTT法检测0(空白对照)、25、50、100 ?g/mL夜关门的石油醚、二氯甲烷、乙酸乙酯提取物预处理12 h后对谷氨酸诱导损伤细胞增殖的影响。以水溶性维生素E为阳性对照(50 ?mol/L),采用2′,7′-二氯荧光黄双乙酸盐探针(DCFH-DA)法检测0(空白对照)、25、50、100 ?g/mL夜关门二氯甲烷提取物预处理12 h后对谷氨酸诱导损伤细胞中活性氧(ROS)水平的影响;以HO-1激动剂钴-原卟啉为阳性对照,采用Western blotting法检测0(空白对照)、25、50、100 ?g/mL夜关门二氯甲烷提取物处理24 h后对细胞中HO-1蛋白表达的影响;分别采用Western blotting法(药物分别处理0.5、1、1.5 h)和免疫荧光染色法(药物处理1 h)检测100 ?g/mL夜关门二氯甲烷提取物处理后对细胞核内外Nrf2蛋白表达的影响。采用小干扰RNA(si-RNA)转染技术进行HO-1基因沉默后,考察100 ?g/mL夜关门二氯甲烷提取物对谷氨酸诱导损伤细胞的存活率以及细胞中ROS水平的影响。结果:与空白对照比较,50、100 ?g/mL夜关门二氯甲烷提取物均可显著升高细胞的存活率(P<0.05),并降低细胞中ROS水平(P<0.05);25、50、100 ?g/mL夜关门二氯甲烷提取物均可显著升高细胞中HO-1蛋白表达水平(P<0.05),100 ?g/mL夜关门二氯甲烷提取物可显著降低细胞质中Nrf2蛋白水平并升高细胞核中Nrf2蛋白水平(P<0.05)。HO-1基因沉默后,夜关门二氯甲烷提取物对谷氨酸诱导损伤细胞的促增殖以及降低ROS水平的作用被逆转(P<0.05)。结论:夜关门二氯甲烷提取物可通过激活Nrf2信号通路,诱导HO-1蛋白的表达,从而发挥对谷氨酸诱导损伤HT22细胞的保护作用。
关键词 夜关门;谷氨酸;血红素加氧酶 1;核因子2;小鼠;海马细胞HT22;机制
ABSTRACT OBJECTIVE: To study the protective effects of Lespedeza cuneata extract on glutamate-induced hippocampal cells HT22 injury of mice and its possible mechanism based on Nrf2/HO-1 signaling pathway. METHODS: Using glutamate (5 mmol/L) to extablish the injury model of HT22 cells. Using water soluble vitamin E as positive control (50 ?mol/L), MTT assay was used to detect the effects of 0 (blank control), 25, 50, 100 ?g/mL petroleum ether extract, dichloromethane extract, ethyl acetate extract of L. cuneata on the proliferation of glutamate-induced injury cellsafter pretreated for 12 h. Using water soluble vitamin E as positive control (50 ?mol/L), DCFH-DA assay was used to detect the effects of 0 (blank control), 25, 50, 100 ?g/mL L. cuneata dichloromethane extract on the level of active oxygen (ROS) in glutamate-induced injury cells after pretreated with 12 h. Using HO-1 agonist CoPP as positive control, Western blotting method was used to detect the effects of 0 (blank control), 25, 50, 100 ?g/mL L. cuneata dichloromethane extract on the protein expression of HO-1 after treated for 24 h. Western blotting method (treated for 0.5, 1, 1.5 h) and immunofluorescence staining (treated for 1 h) were used to detect the effects of 100 ?g/mL L. cuneata dichloromethane extract on protein expression of Nrf2 inside and outside the nucleus. After HO-1 gene was silenced by small interfering RNA (Si RNA) transfection technology, the effects of 100 ?g/mL L. cuneata dichloromethane extract on the survival rates of glutamate-induced injury cells and the level of ROS were detected. RESULTS: Compared with blank control, 50, 100 ?g/mL L. cuneata dichloromethane extract could significantly improve the survival rate of glutamate-induced injury cells (P<0.05), while reduced the level of ROS (P<0.05). 25, 50, 100 ?g/mL L. cuneata dichloromethane extract could increase the protein expression of HO-1 in cells (P<0.05), while 100 ?g/mL L. cuneata dichloromethane extract could significantly decrease the protein level of Nrf2 in cytoplasm and increase that in nucleus (P<0.05). After HO-1 gene silencing, the effects of L. cuneata dichloromethane extract on the proliferation promotion of glutamate-induced injury cells and the reduction of ROS level were reversed (P<0.05). CONCLUSIONS: L. cuneata dichloromethane extract can protect HT22 cells against injury induced by glutamate through activating Nrf2 pathway, inducing HO-1 expression.
KEYWORDS Lespedeza cuneata; Glutamate; HO-1; Nrf2; Mice; Hippocampal cells HT22; Mechanism
大脑中的海马神经元损伤是各种神经退行性疾病的重要病理环节[1-2]。谷氨酸作为哺乳动物中枢神经系统中最重要的兴奋性神经递质,不仅参与了快速的兴奋性突触传递,还可以调节神经递质的释放、突触的可塑性,参与中枢神经系统正常的生理功能[3]。然而,细胞间隙中谷氨酸浓度过高时会对神经元产生氧化应激与毒性,导致神经元的退化、衰老及死亡,谷氨酸引起的神经毒性是导致神经退行性疾病中神经细胞死亡的重要机制之一[4]。夜关门为豆科胡枝子属植物夜关门(Lespedeza cuneata G. Don)的全草,广泛分布于我国大部分地区[5],具有清热解毒、利湿消积等功效[6-7]。现代药理学研究表明,夜关门具有抗菌、抗炎及抗氧化等多种生物活性[8-9]。此外,有研究发现,夜关门可以通过降低脑组织中一氧化氮(NO)及活性氧(ROS)水平有效地抑制小鼠实验性失眠[10],而NO与ROS水平异常则是脑神经毒性的重要指标。因此,本课题组利用谷氨酸诱导小鼠海马细胞HT22损伤模型,探究夜关门提取物对脑神经保护的药效作用及相关机制,为该药用植物的进一步开发利用提供实验依据。
1 材料
1.1 仪器
AS110 R2型分析天平(波兰Radwag公司);ELx800型多功能酶标仪(美国Bio-Tek公司);HS-1302型超净工作台(上海博讯医疗生物仪器股份有限公司);GL-802型微型台式真空泵(海门市其林贝尔仪器制造有限公司);CCL-170B-8型CO2恒温培养箱(新加坡艺思高生物科技有限公司);XSP-17CV型倒置生物显微镜(上海巴拓仪器有限公司);XB-K-25型细胞计数板(深圳市达科为生物技术有限公司); Mini P-4型小型垂直电泳系统(北京凯元信瑞仪器有限公司);Tanon-4600型化学发光成像仪(上海天能科技有限公司);CX31-12C04型双目生物荧光显微镜(日本Olympus公司);TDZ5-WS型冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
1.2 药品与试剂
夜关门药材于2018年8月采自山东青岛,经青岛科技大学化工学院黄山教授鉴定为豆科胡枝子属植物夜关门(L. cuneata G. Don)的全草;水溶性维生素E对照品、谷氨酸对照品(美国Sigma公司,批号:1001270674、100023-198601,纯度:97%、98%);二甲亚砜(DMSO,美国Amresco公司);DMEM高糖培养基、胎牛血清(FBS)、0.25%胰蛋白酶、青霉素/链霉素双抗(美国Gibco-BRL公司,批号:2081862、11041-8611、90326-1、91018-1);Griess染色试剂盒(美国Promega公司,批号:20190605);Bradford蛋白浓度测定试剂盒、RIPA裂解液(北京索莱宝生物科技有限公司,批号:20190708、20290305);血红素加氧酶1(HO-1)小鼠单克隆抗体、核因子2(Nrf2)小鼠单克隆抗体、β-肌动蛋白(β-actin)小鼠单克隆抗体、核纤层蛋白B(Lamin-B)小鼠单克隆抗体、辣根过氧化物酶(HRP)标记的兔抗小鼠免疫球蛋白G(IgG)二抗、小干扰RNA 对照品(si-RNA control)、HO-1小干扰RNA (si-RNA HO-1)、钴-原卟啉(CoPP)(美国Santa Cruz公司);2′,7′-二氯荧光黄双乙酸盐探针(DCFH-DA)、异硫氰酸荧光素(FITC)标记的IgG二抗、4′,6-二脒基-2-苯基吲哚(DAPI)染液(英国Abcam公司,批号:ab113851、ab188285、ab228549);LipofectamineTM2000转染试剂(美国Invitrogen公司,批号:1306267);MTT试剂盒、ROS检测试剂盒、二喹啉甲酸(BCA)试剂盒(南京建成生物工程研究所,批号:804W0515、100-500T、20180317);其余试剂均为分析纯,水为超纯水。
1.3 细胞
小鼠海马细胞HT22细胞株由韩国圆光大学金英哲教授赠送。
2 方法
2.1 夜关门不同溶剂提取物的制备
取夜关门药材,打成粗粉,称取粗粉3份,各500 g,以70%乙醇为溶剂、料液比(g/mL)为1 ∶ 30,在80 ℃条件下回流提取,然后分别以石油醚、二氯甲烷、乙酸乙酯对提取液进行萃取,每种溶剂均萃取3次,每次溶剂用量均为12、8、6倍(L/kg),每次均萃取2 h;滤过,合并滤液,用旋转蒸发仪在水浴条件下减压浓缩,然后于55 ℃水浴中挥干溶剂,分别得到石油醚提取物(得率为2.78%)、二氯甲烷提取物(得率为3.23%)和乙酸乙酯提取物(得率为3.12%)。
2.2 细胞的培养
将细胞接种于含10%FBS和1%青霉素/链霉素双抗的DMEM高糖培养基中,在37 ℃、5%CO2的培养箱中培养,取对数生长期细胞用于试验。
2.3 夜关门不同溶剂提取物的细胞毒性考察
将细胞用含10%FBS和1%青霉素/链霉素双抗的DMEM高糖培养基(下同)重悬至密度为8×104个/mL,接种到96孔板中,每孔100 μL,将细胞置于37 ℃、5%CO2的培养箱中培养24 h。然后将细胞分为空白组和夜关门的乙酸乙酯、二氯甲烷、石油醚提取物组(质量浓度均为25、50、100、200 μg/mL,均以浸膏量计,下同),每组设置3个复孔。各给药组细胞先加入含相应药液的培养基预培养12 h,空白组细胞加入空白培养基,然后加入50 μL MTT试剂(终质量浓度为0.5 mg/mL),继续培养4 h;吸弃上清液,加入150 μL DMSO溶液,轻微振摇1 min至DMSO将甲臜结晶完全溶解后,采用酶標仪在490 nm波长处测定各孔的光密度(OD),并计算细胞存活率[细胞存活率(%)=OD试验组/OD空白组×100%]。
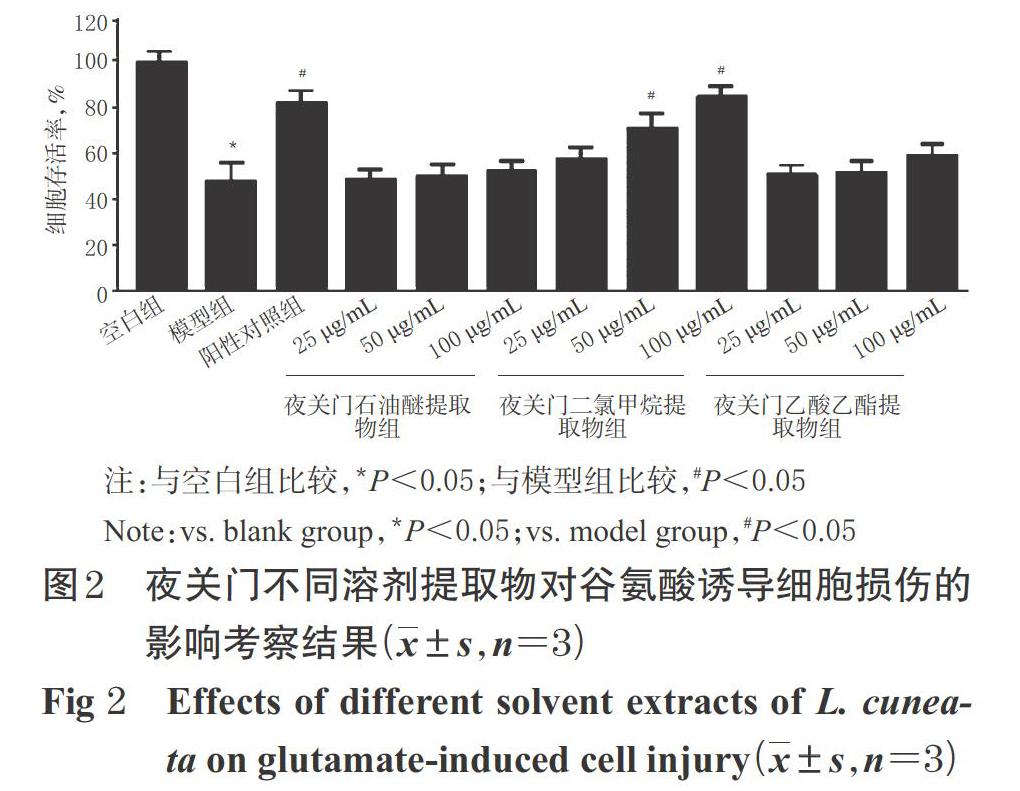
2.4 夜关门不同溶剂提取物对谷氨酸诱导细胞损伤的影响
按“2.3”项下方法接种、培养细胞后,将细胞分为空白组、模型组、阳性对照组(水溶性维生素E,50 μmoL/L)和夜关门的乙酸乙酯、二氯甲烷、石油醚提取物组(质量浓度均为25、50、100 μg/mL),每组设置3个复孔。各给药组细胞先加入含相应药液的培养基预培养12 h,空白组、模型组细胞加入空白培养基,然后除空白组外,其余各组细胞均加入谷氨酸(终浓度为5 mmol/L)诱导损伤24 h,再按“2.3”项下MTT法测定细胞存活率。
2.5 夜关门二氯甲烷提取物对谷氨酸诱导损伤细胞中ROS水平的影响
采用DCFH-DA法检测细胞中ROS水平。将细胞用培养基重悬至密度为2.5×104 个/mL,接种到24孔板中,每孔1 mL,将细胞置于37 ℃、5%CO2的培养箱中培养24 h。然后将细胞分为空白组、模型组、阳性对照组(水溶性维生素E,50 μmoL/L)和夜关门二氯甲烷提取物不同质量浓度组(25、50、100 μg/mL),每组设置3个复孔。空白组细胞不作处理;模型组细胞在培养12 h后,加入5 mmol/L谷氨酸诱导损伤12 h;各给药组细胞分别添加相应药液预处理12 h后,再加入5 mmol/L谷氨酸诱导损伤12 h。吸弃培养液,用无血清和抗体的培养基洗细胞3遍;用10 μmoL/L 的DCFH-DA避光孵育30 min,再用无血清和抗体的培养基洗3遍;加入1%Triton X-100 在37 ℃下孵育10 min,然后分别在激发波长488 nm和发射波长525 nm下用荧光分光光度计测定各孔的荧光强度,计算细胞中ROS水平(ROS水平=试验组荧光强度/空白组荧光强度)。
2.6 夜关门二氯甲烷提取物对细胞中HO-1蛋白表达的影响
采用Western blotting法检测细胞中HO-1蛋白表达水平。将细胞用培养基重悬至密度为1×105 个/mL,接种到6孔板中,每孔1 mL。将细胞置于37 ℃、5%CO2的培养箱中培养24 h。然后将细胞分为空白组、CoPP组(HO-1激动剂,20 μmmol/L)和夜关门二氯甲烷提取物不同质量浓度组(25、 50、100 μg/mL),每组设置3个复孔。空白组细胞不作处理,各给药组细胞分别加入相应药液处理24 h。吸弃培养液,加1 mL冰PBS重悬细胞,将细胞悬液转移至1.5 mL离心管中,以300 r/min离心3 min,吸弃培养液;加入50 μL含蛋白酶和磷酸化蛋白酶抑制剂的RIPA细胞裂解液,于冰上裂解10 min,然后在4 ℃下以15 000 r/min离心20 min,取上清液,置于-80 ℃冰柜中保存,备用。按BCA法测定总蛋白含量。取30 μg总蛋白进行10%~12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),条件为电压120 V、电流300 mA、时间90 min;电转至硝酸纤维素膜上,用TBST缓冲液洗膜3次,室温下用封闭剂(5%的脱脂奶粉)孵育2 h;再用TBST洗3次,加入HO-1、β-actin一抗(1 ∶ 1 000),在室温下以封闭剂孵育1.5 h;TBST洗膜3次,加入HRP标记的二抗(1 ∶ 5 000),在室温下以封闭剂孵育1 h;TBST洗膜3次,以ECL试剂进行显色,利用化学发光成像仪进行分析。通过Gel-Pro Analyzer 4.0软件对蛋白条带灰度进行定量分析,以目标条带灰度值与内参β-actin条带灰度值之比表示目标蛋白的表达水平。
2.7 夜关门二氯甲烷提取物对细胞中Nrf2蛋白表达的影响
2.7.1 Western blotting法检测 按“2.5”项下方法对细胞进行接种和培养后,将细胞分为空白组和夜关门二氯甲烷提取物组,每组设置3个复孔。空白组细胞不作处理,夜关门二氯甲烷提取物组细胞分别用100 μg/mL夜关门二氯甲烷提取物处理不同时间(0.5、1、1.5 h)后,吸弃上清液,加1 mL冰磷酸盐缓冲液(PBS),重悬细胞至1.5 mL离心管中,以300 r/min离心3 min;吸弃培养液,加入20 μL 含蛋白酶和磷酸化蛋白酶抑制剂的细胞质裂解液,于冰上裂解10 min,然后在4 ℃下以15 000 r/min离心20 min,取上清液,即为细胞质蛋白溶液;沉淀加入细胞核裂解液,与细胞质裂解步骤相同,取上清液,即为细胞核蛋白溶液。采用BCA法测定蛋白含量,然后取蛋白按“2.5”项下方法进行电泳试验并分析结果(细胞核中 Nrf2蛋白表达水平测定的内参为Lamin B,细胞质中Nrf2蛋白表达水平测定的内参为β-actin)。
2.7.2 免疫荧光法检测 将细胞用培养基重悬至密度为1×105 个/mL,在6孔板中预先加入12 mm细胞爬片,然后将细胞接种到6孔板中,每孔1 mL。将细胞置于37 ℃、5%CO2的培养箱中培养24 h。然后将细胞分为空白组和夜关门二氯甲烷提取物组,空白组细胞不作处理,夜关门二氯甲烷提取物组细胞用100 μg/mL夜关门二氯甲烷提取物处理1.5 h后,吸弃培养液,用PBS洗3次;用4%多聚甲醛在室温固定20 min,用0.1% Triton X100 孵育10 min,然后用含1%FBS的脱脂奶粉封闭30 min;加入Nrf2一抗(1 ∶ 200),孵育过夜,用PBS冲洗;再加入FITC标记的二抗(1 ∶ 2 000),避光孵育1 h,PBS洗3次;加入DAPI(0.5 mg/mL) 孵育5 min,PBS洗3次。将细胞爬片取出,封片,在荧光显微镜下观察并拍照。绿色荧光为Nrf2阳性染色,蓝色荧光为细胞核染色。
2.8 HO-1基因沉默后夜关门二氯甲烷提取物对谷氨酸诱导细胞损伤的影响
将细胞用培养基重悬至密度为2.5×104个/mL,接种到24孔板中,每孔1 mL。将细胞置于37 ℃、5%CO2的培养箱中培养24 h后,将其分为空白组、模型组、夜关门二氯甲烷提取物组、夜关门二氯甲烷提取物+siRNA HO-1组,每组设置3个复孔。分别将siRNA HO-1与其对照siRNA control样品用无血清和抗体的培养基稀释至浓度为40 nmol/L。之后取LipofectamineTM 2000稀释液1 μL于50 μL培养基中,室温孵育5 min后与上述稀释后的siRNA溶液混合,室温静置20 min,得到转染液。将转染液加入各细胞孔中,每孔100 μL。其中,空白组、模型组与夜关门二氯甲烷提取物组加入siRNA control转染液,夜关门二氯甲烷提取物+siRNA HO-1组加入siRNA HO-1转染液。然后,夜关门二氯甲烷提取物组及夜关门二氯甲烷提取物+siRNA HO-1组分别加入夜关门二氯甲烷提取物(100 μg/mL)处理细胞24 h,空白组不作处理。之后分别按“2.3”~“2.5”項下方法进行细胞存活率及细胞中ROS水平和HO-1蛋白表达的检测,以判断夜关门二氯甲烷提取物是否通过促进HO-1蛋白的表达进而发挥药效。
2.9 統计学方法
采用SPSS 19.0软件对数据进行统计分析,采用GraphPad Prism 5.0软件绘制柱形图。数据以x±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05表示差异有统计学意义。
3 结果
3.1 夜关门不同溶剂提取物的细胞毒性测定结果
当夜关门各溶剂提取物的质量浓度在25~100 μg/mL范围时,对细胞活性均无明显影响;当提取物质量浓度达到200 μg/mL时,均可显著降低细胞的存活率(P<0.05)。这表明在25~100 μg/mL范围内,各溶剂提取物对细胞的毒性较小,故以此质量浓度范围进行后续试验。夜关门不同溶剂提取物对细胞的毒性考察结果见图1。
3.2 夜关门不同溶剂提取物对谷氨酸诱导细胞损伤的影响
与空白组比较,模型组细胞的存活率显著降低(P<0.05)。与模型组比较,阳性对照组和50、100 μg/mL夜关门二氯甲烷提取物组细胞的存活率显著降低(P<0.05),而其余提取物组细胞存活率差异无统计学意义(P>0.05),可见夜关门二氯甲烷提取物对谷氨酸诱导的细胞损伤具有一定的保护作用,故后续试验以夜关门二氯甲烷提取物为研究对象。夜关门不同溶剂提取物对谷氨酸诱导细胞损伤的影响考察结果见图2。
3.3 夜关门二氯甲烷提取物对谷氨酸诱导损伤细胞中ROS水平的影响
与空白组比较,模型组细胞中ROS水平显著升高(P<0.05)。与模型组比较,阳性对照组和50、100 μg/mL夜关门二氯甲烷提取物组细胞中ROS水平显著降低(P<0.05),且夜关门二氯甲烷提取物的作用具有一定的浓度依赖性趋势。各组细胞中ROS水平测定结果见表1。
3.4 夜关门二氯甲烷提取物对细胞中HO-1蛋白表达的影响
与空白组比较,CoPP组和25、50、100 μg/mL夜关门二氯甲烷提取物组细胞中HO-1蛋白表达水平均显著升高(P<0.05),且夜关门二氯甲烷提取物的作用具有一定的浓度依赖趋势。各组细胞中HO-1蛋白表达的电泳图见图3,蛋白表达水平测定结果见表2。
3.5 夜关门二氯甲烷提取物对细胞中Nrf2蛋白表达的影响
与空白组比较,夜关门二氯甲烷提取物不同处理时间组细胞质中Nrf2蛋白表达水平均显著降低(P<0.05),而细胞核中Nrf2蛋白表达水平显著升高(P<0.05)。各组细胞中Nrf2蛋白表达的电泳图见图4,蛋白水平测定结果见表3;免疫荧光染色显微图见图5。
3.6 HO-1基因沉默后夜关门二氯甲烷提取物对谷氨酸诱导细胞损伤的影响
进行si-RNA HO-1转染后,细胞中HO-1蛋白表达水平显著降低(P<0.05),表明si-RNA HO-1转染对HO-1基因发挥了沉默作用。夜关门二氯甲烷提取物可升高谷氨酸诱导损伤细胞的存活率及细胞中ROS水平(P<0.05),而HO-1基因沉默后逆转了夜关门二氯甲烷提取物对谷氨酸诱导损伤细胞的促进增殖以及降低ROS水平的作用(P<0.05)。HO-1基因沉默后各组细胞中HO-1蛋白表达的电泳图见图6,蛋白表达水平测定结果见表4;细胞存活率和细胞中ROS水平测定结果见表5。
4 讨论
谷氨酸引起的神经细胞氧化应激和兴奋性毒性与各类神经退行性疾病的发生、发展有着密切联系。研究发现,高浓度谷氨酸能引起海马组织中谷氨酸转运体及谷氨酸重摄取的功能下降[11]。本研究采用5 mmoL/L谷氨酸诱导小鼠海马细胞HT22发生氧化应激,从而引起细胞损伤及细胞内ROS的产生。用不同溶剂夜关门提取物对细胞进行预处理后,发现夜关门二氯甲烷提取物可以显著抑制由谷氨酸诱导的细胞损伤和ROS的过量生成,这说明夜关门二氯甲烷提取物具有显著的神经保护活性。
HO-1是一种广泛存在的抗氧化防御酶,是热休克蛋白家族中的一个成员,可代谢血红素生成一氧化碳(CO)、胆红素和游离铁。相关研究表明,HO-1及其代谢产物具有神经保护作用[12]。Nrf2是体内调控HO-1表达的重要上游蛋白,在正常状态下,Nrf2与Nrf2的细胞质抑制剂Keap1结合;在受到外界刺激时,Nrf2从复合体中解离出来后,从细胞质转移到细胞核,与HO-1启动子ARE结合,激活HO-1基因表达,从而发挥细胞保护作用[13-15]。本研究发现,夜关门二氯甲烷提取物及CoPP可以诱导细胞中HO-1的表达,同时也可以使细胞中Nrf2活化并从细胞质转移至胞核;而利用si-RNA转染技术进行HO-1基因沉默后,可以逆转夜关门二氯甲烷提取物的上述作用。
综上所述,夜关门二氯甲烷提取物可通过激活谷氨酸诱导小鼠海马细胞的Nrf2信号通路,来诱导细胞中HO-1蛋白的表达,从而发挥其对细胞的保护作用。但本研究结论仍需动物药理学实验等相关研究进一步证实。
参考文献
[ 1 ] LI Z,CHEN X,LU WQ,et al. Wanti-oxidative stress activity is essential for amanita caesarea mediated neuroprotection on glutamate-induced apoptotic HT22 cells and an Alzheimers disease mouse model[J]. Int J Mol Sci,2017,18(8):1623-1637.
[ 2 ] 张徽,王淑静,袁天宇,等.银杏叶提取物对神经退行性疾病作用机制的研究进展[J].药学研究,2020,39(1):37- 40.
[ 3 ] LAI TW,ZHANG S,WANG YT. Excitotoxicity and stro- ke:identifying novel targets for neuroprotection[J]. Prog Neurobiol,2013. DOI:10.1016/j.pneurobio.2013.11.006.
[ 4 ] LUO P,FEI F,ZHANG L,et al. The role of glutamate receptors in traumatic brain injury:implications for postsynaptic density in pathophysiology[J]. Brain Res Bull,2011,85(6):313-320.
[ 5 ] 王东艳,唐超,廖彬汛,等.黔产夜关门的显微特征与其微量元素测定[J].贵州医科大学学报,2018,43(8):37-41.
[ 6 ] 李春晓.土家苗药夜关门功能的本草学相关研究[J].中国中医药咨讯,2011,3(6):30-31.
[ 7 ] 刘英波,刘亮,潘年松,等.苗药夜关门化学成分、药理作用及临床应用研究进展[J].甘肃中医药大学学报,2017,34(4):90-93.
[ 8 ] 侯娟,王春元,李春艳,等.大夜关门总黄酮提纯工艺及体内体外抗氧化研究[J].中国卫生工程学,2016,15(5):421-423.
[ 9 ] 冯华,刘英波,刘亮,等.苗药夜关门不同部位中槲皮素的含量测定及HPLC指纹图谱[J].国際药学研究杂志,2016,43(5):980-984.
[10] 郜红利,涂星,卢映,等.土家苗药夜关门对小鼠实验性失眠的疗效观察与机制初探[J].中成药,2014,36(2) :383-385.
[11] R?SSLER OG,BAUER I,CHUNG HY,et al. Glutamate- induced cell death of immortalized murine hippocampal neurons:neuroprotective activity of heme oxygenase-1,heat shock protein 70,and sodium selenite[J]. Neurosci Lett,2004,362(3):253-260.
[12] MAINES MD. Heme oxygenase:function,multiplicity,regulatory mechanisms,and clinical applications[J]. Faseb Journal,2015,2(10):2557-2568.
[13] KIM KM,PAE HO,ZHENG M,et al. Carbon monoxide induces heme oxygenase-1 via activation of protein kinase R-like endoplasmic reticulum kinase and inhibits endothelial cell apoptosis triggered by endoplasmic reticulum stress[J]. Circ Res,2017,101(9):919-927.
[14] LEE BS,HEO JH,KIM YM,et al. Carbon monoxide mediates heme oxygenase 1 induction via Nrf2 activation in hepatoma cells[J]. Biochem Biophys Res Commun,2016,343(3):965-972.
[15] 蓝升,李金泰,刘毅.自噬在血红素氧合酶1抑制大鼠肝脏缺血/再灌注损伤中的作用[J].中华危重病急救医学,2017,29(3):233-238.
(收稿日期:2019-12-26 修回日期:2020-04-21)
(编辑:林 静)
