MEKK3蛋白K391位点突变对其影响的生物信息学分析及活性鉴定
2020-06-13薄秀梅张荣丽
薄秀梅, 张荣丽, 徐 洲
(1.徐州医科大学基础医学院医学生物实验学分中心,徐州 221004;2.徐州医科大学化学教研室,徐州 221004;3.徐州医科大学江苏省新药研究与临床药学重点实验室,徐州 221004)
MEKK3(mitogen-activated protein kinase/extr acellular signal-regulated kinase kinase kinase 3)是丝裂原活化蛋白激酶(MAPK)信号通路的重要成员,可被一系列细胞外信号(如生长因子、细胞因子、环境应激等)激活[1],通过磷酸化的三级酶促级联反应参与炎症调节、细胞生长及凋亡等生物学过程。其氨基酸序列包含 N-端 Phox1/Bem1p(PB1)结构域,C-端富含丝氨酸/苏氨酸残基的催化结构域(kinase, S-TKc),内含活化环(activation loop,T-loop),诱导T-loop内二聚物的形成可激活JNK、MAPK等,因此二聚化是激活MEKK3磷酸化的重要过程[2]。催化结构域中391位的赖氨酸Lys(K)是一个ATP结合位点,对于MEKK3磷酸化相应底物发挥激酶活性非常重要。磷酸化作用可使MEKK3蛋白结构发生改变,提高与底物的结合度,缓解催化区域位阻[3],从而参与信号分子的活化及信号传递过程。
研究表明,MEKK3参与激活多种神经相关的信号通路[4-6],还与帕金森病的发生及神经血管生成等神经生理病理活动相关[6-8]。MEKK3与下游同样具有PB1结构域的MEK5结合,并将其磷酸化,激活ERK5信号通路[5]。JNK通路是炎症发生过程中重要的信号通路,而炎症是介导神经元坏死的重要因素[9],MEKK3是如何介导JNK通路并诱发炎症性神经系统疾病目前尚无相关报道。该研究采用生物信息学方法分析比较了野生型MEKK3WT及突变型MEKK3K391M蛋白质结构和性质的差异,并检测了其是否可以激活JNK以鉴定其活性,为研究MEKK3的相互作用分子及机制提供实验基础。
1 材料与方法
1.1 主要材料与试剂
大肠杆菌DH5α、pCMV-Tag-2c、PC12细胞本实验室提供;转染试剂Lipofectamine 2000购自Invitrogen公司;抗β-actin、p-JNKs、JNK多抗为Sigma产品,异硫氰酸荧光素酶标记二抗(来源于鼠)为Sigma产品;Protein G PLUS-agarose(sc-2002)为SantaCruz产品;Tris碱,购自Sangon公司;胎牛血清及小牛血清购自Gibco BRL;硝酸纤维素(NC)膜,购自Boehringer Mannheim;各种电泳Protein Marker以及各种限制性内切酶购自MBI公司;总RNA提取试剂盒购于北京天根生化科技有限公司,免疫沉淀试剂盒购于上海碧云天公司。
1.2 方法
1.2.1 引物设计与RT-PCR
根据Genbank中所报道人的MEKK3基因编码序列(NM_203351),用Primer 5.0软件设计上下游引物,同时在预突变的位置设计一对互补碱基引物,并由上海生工生物工程技术服务有限公司合成。其引物的碱基序列如下:
FLAG-MEKK3WT-F′(P1):5′GTCAGAATTCCA ATGGACGAACAGGAGGCATTG 3′
FLAG-MEKK3WT-R′(P2): 5′GTCACTCGAGG TGAGAGCTCAGTACATGAGC 3′
FLAG-MEKK3K391M-F′(P3): 5′GAACTTGCTTCCATGCAGGTCCAATTTG 3′
FLAG-MEKK3K391M-R′(P4): 5′CAAATTGGA CCTGCATGGAAGCAAGTTC 3′
下划线部分分别为EcoR Ⅰ酶切位点G/AATTC与XhoⅠ的酶切位点C/TCGAG。以PC12细胞为材料,提取总RNA,以此为模板用反转录试剂盒进行cDNA的合成,以cDNA为模板用引物(Pl、P2)经RT-PCR扩增出长约1 896 bp的全长片段MEKK3。以反转录的cDNA为模板,用引物(P2、P3)和(P1、P4)经RT-PCR扩增目的片段,获得长约1 200 bp的上游片段和约700 bp的下游片段,用此片段与引物(P1、P4)经重叠延伸PCR法扩增出长约1 896 bp的MEKK3K391M全长片段,取5 μL PCR产物进行1%琼脂糖凝胶电泳分析。当RT-PCR扩增产物以1%琼脂糖凝胶电泳检测发现阳性扩增带后,切下含目的基因的凝胶块,进行PCR扩增产物的纯化,纯化后的产物以1%琼脂糖凝胶电泳检测纯化效果。
1.2.2 构建重组质粒FLAG-MEKK3WT及FLAG-MEKK3K391M
将获得的MEKK3及突变体目的基因片段和质粒(pCMV-Tag-2c)经EcoR I和XholⅠ酶切,酶切片段在DNA连接酶作用下,连入pCMV-Tag-2c载体。产生连接产物:FLAG-MEKK3WT/K391M,取5 μL连接产物加入到制备好的感受态细菌DH5α中,将转化后的200 μL细菌涂在含有相应抗生素的固体培养基上,孵育过夜。待细菌长出后,选取白色菌落在含有相应抗生素的LB培养基中培养。提取质粒,筛选阳性重组子委托上海英俊生物技术有限公司进行DNA序列分析。
1.2.3 真核表达重组质粒在PC12细胞中的表达
取测序正确的阳性重组子转染至PC12细胞,利用DNA中量制备试剂盒抽提需要转染的质粒,电泳分析并将质粒最终浓度调至1 μg/μL,-20 ℃保存用于转染。将PC12细胞传代至60 mm一次性细胞培养皿中。将DNA和脂质体分别加入无血清无双抗的DMEM培养基中,混匀,静置5 min后将DNA与脂质体混合,放置20 min,将已传代的PC12细胞用1 mL无血清无双抗的DMEM培养基清洗一遍,加入DNA与脂质体混合物,再加入1 mL无血清无双抗的DMEM培养基,37 ℃、5% CO2孵育箱内培养4 h。4 h后,再加入2 mL含20%胎牛血清的DMEM培养基,放入37 ℃、5% CO2孵育箱内常规培养。20 h后,将培养基换成含10%小牛血清加药或者不加药的DMEM培养基。常规收集细胞,离心后保存于-20 ℃。
1.2.4 蛋白样品制备及Western-blot免疫印迹分析
将转染后的细胞用PBS收集,离心5 min,弃上清。加入适量含蛋白酶抑制剂的细胞裂解液,超声裂解,离心。收集上清一部分用1×SDS电泳样品缓冲液煮沸变性,-20 ℃保存,另一小部分通过BCA蛋白浓度测定试剂盒检测蛋白浓度。取50 μg蛋白提取物进行聚丙烯酰胺凝胶电泳(电压80 V,200 min)转膜,封闭,PBST洗3次(5 min/次),加一抗4 ℃孵育过夜,PBST洗3次(5 min/次),加二抗25 ℃避光孵育2 h,PBST洗3次(5 min/次),暗室曝光。
实验参照本间智晴的方法设定驯化时间,主要测定放声后鱼群的聚集率(标志框内鱼尾数与总鱼尾数的百分比)。以及放声后鱼群的反应时间和聚集时间。实验驯化时间分为两个阶段,第一阶段为先放声60s,停止放声60s,接着再放声30s后投饵120s,总时间为270s;第二阶段为先放声90s,停止放声60s,再放声30s后投饵120s,总时间为300s。实验天数为12d,每日驯化4次。投饵量参照佐藤靖的研究报告,1次投饵量为15.7g。
1.2.5 生物信息学比较分析
进入GenBank下载人源MEKK3的基因和氨基酸序列。用ProtParam分析MEKK3蛋白质理化性质及稳定性;用ProtScale、TMHMM预测蛋白质的亲/疏水性和跨膜区;借助PredictProtien和Swiss-Model在线预测软件对蛋白质的二级和三级结构进行预测分析,用Swiss-Pdb Viewer 3.7软件分析定点突变对MEKK3三级结构的影响。PROVEAN[10]预测氨基酸替换对蛋白质生物功能的影响。
2 结果与分析
2.1 MEKK3蛋白的理化性质分析和预测
借助ProtParam软件对MEKK3蛋白进行理化性质预测,并与MEKK3K391M进行比对。人MEKK3蛋白由626个氨基酸组成,相对分子质量约为71 kD,蛋白质等电点为9.02,说明MEKK3是碱性蛋白质。在哺乳动物网织红细胞中预测的半衰期为30 h、酵母体内大于20 h、大肠杆菌细胞内大于10 h,不稳定系数是59.97,高于40,根据不稳定指数的判断标准[11],推测MEKK3为不稳定蛋白。疏水性平均值为-0.699,表明是亲水蛋白质。对MEKK3K391M进行预测,显示相对分子质量不变;蛋白质等电点为8.95,与野生型蛋白大致相同;疏水性平均值为-0.690,点突变并未改变蛋白质亲/疏水性;蛋白的不稳定系数为59.47,虽然也高于40,但比野生型蛋白不稳定值稍低。
2.2 预测与分析MEKK3WT与MEKK3K391M蛋白亲/疏水性和跨膜区
使用ProtScale(https://web.expasy.org/protscale/)对MEKK3WT蛋白进行亲/疏水性分析,结果显示,MEKK3WT蛋白亲水性最强位点是289位的天冬酰胺(asparagine, N),分值为-3.144;疏水性最强的位点是576位的异亮氨酸(iosle ucine, I),分值为1.889。MEKK3WT蛋白亲/疏水肽链分布在整个序列中是亲水蛋白。突变蛋白MEKK3K391M亲/疏水性的最强位点均未改变,如图1所示。用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)软件对MEKK3WT蛋白进行跨膜区分析,结果显示,MEKK3WT蛋白626个氨基酸残基全部在膜外,不存在跨膜区域,突变体MEKK3K391M蛋白跨膜区与MEKK3WT蛋白一致,如图2所示。
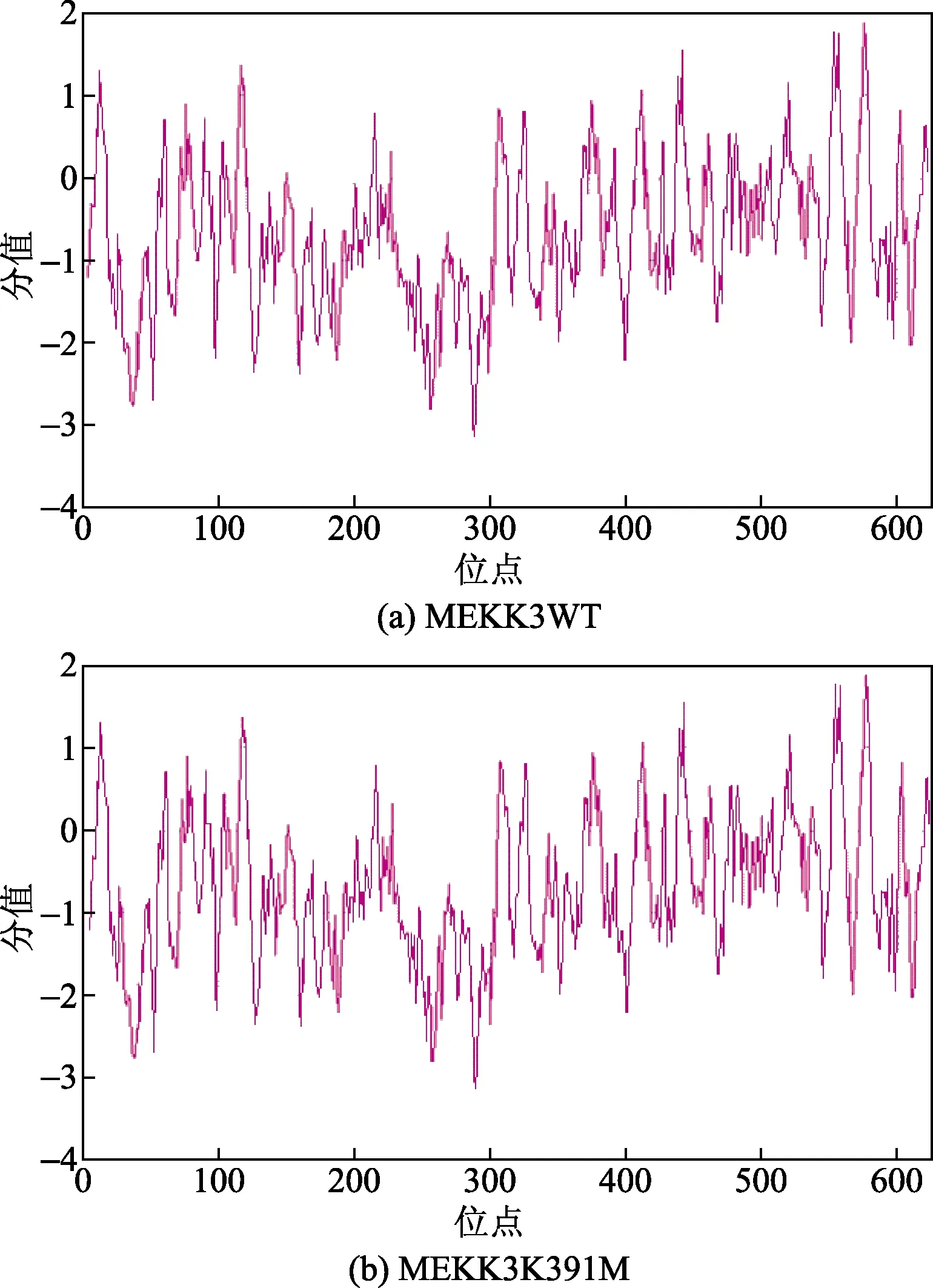
图1 MEKK3WT与MEKK3K391M蛋白的亲/疏水性
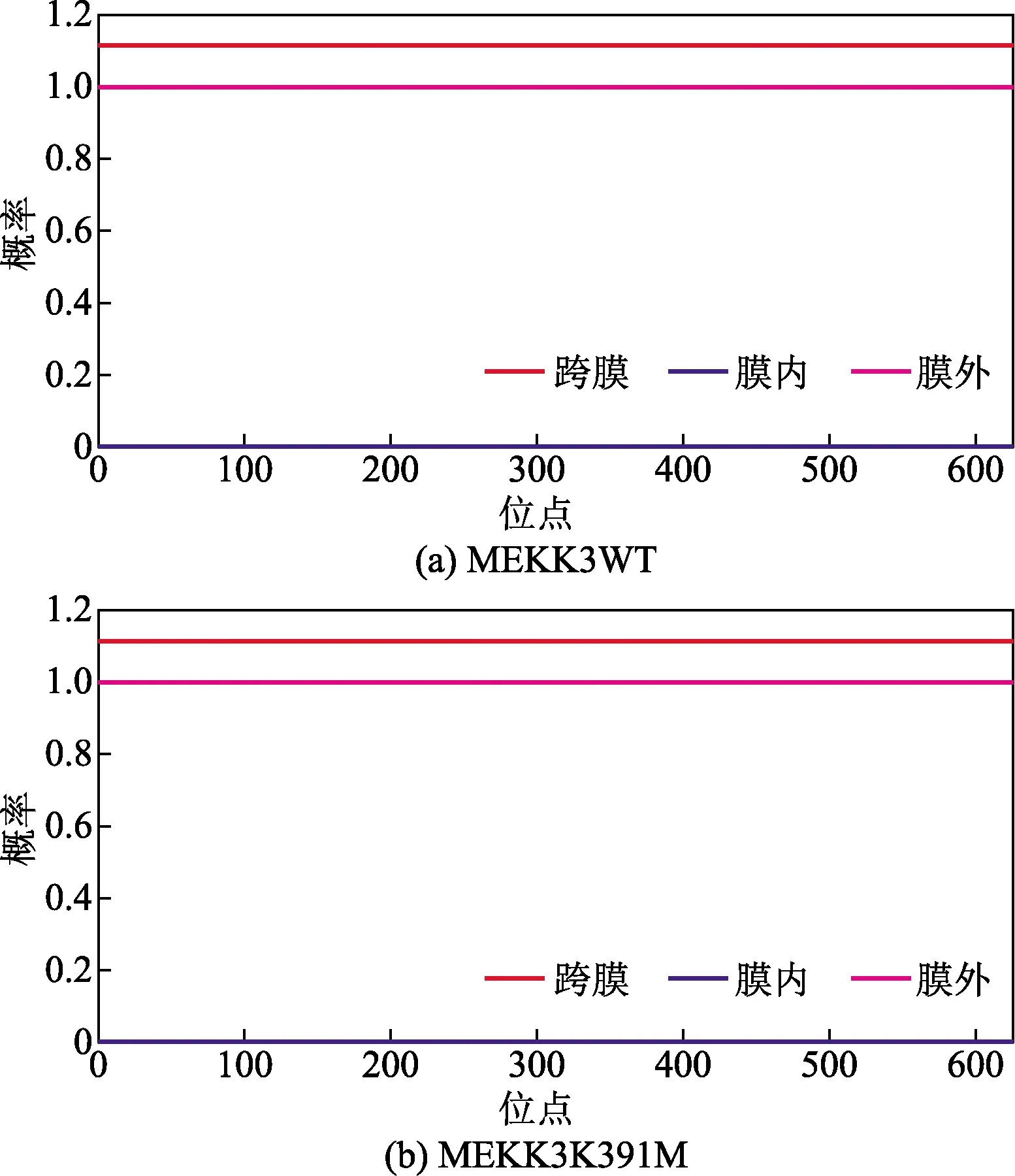
图2 MEKK3WT与MEKK3K391M蛋白的跨膜区域预测
2.3 MEKK3WT与MEKK3K391M蛋白二级结构的预测和分析
PredictProtien(https://www.predictprotein.org/)在线预测MEKK3蛋白的二级结构,发现该蛋白含有14个α-螺旋和17个β-折叠,α-螺旋和β-折叠的氨基酸比率分别为18.69%和14.38%。MEKK3K-391M的α-螺旋和β-折叠分别变为13个和21个,在 3~418位点MEKK3蛋白形成4个螺旋区(3~18、66~76、99~106、403~417),MEKK3K391-M蛋白形成3个螺旋区(3~17、66~76、402~418);在537~561位点MEKK3蛋白形成2个螺旋区(537~538、553~561),MEKK3K391M蛋白形成3个螺旋区(555、557~558、560~560);在607~616位点MEKK3蛋白只有1段螺旋(613~616)而MEKK3K391M分为2段螺旋(607、613~616);在44~417位点,MEKK3蛋白形成5个β-折叠(44~49、55~58、81~87、99~106、403~417),而MEKK3K391M形成9个(46~51、57~59、83~85、90~91、118~120、360~364、367~367、375~381、387~395);MEKK3蛋白在590~616处形成4个β-折叠(590~592、594~602、607、613~616),而MEKK3K391M没有。二级结构分析显示,两者的蛋白结合位点有变化,MEKK3蛋白有13个蛋白结合位点,MEKK3K391M有17个蛋白结合位点,比MEKK3蛋白多了66、96、124~126、175、222、261、292~293、300、521位点,而少了22、34、173~174、364位点,如图3所示。
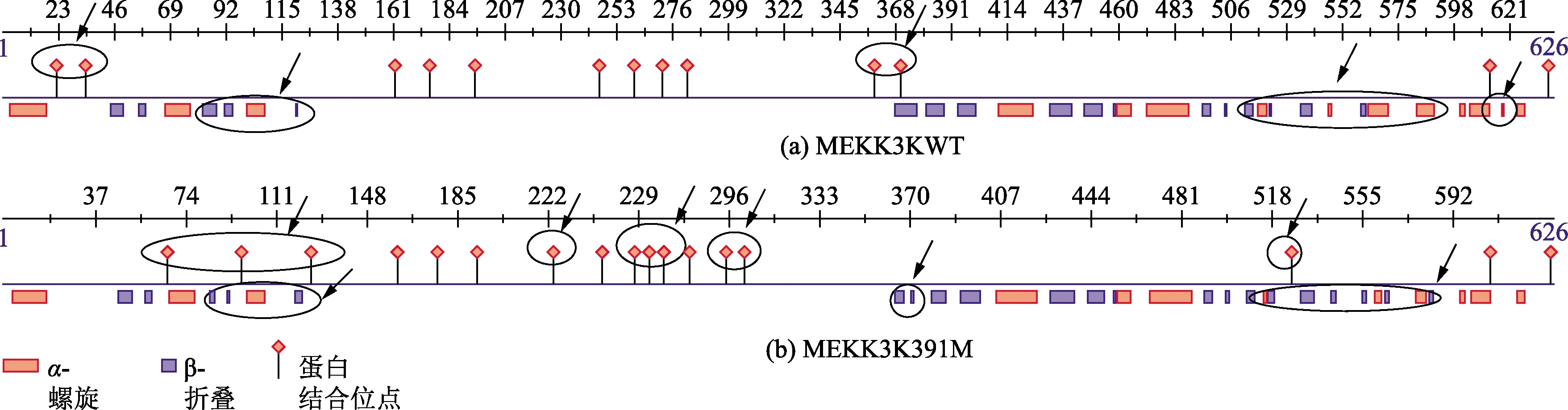
○为两者不同处
2.4 MEKK3WT与MEKK3K391M蛋白的结构域和三级结构分析
采用PROSITE(www.expasy.org/prosite)软件预测分析MEKK3蛋白含有PB1结构域和蛋白激酶结构域(protein kinase domain),PB1结构域含有80个氨基酸残基(Asp44~Gln123),蛋白激酶结构域含有261个氨基酸残基(Trp362~Ala622),蛋白激酶结构域中含有许多ATP结合位点,其中Leu368、Gly369、Gln370、Gly371、Ala372、Phe373、Gly374、Arg375、Val376组成核苷酸结合区域,Lys391为氨基酸与化学物质相互作用的位点,Asp489位点具有酶活性直接参与催化作用。MEKK3K391M蛋白Leu368~Val376无核苷酸结合功能,Met391位点不能与化学物质相互作用,具有酶活性的位点Asp489也无催化功能,如图4所示。分析表明,Lys391突变为Met391,该位点失去与化学物质的结合能力。
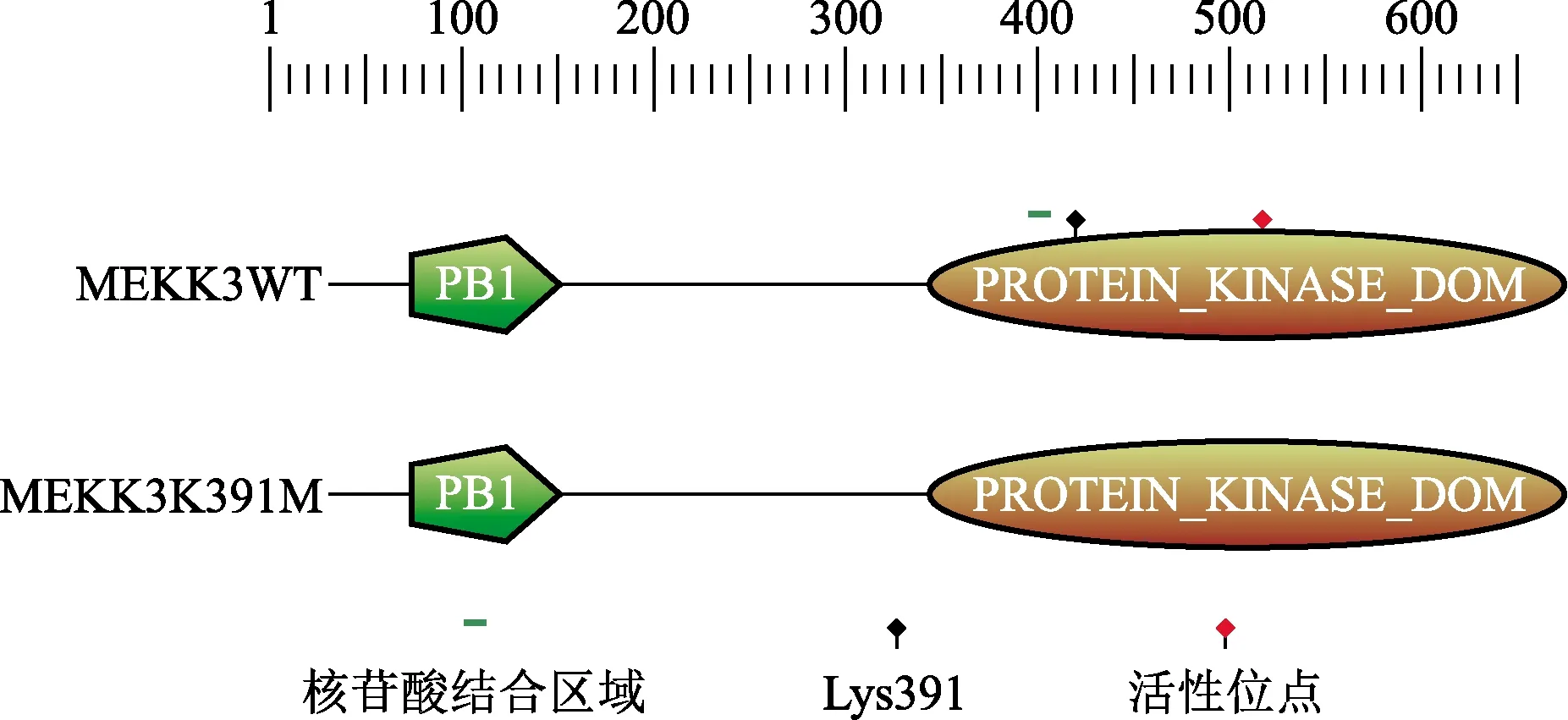
图4 MEKK3WT与MEKK3K391M蛋白的结构域
2.5 MEKK3WT与MEKK3K391M蛋白三级结构的预测和分析
将MEKK3蛋白序列输入蛋白三级结构在线预测平台Swiss Model(https://www.Swissmodel.expasy.org/)后,对蛋白进行同源建模,如图5(a)所示。进一步分析MEKK3蛋白的氨基酸序列与模型蛋白质相似性波形图,预测结构的波形较稳定且大部分的氨基酸残基分值不低于0.6,该模型趋近真实情况,如图5(b)所示。使用Swiss-Pdb Viewer 3.7软件分析预测MEKK3蛋白三级结构空间位阻的变化。MEK-K3蛋白K391突变为M391后,侧链基团形成的氢键并无变化,但是靠近反应中心的原子侧链占有的空间位置变大,增大了空间位阻,如图6所示。利用PROVEAN(http://provean.jcvi.org/index.php)预测单一氨基酸替换对MEKK3蛋白质功能区的影响,设定阈值为-2.5,其准确度(balanced acurracy)达到77.9%。此时发现突变型K391M的得分(PROVEAN score)为-5.394,小于-2.5,表示该突变为有害突变。
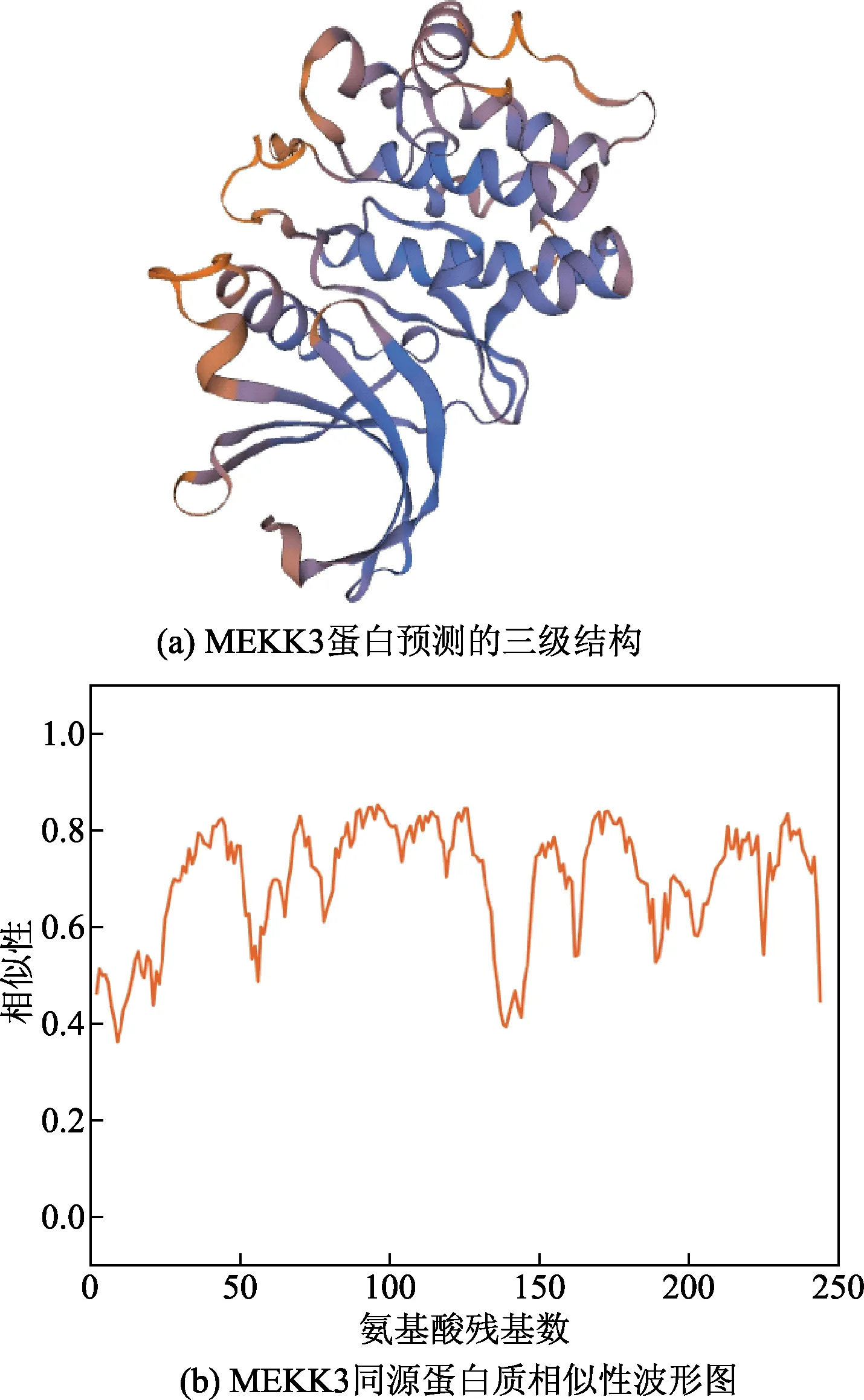
图5 MEKK3蛋白三级结构及其同源蛋白质相似性波形图

□为突变位点在MEKK3三级结构中的位置;→表示 LYS391侧链基团;→表示MET391侧链基团
2.6 MEKK3相互作用蛋白分析
分析可知,与MEKK3相互作用的大部分是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族成员,它们之间也存在紧密的相互作用关系。
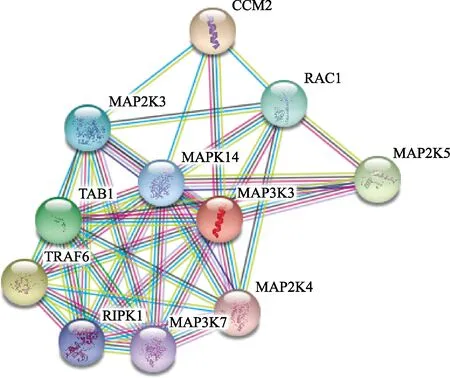
图7 MEKK3蛋白的相互作用
2.7 MEKK3WT和MEKK3K391M重组体构建
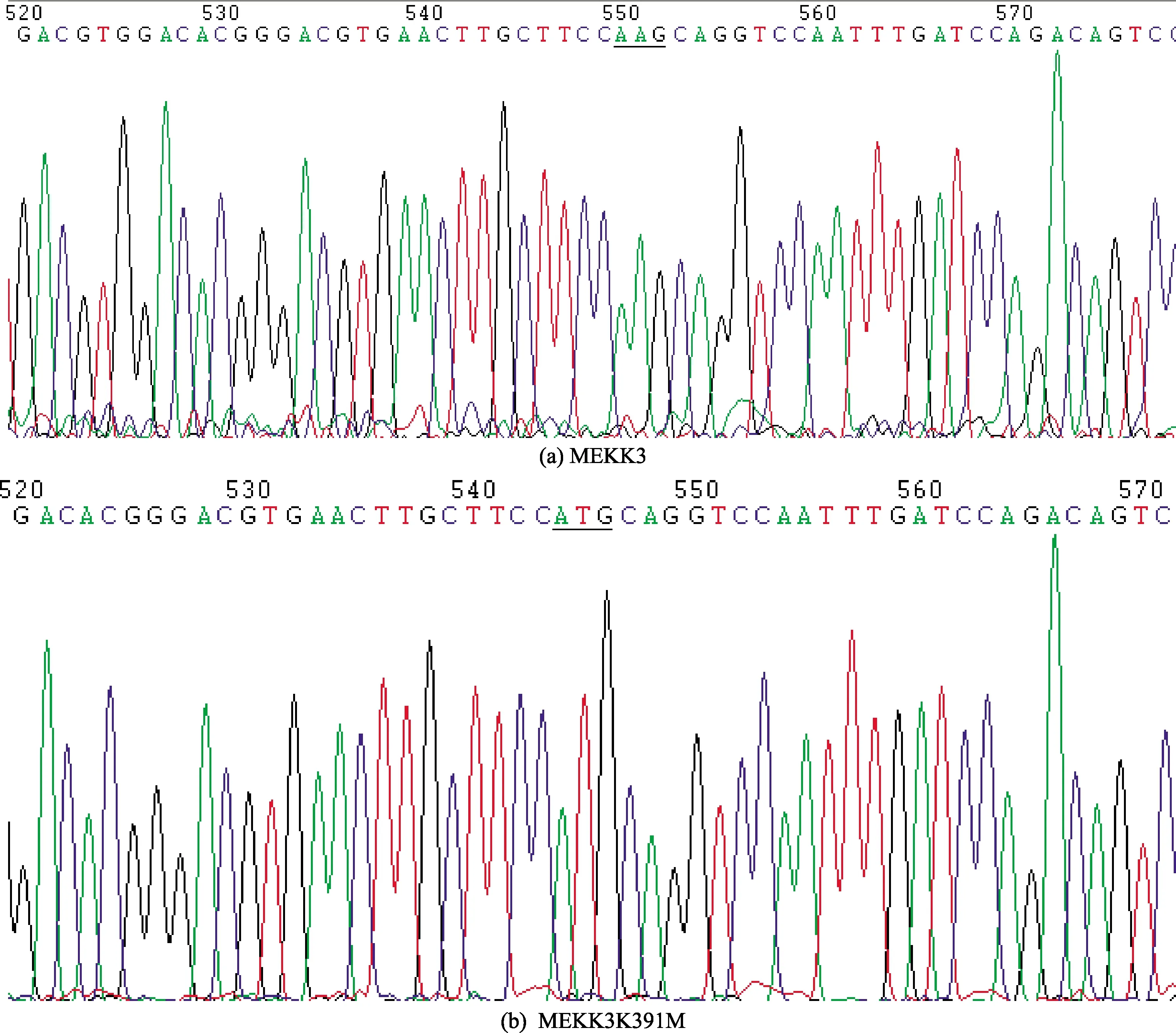
图8 MEKK3和MEKK3K391M测序结果(部分)
以PC12细胞提取的总RNA为模板,用RT-PCR的方法获得MEKK3全长cDNA,经重叠延伸PCR获得MEKK3K391M全长cDNA,构建重组质粒FLAG-MEKK3/K391M,筛选阳性重组子测序分析,2个重组子测序结果表明:FLAG-MEKK3与GenBank登记的序列完全一致;FLAG-MEKK3K391M成功将编码391位赖氨酸(Lys)的密码子AAG突变为编码甲硫氨酸(Met)的密码子ATG,与预期结果完全一致,测序结果(部分)如图8所示。
2.8 MEKK3WT和MEKK3K391M在PC12细胞中的表达
转染FLAG-MEKK3WT和FLAG-MEKK3K391M的PC12细胞,经细胞裂解液处理,SDS-PAGE分离后,以抗MEKK3的抗体进行免疫印迹分析。结果表明,FLAG-MEKK3WT和FLAG-MEKK3K391M均得到高效表达,如图9所示。
2.9 MEKK3WT和MEKK3K391M蛋白生物活性鉴定
将MEKK3WT和MEKK3K391M重组体转染PC12细胞,提取细胞总蛋白,进行免疫印迹分析,结果表明,JNK蛋白表达在MEKK3组和MEKK3K391M没有明显变化,而P-JNK在MEKK3组的条带明显深于对照组和MEKK3K391M组。
而P-JNK含量在MEKK3K391M组与对照组中相差不大。结果表明,过表达MEKK3激酶能激活JNK,使JNK发生磷酸化反应,P-JNK含量升高。而MEKK3K391M失去活性,无法激活JNK,如图10所示。
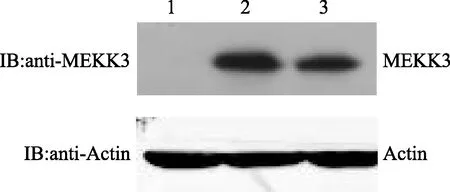
1为control(vector);2为MEKK3WT;3为MEKK3K391M
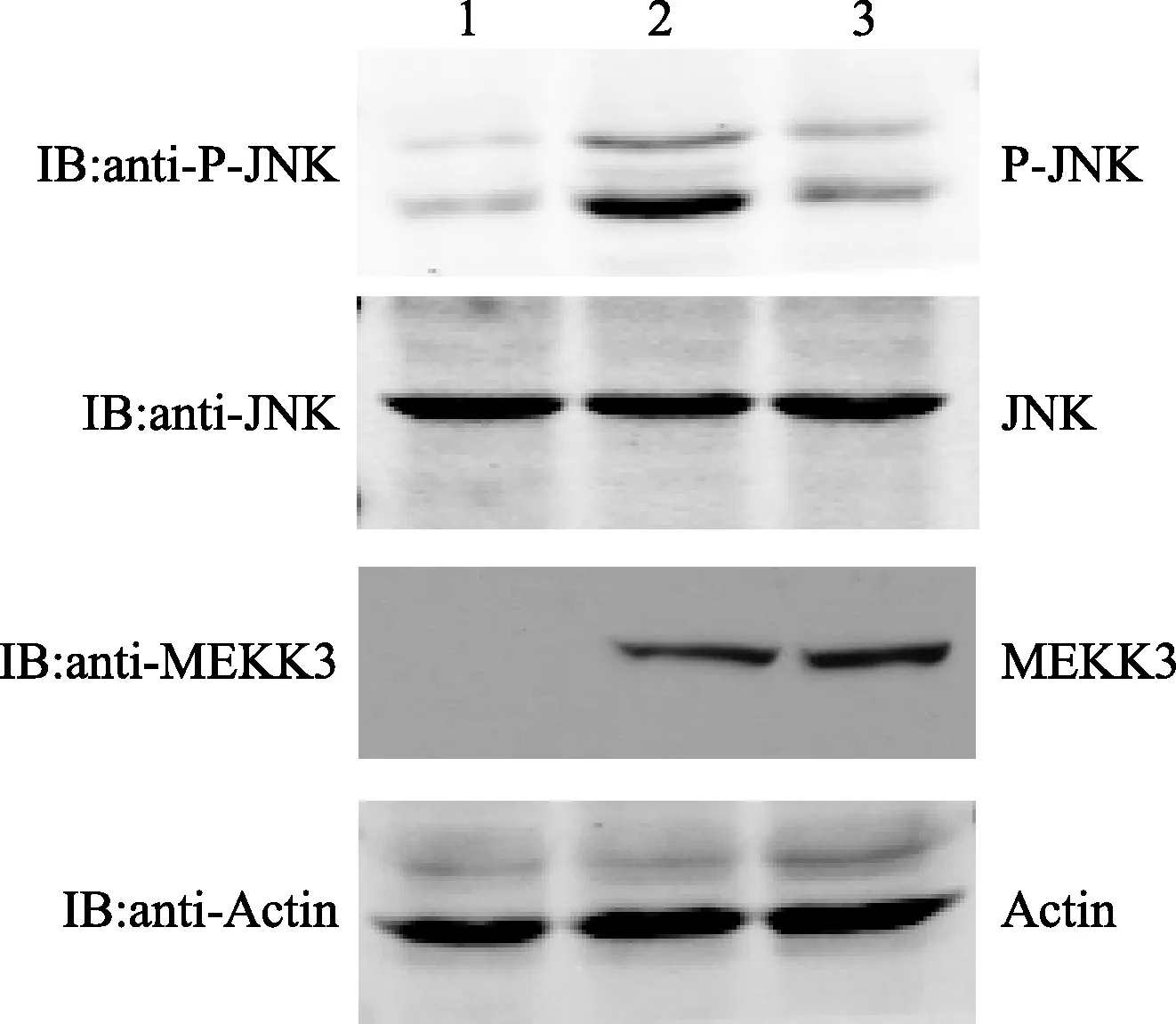
1为control(vector);2为MEKK3;3为MEKK3K391M
3 讨论
利用生物信息学手段分析预测了MEKK3蛋白的理化性质及跨膜区,结果表明MEKK3是碱性、亲水性蛋白质,MEKK3定点突变后其蛋白质亲水性以及跨膜区未改变,而稳定性有所增强。对MEKK3蛋白及突变体二/三级结构分析表明,MEKK3K391M中激酶活性位点的改变影响了α-螺旋区和β-折叠在蛋白质中的分布,同时该位点失去与化学物质结合的能力。MEKK3蛋白K391突变为M391,靠近反应中心的原子侧链占有的空间位置变大,增大了空间位阻,导致MEKK3与ATP结合的难度加大,从而无法呈递磷酸基团催化相应的底物,MEKK3蛋白处于永久失活状态。PROVEAN预测K391M的突变为有害突变。以上生物信息学分析预测表明突变后的MEKK3可能无法结合并催化相应底物,失去生物学活性。进一步研究发现与MEKK3相互作用的蛋白质大部分为丝裂原活化蛋白激酶家族成员,结合生物信息学分析推测其主要作用方式是磷酸化并激活相应蛋白底物,进行信号传递。随后,利用分子生物学手段构建了MEKK3突变体MEKK3K391M,MEKK3可以激活JNK,产生P-JNK,而MEKK3K391M无法激活JNK。为进一步研究MEKK3在JNK通路中发挥的作用奠定了基础。
作为一种蛋白激酶,MEKK3分子内特殊位点的磷酸化是其行使功能的必要条件,大量研究证实,MEKK3存在多个磷酸化位点。Thr294位点的磷酸化可使14-3-3蛋白与MEKK3相互作用,从而抑制核转录因子NF-κB的激活[12]。在脂多糖(lipopolysaccharide,LPS)的刺激下,Ser526位点可被磷酸化,诱导IL-6的产生[13]。Ser526是活化环内一个自身磷酸化位点,其磷酸化作用可诱导NF-κB、ERK、JNK或p38的激活,而MEKK3K391M无法在此位点磷酸化,表明K391是MEKK3的活化关键位点[14]。在胚胎发育早期,内皮细胞向间充质细胞转换过程中MEKK3发挥了重要作用[15],MEKK3K391M组间充质细胞的生成减少。同时,在外植体中检测到,MEKK3K391M组细胞凋亡蛋白比对照组高两倍,表明MEKK3K391M可促进细胞凋亡。MAPK信号通路被认为与炎症调节、细胞生长及凋亡等生物学过程有关。近年来研究发现,在神经退行性疾病如阿尔茨海默病(AD),帕金森氏病(PD)中,神经炎症发挥了重要的作用[16],用脂多糖(lipopolysaccharide,LPS)处理BV2细胞,脑组织特异性表达的microRNA-124显著下降,过表达microRNA-124,MEKK3/NF-κB信号通路被抑制,引起小胶质细胞的活化,抑制神经炎症的发生[6]。在许多信号通路中,MEKK3可以与一些蛋白分子相互作用,形成复合体,在JNK信号通路中发挥重要作用。脂肪组织炎症中,MEKK3与同样具有PB1结构域的蛋白NBR1之间的相互作用形成信号复合物,激活JNK[17]。MEKK3与WDR62形成复合物并将其磷酸化,激活JNK,控制神经系统的生成[8]。MEKK3是IL-1R-TLR4信号传导通路中MyD88-IRAK-TRAF6复合物的必须信号传导,在IL-1和LPS刺激下诱导产生NF-κB、JNK。在MEKK3基因敲除的小鼠胚胎成纤维细胞中,Toll样受体8(Toll-like receptor8,TLR8)介导的NF-κB、ERK、JNK的激活完全被阻断[18],因此TLR8激活JNK需依赖MEKK3的活化。然而在神经损伤性疾病中,MEKK3激活JNK通路涉及众多蛋白,其底物蛋白需要进一步研究。
JNK作为炎症反应的重要信号传导通路对大脑中神经元的凋亡或退化有重要影响[19]。在脂多糖(lipopolysaccharide,LPS)诱导的神经系统疾病中,JNK被激活[20],炎症在缺血性脑卒中的发病机制中起着至关重要的作用,脑缺血时,受损血脑屏障内的小胶质细胞和浸润的巨噬细胞被激活。缺血性脑卒中后小胶质细胞M1/M2表型的调控对脑修复至关重要。用脂多糖刺激小胶质细胞,茴香醇(对甲氧苄醇,PMBA)可通过抑制NF-κB激活和JNK的磷酸化抑制炎症因子以及修复脑缺血的炎症损伤[21]。芦丁通过调节新生大鼠海马JNK和p38 MAPK通路,减轻异氟醚诱导的神经凋亡[22]。JNK通路可以被许多蛋白分子调控,在阿尔茨海默氏症转基因小鼠模型中,JNK和p38通路可被Cdk5/Rac1蛋白激酶复合体调控[23]。因此,寻找JNK上游调控因子,抑制JNK信号通路对于治疗神经系统疾病具有重要的意义。
4 结论
MEKK3中Lys391的氨基酸置换引起了蛋白结构和功能的改变,表现在α-螺旋、β-折叠的数量和位置变化、结合化学物质和催化能力降低、侧链基团空间位阻变大等,突变蛋MEKK3K391M与ATP结合的难度加大,从而无法呈递磷酸基团催化相应的底物,失去生物学活性,随后的活性鉴定实验表明,野生型MEKK3可以激活JNK,而MEK-K3K391M不能。研究成果对于进一步探索在神经系统疾病中与MEKK3相互作用的蛋白以及MEKK3如何调控JNK信号通路提供实验基础,也将为神经损伤性疾病的研究提供新的方向。
