白及Aux/IAA基因的鉴定及分析
2020-06-12刘厚伯上官艳妮黄恻隐郑明辉徐德林
刘厚伯,李 春,李 林,上官艳妮,黄恻隐,刘 怡,郑明辉,徐德林,①
(1.遵义医科大学 细胞生物学教研室,贵州 遵义 563099;2.河南省农业科学院 芝麻研究中心,河南 郑州 450002)
生长素又称吲哚乙酸(indoleacetic acid,IAA),在植物生长发育过程中具有重要作用,不但能调节植物细胞和器官的生长发育[1],还能够单独或与其他激素协同作用参与植物对环境胁迫的应激反应[2-3]。Aux/IAA基因可调控生长素信号转导过程[4],且Aux/IAA蛋白具有4个保守结构域,其中,Domain Ⅰ具有转录抑制功能,包含1个两亲性基序LxLxLx[5];Domain Ⅱ具有稳定蛋白质结构的作用,含有蛋白质泛素化降解的靶位点,核心序列为VGWPP;Domain Ⅲ和Domain Ⅳ负责蛋白质的二聚化[6],前者含有βαα基序[1],后者含有酸性区域和SV40核定位序列(NLS,PKKKRKV)[6]。研究表明:Aux/IAA基因可参与调控植物生长发育,并可调控植物体内多个信号转导通路[7-12],为近年的研究热点。
白及〔Bletillastriata(Thunb.ex A.Murray)Rchb.f.〕为多年生草本植物,具有抗菌、止血和抗肿瘤等功效[13],且观赏价值较高[14]。近年来,随着环境不断恶化和人类过度采挖,白及的野生资源越来越少,加上其人工培育品种质量参差不齐[15]、遗传背景不清,严重制约了白及的研究和开发利用。由于Aux/IAA基因对植物的生长发育和遗传改良有重要作用,因此,有必要对其Aux/IAA基因进行研究。
鉴于此,基于白及的全转录组数据,作者采用生物信息学方法对白及Aux/IAA基因进行分析,以期为白及Aux/IAA基因的表达调控和功能鉴定以及白及生长繁育相关代谢途径研究提供基础资料。
1 材料和方法
1.1 材料
以采自贵州省正安县的白及成熟种子萌发获得的组培苗为实验材料。从拟南芥〔Arabidopsisthaliana(Linn.)Heynh.〕信息资源(TAIR)数据库(https:∥www.arabidopsis.org/)中获得拟南芥Aux/IAA蛋白序列,并从NCBI数据库(https:∥www.ncbi.nlm.nih.gov/)中获得铁皮石斛(DendrobiumofficinaleKimura et Migo)Aux/IAA蛋白序列。
1.2 方法
1.2.1 样品采集 随机采集组培苗的原球茎、移栽前组培苗(包括根、茎和叶)、移栽2个月的组培苗(包括根、茎和叶)及移栽1年后的组培苗(包括根、茎、叶、花和种子),每个阶段采集的组培苗均为同一区域内形状、色泽和大小基本一致的植株,各采集3株。采集后迅速运回实验室,提取单株总RNA,用液氮速冻后保存于-80 ℃冰箱中。
1.2.2 基因鉴定和序列分析 经质量检测合格后,将不同生长时期所有的单株总RNA进行等量混合,先进行转录组测序,再拼接组装成unigenes[16]。利用BLASTp工具进行比对搜索(设置缺省参数),手动去除错配序列;利用Pfam 32.0在线软件(http:∥pfam.xfam.org/)检索白及的转录组序列(登录号PF02309),对检索结果进行整合和去冗余,并去除不完整序列,得到候选序列;利用ORFfinder在线软件(https:∥www.ncbi.nlm.nih.gov/orffinder/)分析上述序列的开放阅读框(ORF)。利用SMART(http:∥smart.embl-heidelberg.de/)和InterPro(http:∥www.ebi.ac.uk/interpro/)在线软件分析白及Aux/IAA蛋白的保守结构域。
1.2.3 蛋白质序列分析 利用ProtParam在线软件(https:∥web.expasy.org/protparam/)分析预测白及Aux/IAA蛋白的理论相对分子质量、理论等电点、不稳定指数、脂肪族氨基酸指数和总平均亲水性等理化性质;利用Plant-mPLoc server在线软件(http:∥www.csbio.sjtu.edu.cn/bioinf/plant-multi/#)进行蛋白质的亚细胞定位;利用SOPMA在线软件(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析蛋白质的二级结构;运用MEME 5.0.5在线软件(http:∥meme-suite.org/)分析蛋白质的基序,设定基序宽度最大值为50,基序数为20[17],其余参数为默认值;利用DNAMAN v9软件对蛋白质的保守结构域进行比对。
1.2.4 GO功能分类和KEGG富集分析 利用String在线软件(https:∥string-db.org/)对白及Aux/IAA蛋白的氨基酸序列进行GO功能分类和KEGG富集分析,以1×10-5为界限[16]。
1.2.5 系统发育分析 利用MEGA 7.0软件的Clustal W程序,采用邻接法构建模式植物拟南芥32条Aux/IAA蛋白已知序列、近缘植物铁皮石斛16条Aux/IAA蛋白已知序列和白及Aux/IAA蛋白预测序列的系统发育树,并进行自举评估(bootstrapping),重复检测1 000次,其他参数为默认值。
2 结果和分析
2.1 基因鉴定及序列分析
研究结果表明:在拼接组装的132 502条unigenes中,共发现142条unigenes与生长素有关;经过对Pfam检索结果的整合、去冗余和去除不完整序列,共筛选出5个Aux/IAA基因,按照其在白及转录组中对应序列的ID顺序依次命名为BsAux/IAA1、BsAux/IAA2、BsAux/IAA3、BsAux/IAA4和BsAux/IAA5,序列长度分别为5 985、2 427、942、879和780 bp,开放阅读框(ORF)长度分别为2 739、1 053、537、492和492 bp。
2.2 蛋白质序列分析
2.2.1 一级和二级结构分析 蛋白质一级结构分析结果(表1)表明:BsAux/IAA1、BsAux/IAA2、BsAux/IAA3、BsAux/IAA4和BsAux/IAA5的氨基酸残基数为163~912。上述5个BsAux/IAA蛋白的理论相对分子质量为18 172.97~101 442.89,理论等电点为pI4.40至pI11.51,且BsAux/IAA1、BsAux/IAA3、BsAux/IAA4和BsAux/IAA5的pI值小于7,据此推测这4个BsAux/IAA蛋白可在酸性亚细胞环境中发挥作用。上述5个BsAux/IAA蛋白中,BsAux/IAA2和BsAux/IAA4的不稳定指数较低(分别为33.17和33.14),其余3个BsAux/IAA蛋白的不稳定指数较高(48.10~63.81),据此判定BsAux/IAA2和BsAux/IAA4为稳定蛋白(不稳定指数小于40[18]),其余3个BsAux/IAA蛋白为不稳定蛋白(不稳定指数大于40[18])。脂肪族氨基酸指数能够反映蛋白质的热稳定性,上述5个BsAux/IAA蛋白的脂肪族氨基酸指数为69.45~79.63,说明这5个BsAux/IAA蛋白的热稳定性较高。疏水性分析结果表明:上述5个BsAux/IAA蛋白的总平均亲水性为-0.577~-0.006,说明这5个BsAux/IAA蛋白为亲水性蛋白。亚细胞定位结果表明:5个BsAux/IAA蛋白均定位于细胞核中。
蛋白质二级结构分析结果(表2)表明:BsAux/IAA1、BsAux/IAA3和BsAux/IAA5均表现为无规则卷曲所占比例最大,α-螺旋所占比例次之,延伸链所占比例较小,β-转角所占比例最小;而BsAux/IAA2则表现为α-螺旋所占比例均最大,无规则卷曲所占比例次之,延伸链所占比例较小,β-转角所占比例最小;BsAux/IAA4表现为无规卷曲所占比例最大,延伸链所占比例次之,α-螺旋所占比例较小,β-转角所占比例最小。
表1 白及Aux/IAA蛋白的一级结构分析
Table 1 Analysis on primary structure of Aux/IAA proteins ofBletillastriata(Thunb.ex A.Murray)Rchb.f.
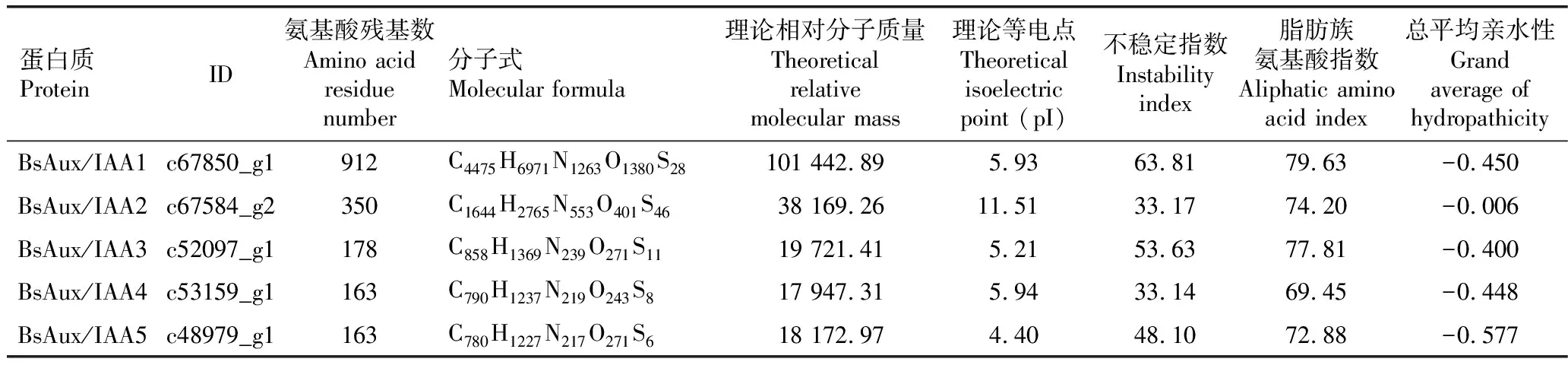
蛋白质ProteinID氨基酸残基数Amino acid residue number分子式Molecular formula理论相对分子质量Theoretical relative molecular mass理论等电点Theoretical isoelectric point (pI)不稳定指数Instability index脂肪族氨基酸指数Aliphatic amino acid index总平均亲水性Grand average of hydropathicityBsAux/IAA1c67850_g1912C4475H6971N1263O1380S28101 442.895.9363.8179.63-0.450BsAux/IAA2c67584_g2350C1644H2765N553O401S4638 169.2611.5133.1774.20-0.006BsAux/IAA3c52097_g1178C858H1369N239O271S1119 721.415.2153.6377.81-0.400BsAux/IAA4c53159_g1163C790H1237N219O243S817 947.315.9433.1469.45-0.448BsAux/IAA5c48979_g1163C780H1227N217O271S618 172.974.4048.1072.88-0.577
表2 白及Aux/IAA蛋白的二级结构分析
Table 2 Analysis on secondary structure of Aux/IAA proteins ofBletillastriata(Thunb.ex A.Murray)Rchb.f.
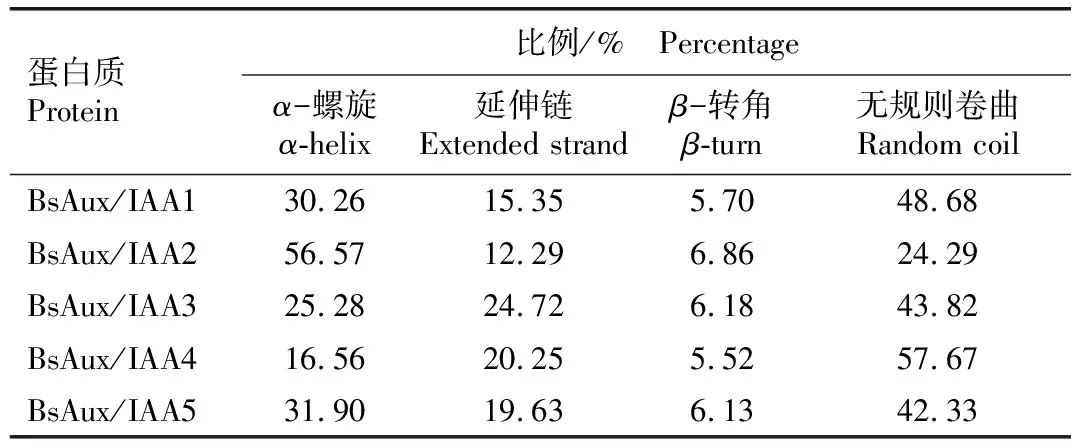
蛋白质Protein比例/% Percentageα-螺旋α-helix延伸链Extended strandβ-转角β-turn无规则卷曲Random coilBsAux/IAA130.2615.355.7048.68BsAux/IAA256.5712.296.8624.29BsAux/IAA325.2824.726.1843.82BsAux/IAA416.5620.255.5257.67BsAux/IAA531.9019.636.1342.33
2.2.2 基序和保守结构域分析 蛋白质保守性分析结果(图1、图2、图3和表3)表明:5个BsAux/IAA蛋白共有20个motif,分别命名为motif1至motif20,其中motif1、motif2、motif3和motif9为保守基序;但是,仅BsAux/IAA1具有4个完整的典型保守结构域,分别为Domain Ⅰ、Domain Ⅱ、Domain Ⅲ和Domain Ⅳ,依次对应保守基序motif9、motif3、motif2和motif1。并且,5个BsAux/IAA蛋白均含有motif1,BsAux/IAA3至BsAux/IAA5均含有motif2,BsAux/IAA2至BsAux/IAA4均含有motif3,BsAux/IAA3和BsAux/IAA4均含有motif9,其余基序只存在于2个BsAux/IAA蛋白中。上述结果表明:motif1为BsAux/IAA蛋白中非常重要的保守基序。

不同色块的长度和顺序分别代表各基序在蛋白质序列中的实际大小和位置The length and order of the boxes with different colors represent the actual size and location of each motif in protein sequence,respectively.
图1 白及Aux/IAA蛋白的基序序列(A)及位置(B)
Fig.1 Motif sequence(A)and location(B)of Aux/IAA proteins ofBletillastriata(Thunb.ex A.Murray)Rchb.f.

不同色块的长度和顺序分别代表各基序在蛋白质序列中的实际大小和位置The length and order of the boxes with different colors represent the actual size and location of each motif in protein sequence,respectively.
图2 白及Aux/IAA蛋白的基序标志及共有基序
Fig.2 Motif symbol and consensus of Aux/IAA proteins ofBletillastriata(Thunb.ex A.Murray)Rchb.f.

下划线示保守域The underlines represent conserved domains.黑色、红色和蓝色分别表示同源性100%、75%~100%和50%~75%的氨基酸残基Black,red,and blue represent the amino acid residues with homology of 100%,75%-100%,and 50%-75%,respectively.
图3 白及Aux/IAA蛋白的结构域分析
Fig.3 Analysis on domains of Aux/IAA proteins ofBletillastriata(Thunb.ex A.Murray)Rchb.f.
表3 白及Aux/IAA蛋白的基序分布
Table 3 Motif distribution of Aux/IAA proteins ofBletillastriata(Thunb.ex A.Murray)Rchb.f.

基序Motif氨基酸残基数Amino acid residue number序列Sequence对应结构域Corresponding domainmotif133YAJAYEDREGDWMLVGDVPWEMFISNCRRLRIMDomain Ⅳmotif238IFVKVSMDGAPYLRKIDLKVYDGYEELRDALEDMFKCFDomain Ⅲmotif319KAQVVGWPPVRSNRRNSFQDomain Ⅱmotif99TELRLGLPGDomain Ⅰ
2.2.3 GO功能分类和KEGG富集分析 GO功能分类(表4)结果表明:5个BsAux/IAA蛋白的功能均包含细胞组分、生物学过程和分子功能3个大类。在细胞组分大类中,5个BsAux/IAA蛋白均被注释到细胞核和细胞器;在生物学过程大类中,被注释到信号通路、发育过程、细胞过程、转录、代谢过程、激素反应和钠离子转运相关的BsAux/IAA蛋白分别有5、5、5、5、5、3和1个;在分子功能大类中,被注释到结合、DNA结合转录因子活性、催化活性、蛋白结合转录因子活性和电压门控钠通道活性的BsAux/IAA蛋白分别有5、4、1、1和1个。KEGG富集分析结果表明:5个BsAux/IAA蛋白均参与植物激素信号转导通路。
表4 白及Aux/IAA蛋白的GO功能分类1)
Table 4 GO function classification of Aux/IAA proteins ofBletillastriata(Thunb.ex A.Murray)Rchb.f.1)

1)√:表示蛋白质具有该功能Indicating the protein has this function.
2.3 系统发育分析
系统发育分析结果(图4)表明:这些Aux/IAA蛋白被分成GroupⅠ和GroupⅡ 2个亚家族,且GroupⅠ又被分成a和b 2个亚群;供试5个BsAux/IAA蛋白均属于GroupⅠ亚家族,其中BsAux/IAA3、BsAux/IAA4和BsAux/IAA5属于a亚群,而BsAux/IAA1和BsAux/IAA2属于b亚群。总体来看,BsAux/IAA1、BsAux/IAA2、BsAux/IAA4和BsAux/IAA5与铁皮石斛Aux/IAA的亲缘关系较近,而BsAux/IAA3与拟南芥Aux/IAA的亲缘关系较近。
3 讨论和结论
生长素是调控植物生长发育的主要内源激素,Aux/IAA基因是调控植物体内生长素信号转导的关键基因[19]。本研究共鉴定出5个白及Aux/IAA基因,明显低于黄瓜(CucumissativusLinn.)[20]、水稻(OryzasativaLinn.)[21]、油菜(BrassicanapusLinn.)[1]、木瓜(CaricapapayaLinn.)[22]和土豆(SolanumtuberosumLinn.)[23],这可能与本研究基于转录组数据结果(受到取样和测序限制)进行分析有关,具体原因有待深入研究。亚细胞定位分析结果表明:5个白及Aux/IAA蛋白均被定位在细胞核中,说明白及Aux/IAA蛋白可能在细胞核中起作用,推测这可能是因为Aux/IAA蛋白含有2个核定位信号(NLS)[24]。
根据保守结构域分析结果,仅有BsAux/IAA1蛋白包含Domain Ⅰ、Domain Ⅱ、Domain Ⅲ和Domain Ⅳ 4个保守结构域,与拟南芥[25]、水稻[26]、玉米(ZeamaysLinn.)[10]和黄瓜[27]等植物的Aux/IAA蛋白保守结构域相似,可见,植物Aux/IAA蛋白具有一定的保守性。但BsAux/IAA2、BsAux/IAA3、BsAux/IAA4和BsAux/IAA5蛋白却存在不同程度的保守结构域缺失。例如:BsAux/IAA2、BsAux/IAA3和BsAux/IAA5均缺少具有转录抑制功能的保守结构域Domain Ⅰ(motif9)[5],BsAux/IAA2和BsAux/IAA3缺少具有蛋白质降解功能的保守结构域Domain Ⅱ(motif3)[28],BsAux/IAA2和BsAux/IAA5缺少具有自身二聚化功能的保守结构域Domain Ⅲ(motif2)[29]。推测造成BsAux/IAA蛋白部分保守结构域缺失的原因可能是在白及生长繁育进化过程中发生了基因突变导致的序列改变,致使部分BsAux/IAA蛋白只具备Aux/IAA蛋白的典型功能或拥有新功能,且不再参与生长素的信号响应。
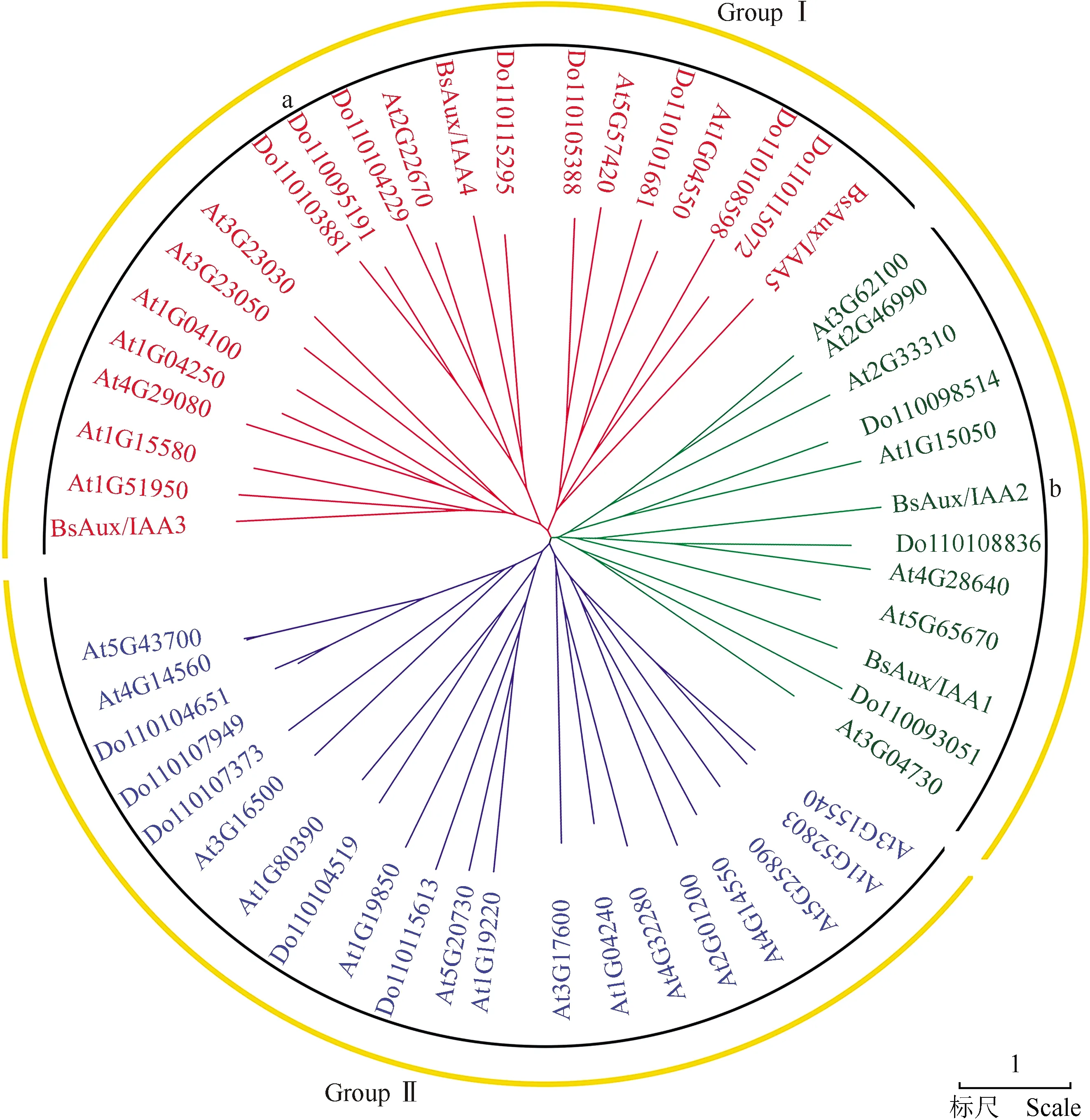
Bs:白及Bletillastriata(Thunb.ex A.Murray)Rchb.f.;At:拟南芥Arabidopsisthaliana(Linn.)Heynh.;Do:铁皮石斛DendrobiumofficinaleKimura et Migo.
图4 白及与拟南芥和铁皮石斛Aux/IAA蛋白的系统发育树
Fig.4 Phylogenetic tree of AUX/IAA proteins ofBletillastriata(Thunb.ex A.Murray)Rchb.f.,Arabidopsisthaliana(Linn.)Heynh.,andDendrobiumofficinaleKimura et Migo
系统发育分析结果表明:BsAux/IAA1、BsAux/IAA2、BsAux/IAA4和BsAux/IAA5与铁皮石斛Aux/IAA的亲缘关系较近,而BsAux/IAA3与拟南芥Aux/IAA的亲缘关系较近,说明多数BsAux/IAA蛋白与铁皮石斛Aux/IAA蛋白的功能相似。
GO功能分类结果表明:5个BsAux/IAA蛋白具有细胞组分、生物学过程和分子功能3大类功能,且均具有结合功能,说明BsAux/IAA基因具有组织特异性、发育依赖性和非生物胁迫应答性,这为白及新品种的遗传改良及在转录水平控制Aux/IAA基因表达等研究提供了新方向。然而,由于取样和测序的局限性,本研究仅鉴定出白及部分Aux/IAA蛋白的序列,关于白及Aux/IAA蛋白的研究还有待深入。
综上所述,白及Aux/IAA蛋白具有一定的保守性,可能在细胞核中发挥作用,并具有组织特异性、发育依赖性和非生物胁迫应答性。
