柯诺辛对鱼藤酮所致帕金森病小鼠运动功能影响
2020-06-08黄玉菊李冲陈蕾蕾谢俊霞
黄玉菊 李冲 陈蕾蕾 谢俊霞
[摘要] 目的 探讨柯诺辛对鱼藤酮所致帕金森病(PD)小鼠运动功能的影响。方法 8周龄雄性C57BL/6n小鼠96只,随机分为4组,每组24只。空白对照组给予空白溶剂,PD模型组给予鱼藤酮(5 mg/kg),雷帕霉素组联合给予雷帕霉素(10 mg/kg)和鱼藤酮(5 mg/kg),柯诺辛组联合给予柯诺辛(10 mg/kg)和鱼藤酮(5 mg/kg),均灌胃给药,每天1次,连续12周。分别于实验周期的第4、8和12周末,应用转棒实验检测各组小鼠在转棒上持续运动的时间。结果 实验周期第4周末和第8周末,空白对照组、PD模型组、雷帕霉素组和柯诺辛组小鼠在转棒上持续运动时间比较差异无显著性(F=1.220、3.638,P>0.05)。第12周末,PD模型组小鼠在转棒上持续运动时间较空白对照组缩短,雷帕霉素组、柯诺辛组在转棒上持续运动时间较PD模型组增加,差异均有统计学意义(F=5.166,P<0.05);雷帕霉素组与柯诺辛组比较,小鼠持续运动时间差异无统计学意义(P>0.05)。结论 柯诺辛可以改善鱼藤酮所致PD小鼠的运动持久能力。
[关键词] 帕金森病;鱼藤酮;柯诺辛;小鼠;移动
[中图分类号] Q426;R338.2 [文献标志码] A [文章编号] 2096-5532(2020)02-0153-03
doi:10.11712/jms.2096-5532.2020.56.092 [开放科学(資源服务)标识码(OSID)]
[网络出版] http://kns.cnki.net/kcms/detail/37.1517.R.20200519.1427.002.html;2020-05-20 08:57
[ABSTRACT] Objective To investigate the effect of corynoxine on the motor function of mice with rotenone-induced Parkinsons disease (PD). Methods A total of 96 male C57BL/6n mice, aged 8 weeks, were randomly divided into blank control group, PD model group, rapamycin group, and corynoxine group, with 24 mice in each group. The mice in the blank control group were given blank solvent, those in the PD model group were given rotenone (5 mg/kg), those in the rapamycin group were given rapamycin (10 mg/kg) and rotenone (5 mg/kg), and those in the corynoxine group were given corynoxine (10 mg/kg) and rotenone (5 mg/kg), all by gavage, once a day for 12 consecutive weeks. At the end of weeks 4, 8, and 12 of experiment, the rotarod test was used to measure the duration of continuous movement on a rotating rod. Results At the end of weeks 4 and 8 of experiment, there was no significant difference in the duration of continuous movement on a rotating rod between the blank control group, the PD model group, the rapamycin group, and the corynoxine group (F=1.220,3.638;P>0.05). At the end of week 12, the PD model group had a significantly shorter duration of continuous movement on a rotating rod than the blank control group, and compared with the PD model group, the rapamycin group and the corynoxine group had a significant increase in the duration of continuous movement on a rotating rod (F=5.166,P<0.05). There was no significant difference in the duration of continuous movement on a rotating rod between the rapamycin group and the corynoxine group (P>0.05). Conclusion Corynoxine can improve motor duration in mice with rotenone-induced PD.
[KEY WORDS] Parkinsons disease; rotenone; corynoxine; mice; locomotion
帕金森病(PD)是发病率仅次于阿尔茨海默病的第二大神经退行性疾病,其主要临床表现为运动功能障碍。流行病学研究显示,60岁以上人群PD的发病率为1%~2%,并且随着年龄的增加而增加[1-2]。由于PD的病因、病理机制尚未完全阐明,目前仍然缺乏有效的治疗措施。PD病理特征包含路易小体的出现,而路易小体的主要成分是聚集的α-突觸核蛋白。已有研究显示,α-突触核蛋白基因(SNCA)的多倍增加或点突变均可导致α-突触核蛋白错误折叠,从而引发PD[3]。在大鼠和果蝇中,过表达α-突触核蛋白可产生类PD样症状[4]。自噬是降解受损细胞器和长寿命蛋白聚合物(如α-突触核蛋白)的主要途径。研究结果表明,自噬功能障碍与PD密切相关[5-6]。PD相关的细胞和动物实验也显示,自噬相关基因的过表达或小分子自噬诱导剂可清除α-突触核蛋白,保护神经细胞[7]。因此,筛选能够有效清除α-突触核蛋白的小分子自噬诱导剂,成为研发PD新药的一个研究热点。在前期研究中,我们从中药钩藤中筛选到哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂——柯诺辛[8],研究显示柯诺辛能够通过诱导自噬有效清除PD细胞模型过表达的α-突触核蛋白[9-10]。但是,目前尚无应用PD动物模型评估柯诺辛神经保护作用的研究。本研究采用灌胃给药鱼藤酮方法构建PD小鼠模型,并通过转棒实验评估柯诺辛对PD小鼠运动功能障碍的影响。
1 材料与方法
1.1 动物分组及处理
SPF级8周龄雄性C57BL/6n小鼠96只,体质量(23±2)g,购于北京维通利华实验技术有限公司。小鼠每笼5只饲养,室温(21±2)℃,湿度(50±5)%,12/12 h昼夜循环光照,自由饮水、摄食、运动。适应性饲养1周后,小鼠随机分为空白对照组(A组)、PD模型组(B组)、雷帕霉素组(C组)、柯诺辛组(D组),每组24只。空白对照组给予空白溶剂,PD模型组给予5 mg/kg的鱼藤酮溶液,雷帕霉素组给予10 mg/kg的雷帕霉素溶液+5 mg/kg的鱼藤酮溶液,柯诺辛组给予10 mg/kg的柯诺辛溶液+5 mg/kg的鱼藤酮溶液,均灌胃给药。造模前对照组和PD模型组均预先灌胃生理盐水;雷帕霉素组和柯诺辛组分别预灌胃给予雷帕霉素和柯诺辛1周,造模开始后两种药物灌胃时间需间隔4 h以上。各组均每周灌胃6 d,连续灌胃12周。
1.2 转棒实验
在实验周期的第4、8、12周末进行转棒实验,测试各组小鼠的运动功能。使用美国Med Associates Inc公司生产的转棒仪,先将小鼠放在静止的转棒仪上适应2 min,之后将转棒仪以转速4~40 r/min转动,记录小鼠在旋转棒上持续运动的时间,记录时间5 min。测试3次,每次间隔2 h,取平均值。
1.3 统计学分析
应用Graph Pad Prism软件进行统计分析,计量资料结果以±s表示,多组间比较采用单因素方差分析(one-way ANOVA检验)。
2 结 果
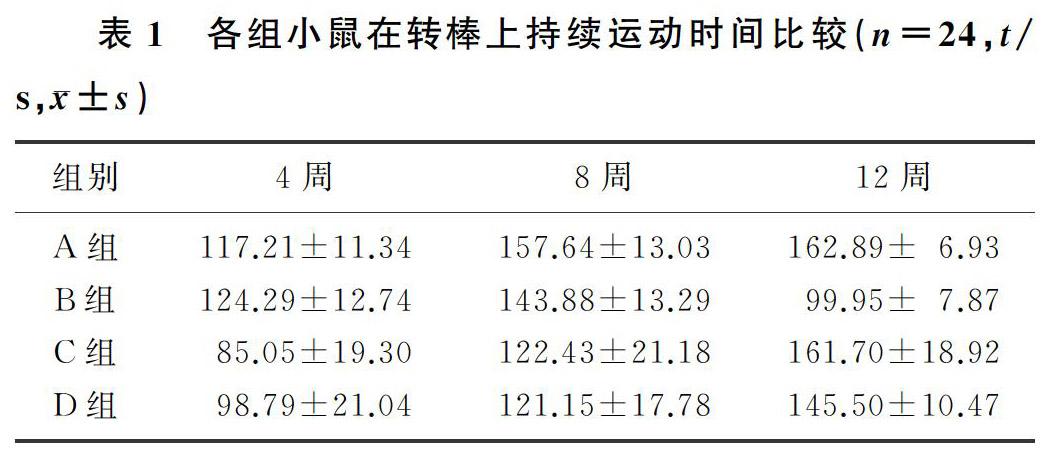
实验周期第4周末和第8周末,空白对照组、PD模型组、雷帕霉素组和柯诺辛组小鼠在转棒上持续运动时间比较,差异均无显著意义(F=1.220、3.638,P>0.05)。第12周末,PD模型组小鼠在转棒上持续运动时间较空白对照组缩短,雷帕霉素组、柯诺辛组在转棒上持续运动时间较PD模型组增加,差异均有统计学意义(F=5.166,P<0.05);雷帕霉素组与柯诺辛组比较,小鼠持续运动时间差异无统计学意义(P>0.05)。见表1。
3 讨 论
PD的病因学研究显示,环境因素和遗传因素是PD的两大病因。目前,利用1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)建立的PD动物模型研究已经取得了不少的成果,但现实生活中接触MPTP的人并不多。而作为杀虫剂和除草剂的鱼藤酮,其结构与MPTP类似,脂溶性高,可迅速穿过血-脑脊液屏障[11]。应用鱼藤酮建立的PD动物模型几乎可以复制PD的所有症状,其中最为突出的是鱼藤酮所致PD动物模型可以很好地模拟突触核蛋白聚集和路易小体形成[12]。本文研究通过灌胃给药鱼藤酮构建PD小鼠模型,从而模拟散发性PD。
目前PD治疗缺乏有效的措施,而中草药来自大自然,具有悠久的临床应用史,在PD的治疗和研究中广泛应用。研究显示,诸多中草药的提取物或活性成分,如钩藤[13]、乌鸡白凤丸[14]、丹参素[15]、银杏[16]、雷公藤[17]和何首乌[18]等,可以从对抗焦虑、清除致病蛋白、减少氧化损伤、对抗神经毒性等方面发挥显著的神经保护作用。因此,借助分子生物学技术和PD动物模型,从中草药尤其是其活性组分中筛选小分子自噬诱导剂,是目前研发防治PD新药的一项有效策略。
柯诺辛是从中药钩藤中提取的一种重要活性成分,我们前期的细胞实验证实,柯诺辛可以在细胞水平通过抑制mTOR通路诱导自噬有效清除α-突触核蛋白[8],但尚未在动物水平评估其神经保护作用。运动功能障碍是PD的主要临床特征,本文研究通过转棒实验评估柯诺辛作用不同时间对鱼藤酮所致PD模型小鼠运动功能的改善情况。mTOR在调节自噬的功能中发挥重要作用[19],雷帕霉素是第一个被发现的mTOR抑制剂,研究显示,雷帕霉素对MPTP所致PD模型小鼠具有神经保护作用,其可上调谷氨酸转运体和IL-6的表达[20],因此本文选用雷帕霉素作为阳性对照。本文研究结果显示,实验周期的第4周和第8周末,PD模型组与空白对照组小鼠在转棒上持续运动时间差异无显著性,直到第12周末PD模型组小鼠的运动时间才显著缩短,其原因可能是因为PD的运动症状一般晚于病理特征出现[21]。有文献报道,只有当黑质中的多巴胺能神经元受损超过50%,纹状体中多巴胺递质的含量降低超过80%时,运动障碍症状才会出现[22]。本文研究结果显示,实验周期的第12周末雷帕霉素组和柯诺辛组小鼠在转棒上持续运动时间较PD模型组明显增加,且雷帕霉素组和柯诺辛组比较差异无显著性,提示柯诺辛可以明显增加PD模型小鼠的运动持续能力。
綜上所述,柯诺辛对PD小鼠的运动障碍具有改善作用,但是柯诺辛对多巴胺能神经元的保护作用及其机制,还需要进一步研究。
[参考文献]
[1] MA Chunlin, SU Li, XIE Juanjuan, et al. The prevalence and incidence of Parkinsons disease in China: a systematic review and meta-analysis[J]. Journal of Neural Transmission, 2014,121(2):123-134.
[2] LI Gen, MA Jianfang, CUI Shishuang, et al. Parkinsons di-sease in China: a forty-year growing track of bedside work[J]. Translational Neurodegeneration, 2019,8(1):22.
[3] EMILY M R, MIRANDA B D, SANDERS L H. Alpha-synuclein: pathology, mitochondrial dysfunction and neuroinflammation in Parkinsons disease[J]. Neurobiology of Disease, 2018,109:249-257.
[4] TRIGO-DAMAS I, DEL REY N L, BLESA J, et al. Novel models for Parkinsons disease and their impact on future drug discovery[J]. Expert Opinion on Drug Discovery, 2018,13(3):229-239.
[5] GUO Fang, LIU Xinyao, CAI Huaibin, et al. Autophagy in neurodegenerative diseases: pathogenesis and therapy[J]. Brain Pathology, 2018,28(1):3-13.
[6] LYNCH-DAY M A, MAO K, WANG K, et al. The role of autophagy in Parkinsons disease[J]. Cold Spring Harbor Perspectives in Medicine, 2012,2(4): a009357.
[7] HARRIS H, RUBINSZTEIN D C. Control of autophagy as a therapy for neurodegenerative disease[J]. Nature Reviews Neurology, 2012,8(2):108-117.
[8] CHEN Leilei, SONG Juxian, LU Jiahong, et al. Corynoxine, a natural autophagy enhancer, promotes the clearance of Alpha-Synuclein via Akt/mTOR pathway[J]. Journal of Neuroimmune Pharmacology, 2014,9(3):380-387.
[9] CHEN Leilei, WANG Yongbo, SONG Juxian, et al. Phosphoproteome-based kinase activity profiling reveals the critical role of MAP2K2 and PLK1 in neuronal autophagy[J]. Autophagy, 2017,13(11):1969-1980.
[10] CHEN Lei, XIE Junxia. Identification of neuronal autophagy regulators: combined use of iKAP and THANATOS[J]. Movement Disorders, 2018,33(4):580-581.
[11] BOVE J, PERIER C. Neurotoxin-based models of Parkinsons disease[J]. Neuroscience, 2012,211(SI):51-76.
[12] GREENAMYRE J T, CANNON J R, DROLET R, et al. Lessons from the rotenone model of Parkinsons disease[J]. Trends in Pharmacological Sciences, 2010,31(4):141-142.
[13] SONG Juxian, LU Jiahong, LIU Liangfeng, et al. HMGB1 is involved in autophagy inhibition caused by SNCA/α-synuclein overexpression: a process modulated by the natural autophagy inducer corynoxine B[J]. Autophagy, 2014,10(1):144-154.
[14] JIA R, GOU Y, HO L O, et al. Anti-apoptotic activity of Bak Foong Pills and its ingredients on 6-hydroxydopamine-induced neurotoxicity in PC12 cells[J]. Cell Biology International, 2005,29(10):835-842.
[15] WANG Xinjian, XU Jianxing. Salvianic acid A protects human neuroblastoma SH-SY5Y cells against MPP+-induced cytoto-xicity[J]. Neuroscience Research, 2005,51(2):129-138.
[16] 冯建军,郭雄. 银杏叶提取物对帕金森病模型大鼠神经形态学的影响[J]. 西部医学, 2013,25(10):1455-1463.
[17] 周子懿,高俊鹏,向军,等. CX3CR1参与雷公藤内酯对MPP+帕金森病大鼠多巴胺能神经元的保护作用[J]. 中国病理生理杂志, 2015,31(4):659-663.
[18] 李玉娟,段昌令,李连达,等. 何首乌提取物对鱼藤酮所致帕金森病线虫模型的神经保护作用[J]. 中国药业, 2016,25(5):12-15.
[19] KIM Y C, GUAN K L. mTOR: a pharmacologic target for autophagy regulation[J]. The Journal of Clinical Investigation, 2015,125(1):25-32.
[20] ZHANG Yunlong, HE Xiaoliang, WU Xiaojuan, et al. Rapamycin upregulates glutamate transporter and IL-6 expression in astrocytes in a mouse model of Parkinsons disease[J]. Cell Death & Disease, 2017,8(2):e2611-e2611.
[21] BAIG F, LAWTON M, ROLINSKI M, et al. Delineating nonmotor symptoms in early Parkinsons disease and first-degree relatives[J]. Movement Disorders, 2015,30(13):1759-1766.
[22] SCHAPIRA A H, JENNER P. Etiology and pathogenesis of Parkinsons disease[J]. Movement Disorders, 2011,26(6):1049-1055.
(本文編辑 黄建乡)
