菌根真菌对酸铝胁迫的响应
2020-06-08王艳阳常顺利王诗慧古丽哈娜提波拉提别克张毓涛
王艳阳, 常顺利,*, 王诗慧, 古丽哈娜提·波拉提别克, 张毓涛
菌根真菌对酸铝胁迫的响应
王艳阳1, 常顺利1,*, 王诗慧1, 古丽哈娜提·波拉提别克1, 张毓涛2
1. 新疆大学资源与环境科学学院绿洲生态教育部重点实验室, 新疆乌鲁木齐市 830046; 2. 新疆林科院森林生态研究所, 新疆乌鲁木齐市 830063
酸性环境中活性铝浓度升高可能抑制菌根真菌生长, 为探讨酸性条件下菌根真菌对活性铝的响应机制,以拟青霉(sp.,)、细长孢霉()、木霉菌(spp.,)、瓶头霉()和葡萄状穗霉()5种菌根真菌为供试材料, 采用PDA液体培养基单种纯培养以pH值为5.5设定3个Al3+浓度梯度, 分别为对照(0 mmol·L-1)、低铝(0.2 mmol·L-1)和高铝(1.0 mmol·L-1), 研究酸性条件下不同活性铝浓度对菌根真菌的生物量、有机酸分泌以及N、P、K含量等的影响。结果表明: (1)除拟青霉()外, 其他菌株均不同程度受活性铝浓度影响,生物量随活性铝浓度增加而增加, 低铝时比对照增加了238%(<0.05), 而细长孢霉()木霉菌()瓶头霉()和葡萄状穗霉()生物量均降低, 其中,和分别比对照降低了38.1%和72.5%(<0.05)。(2)5种菌根真菌分泌有机酸存在显著性差异,和的H+分泌量在高铝浓度时均低于对照, 对产生显著性差异(<0.05); 仅分泌草酸, 对照的分泌量是高铝时的1.12倍。(3)5种菌根真菌N、P、K含量随不同活性铝浓度胁迫存在显著性差异,和的P、K含量随活性铝浓度增加而显著增加(<0.05);和的N含量随活性铝浓度增加而显著降低(<0.05),的P、K含量分别在低铝和高铝时达到峰值,和的N、P、K含量在低铝时达到峰值而在高铝时受到抑制。(4)、和受酸铝影响不显著, 属耐酸铝型菌株,和属酸铝敏感型菌株。本工作可为天山雪岭云杉森林更新与幼苗存活问题研究的深入开展提供基础依据。
菌根真菌; 活性铝; 酸度; 有机酸; 云杉森林
0 前言
当土壤pH值小于5.5时, 土壤内部分固态的矿物铝被活化成可溶性铝, 可溶性铝(主要是Al3+)抑制大部分菌根真菌释放拮抗铝毒物质, 导致大多数菌根真菌对植物以及林木的侵染力下降[1]。植物体内细胞核和核仁遭到严重破坏, 直接或间接地抑制细胞中DNA和染色体的复制及合成, 核酸代谢失调, 植物对养分的吸收能力下降, 抑制植物生长速率, 产生毒害[2]。酸性土壤中的活性铝可能是影响林木生长的重要限制因子[3-4]。因此研究酸铝胁迫对菌根真菌(Mycorrhizal fungi )的影响显得尤为重要。
菌根真菌是天山雪岭云杉()森林生态系统的重要组成部分, 是维持森林生物多样性和生态系统功能的主要因素[5]。菌根真菌可通过两种方式降低有毒物质的活性: (1)直接和间接途径参与植物生理代谢, 进而介导植物抗逆性、分解有毒物质和修复退化土壤与生境[6]; (2)还可通过将铝固定在球蛋白结构中进行铝分隔, 分泌某些有机酸来抵抗铝毒, 进而免受铝等多种有毒元素引起的胁迫[7-8]。研究表明接种菌根真菌可提高寄主植物的营养及吸水能力[9-10]。研究表明酸铝条件下菌根真菌715等可增强林木的抗铝性[11]。因此, 选择适应性强的菌根真菌, 培育菌根苗可大幅度提高雪岭云杉造林成活率[12]。
雪岭云杉是天山森林群落的单优树种, 在干旱区涵养水源、保护生物多样性、水土保持以及净化大气等方面起重要作用[13-14]。林下土壤呈酸性(灰褐色森林土, pH值为5.6左右)[15], 会存在幼苗存活困难等更新障碍问题[16]。酸性土壤中活性铝胁迫对菌根真菌生长的抑制可能是导致雪岭云杉幼苗存活困难的关键因素[17-19], 然而其作用机制尚不清楚。
本研究选取了从天山雪岭云杉根部分离并通过一代测序技术鉴定得到的拟青霉(sp.,)、细长孢霉(,)、木霉菌(spp.,)、瓶头霉(,)和葡萄状穗霉(,)的5种菌根真菌[20-22]为供试材料, 通过研究酸性条件下不同活性铝浓度对5种菌根真菌生长的影响, 期望阐述液体纯培养条件下菌根真菌抗酸铝性与其生物量、有机酸分泌、营养养分吸收之间的关系, 以期筛选出抗酸铝型菌株, 为解决天山雪岭云杉幼苗存活率低下等更新障碍问题提供借鉴。
1 材料与方法
1.1 供试材料
本文从天山雪岭云杉根部分离筛选并通过一代测序技术鉴定得到的拟青霉()、细长孢霉()、木霉菌()、瓶头霉()和葡萄状穗霉()5种共生菌根真菌菌株。
1.2 试验设计
本试验测得天山雪岭云杉活性铝浓度为(0.05- 0.85 g·kg–1)、pH值为5.6。
取4 ℃保存1—2个月的上述菌株, 接种于PDA液体培养基上, 在25 ℃条件下暗培养14 d备用。用分析纯Al2( SO4)3·18H2O提供活性铝, 在pH值为5.5条件下设定3个Al3+浓度的PDA液体培养基[23]: 对照(CK, 0 mmol·L–1)、低铝(Low Al, 0.2 mmol·L–1)、高铝(High Al, 1.0 mmol·L–1)。各处理3次重复。取150 mL三角瓶分装不同活性铝浓度的液体培养基, 每瓶20 mL, 封口后于121 ℃高压蒸汽灭菌30 min。冷却后接种5种菌根真菌1个直径为6 mm的供试琼脂菌种, 25 ℃的黑暗条件下静置培养14 d待测。
1.3 测试指标与方法
培养结束后, 过滤收集菌丝和滤液。菌丝用于测定生物量和氮(N)、磷(P)、钾(K)含量。菌丝生物量通过称重法获得。烘干的菌丝体经硫酸和双氧水消化后, 采用凯氏定氮法测定氮含量, 钼锑抗分光光度计法测定磷含量, 火焰光度法测定钾含量。滤液用于测定H+分泌量与有机酸的种类、含量。H+分泌量采用pH计法测定。滤液再经定容, 过滤(0.22 μm微孔滤膜)后, 用外标法于高效液相色谱仪上分析不同有机酸的含量[24-25]。检测的有机酸包括草酸、柠檬酸、苹果酸、丁二酸、甲酸和乙酸。
1.4 数据处理与分析
试验数据采用Excel进行基本计算, SPSS14.0统计软件进行统计分析, 采用LSD(Least—Significant Difference)法对数据进行多重比较, 显著水平<0.05。
2 结果与分析
2.1 活性铝胁迫对受试菌株生物量的影响
活性铝胁迫对受试菌株生物量的影响显示(图1), 0.2 mmol·L–1Al3+(低铝)浓度培养液中, 仅的生物量比对照增加了238%, 显著高于对照(<0.05);和菌丝生物量均减少, 但和差异未达到显著水平,比对照(无铝)减少了78.0%, 显著低于对照(<0.05)。1.0 mmol·L–1Al3+(高铝)浓度培养液中, 大部分菌株菌丝生物量开始下降(除和); 其中和分别比对照降低了38.1%和72.5%(<0.05);和差异未达到显著水平;比对照增加了138%。
2.2 活性铝胁迫对受试菌株氮磷钾含量的影响
2.2.1 活性铝胁迫对受试菌株氮含量的影响
活性铝对受试菌株含氮量的影响显示(表1), 受酸性条件不同活性铝浓度胁迫后,和的含氮量随活性铝浓度增加而增加。1.0 mmol·L–1Al3+浓度处理后, 含氮量分别比对照增加了23.3%和35.8%, 但并未引起和的含氮量呈现显著性差异。和的含氮量随活性铝浓度上升而降低, 均在对照时达到峰值, 分别比对照减少了34.9%和46.5%, 显著低于对照(<0.05)。随培养液活性铝浓度的变化趋势是先上升后下降, 0.2 mmol·L–1Al3+浓度时的含氮量达到峰值, 比对照增加了109%, 显著高于对照(<0.05), 1.0 mmol·L–1Al3+浓度处理后, 含氮量有所下降, 但活性铝浓度并未引起其显著变化。
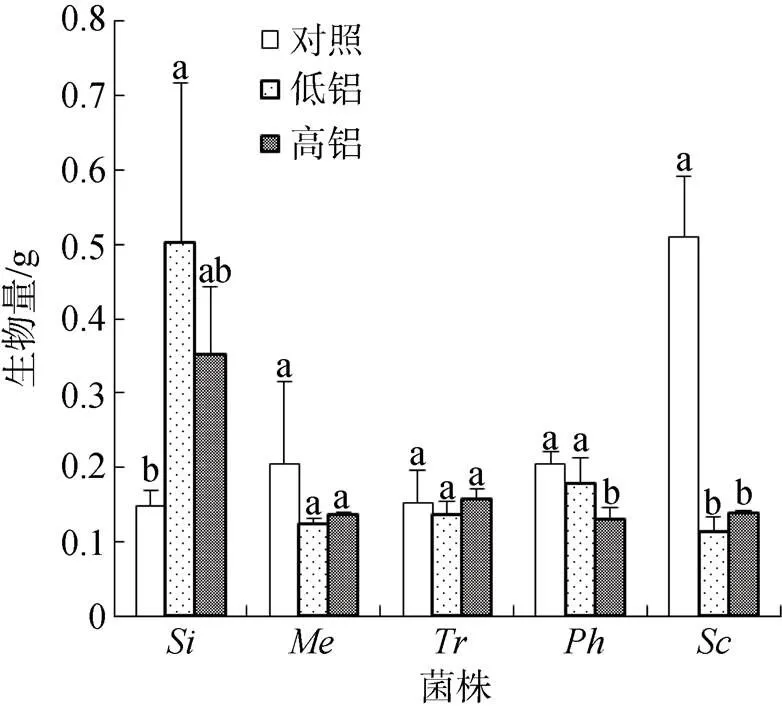
注: 不同小写字母表示同一菌株在不同活性铝浓度条件下差异显著(P<0.05)。
Figure 1 Biomass of five fungi under different aluminum treatments
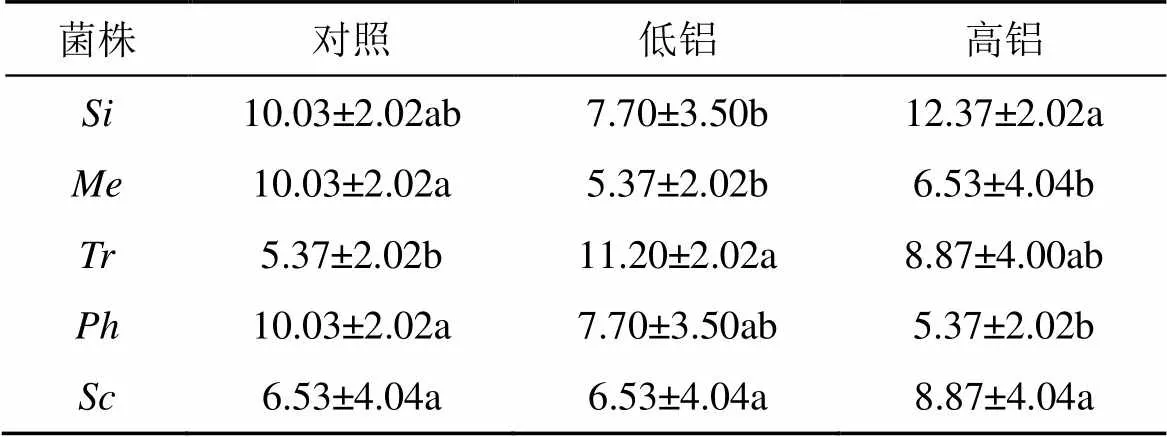
表1 活性铝胁迫对受试菌株氮含量的影响/(mg·g–1干重)
注: 不同小写字母表示相同菌株不同活性铝浓度处理的平均值0.05水平差异显著。
2.2.2 活性铝胁迫对受试菌株磷含量的影响
活性铝对受试菌株含磷量的影响显示(表2), 受不同活性铝浓度胁迫后,和的含磷量随培养液活性铝浓度增加而增加, 1.0 mmol·L–1Al3+浓度处理后, 含磷量分别比对照增加了23.3%和30.9%, 显著高于对照(<0.05)。和的含磷量随活性铝浓度变化是先上升后降低, 均在0.2 mmol·L–1Al3+浓度处理时达到峰值, 分别比对照增加了66.0%和17.7%, 显著高于对照(<0.05), 1.0 mmol·L–1Al3+浓度处理后, 并未对其产生显著性差异。随培养液活性铝浓度的变化趋势是先降低后升高, 1.0 mmol·L–1Al3+浓度时达到最大值, 比对照增加了9.8%, 差异不显著。

表2 活性铝胁迫对受试菌株磷含量的影响/(mg·g–1干重)
注: 不同小写字母表示相同菌株不同活性铝浓度处理的平均值0.05水平差异显著。
2.2.3 活性铝胁迫对受试菌株钾含量的影响
活性铝对受试菌株含钾量的影响显示(表3), 0.2 mmol·L–1Al3+浓度处理时,、和与对照无显著差异。和分别比对照增加了23.7%、5.4%和2.7%;和分别比对照减少了13.6%和10.1%。1.0 mmol·L–1Al3+浓度处理后, 仅的含钾量随培养液活性铝浓度增加而增加, 比对照增加了25.9%, 显著高于对照(<0.05);和的含钾量均与活性铝浓度无显著性差异,和分别比对照减少了3.7%和8.9%,和分别比对照增加了0.4%和12.2%。
2.3 活性铝对受试菌株有机酸分泌量的影响
2.3.1 H+分泌量
活性铝胁迫对受试菌株H+分泌量的影响显示(图2),的H+分泌量与活性铝浓度呈现先降低后增加的趋势。对照达到最大值, 低铝处理达到最低值, 高铝处理时, 比对照减少了58.3%, 显著低于对照(<0.05);和H+分泌量与活性铝浓度的关系则呈现先上升后降低的趋势, 均在低铝时达到最高值, 分别比对照增加了1.5%(显著高于对照< 0.05)、43.3%和220%(显著高于对照<0.05), 活性铝胁迫对和均产生了显著性差异, 并未对产生显著性差异;的H+分泌量随活性铝浓度增加而增加, 在高铝浓度下比对照增加了207%, 但酸铝胁迫并未对产生显著性差异。
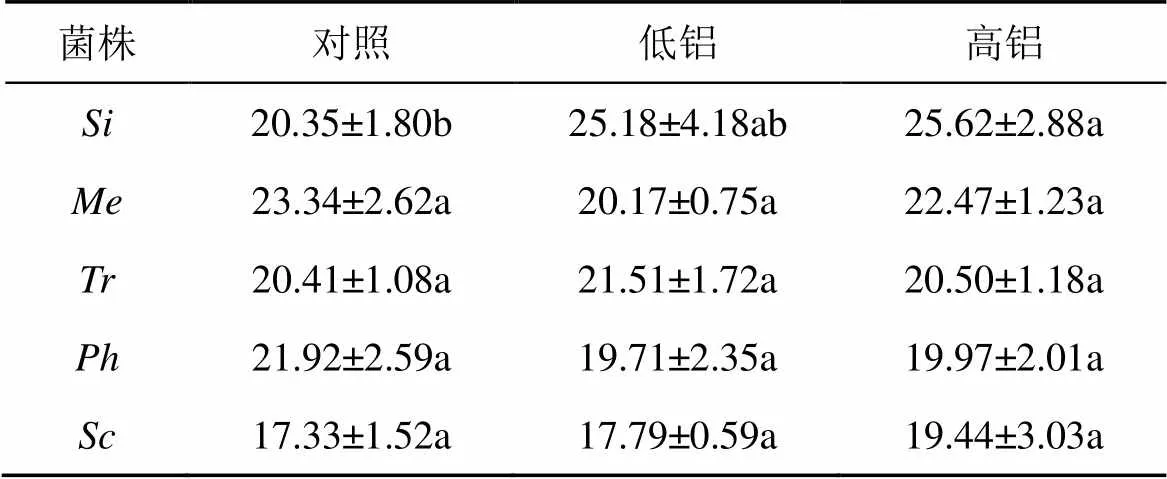
表3 活性铝胁迫对受试菌株钾含量的影响/(mg·g–1干重)
注: 不同小写字母表示相同菌株不同活性铝浓度处理的平均值0.05水平差异显著。

注: 不同小写字母表示同一菌株在不同活性铝浓度条件下差异显著(P<0.05)
Figure 2 H+secretion of 5 fungi treated with different active Aluminum concentrations
2.3.2 有机酸分泌量
本试验在菌根真菌培养液中检测出草酸、柠檬酸、苹果酸、丁二酸、乙酸。不同活性铝浓度梯度对5种菌根真菌有机酸分泌量的影响显示(表4)。所有供试菌株均检测出苹果酸,和苹果酸分泌量无论在对照、低铝、高铝均未出现明显差异,和均在低铝时达到峰值, 高铝时分别比对照减少了27.1%和40.9%。仅分泌草酸, 并随活性铝浓度增加而减少, 对照的分泌量是高铝时的1.12倍。供试菌株中柠檬酸分泌除外,和均被检测出, 高铝时分别比对照增加了48.8%、189%、29.9%和227%, 其中和均在高铝时达到峰值,在对照处理时有少量柠檬酸分泌。和均分泌丁二酸,在对照处理时达到峰值, 而在低铝时达到峰值,和未分泌。所有供试菌株均未检测到甲酸。5种供试菌株中, 只有分泌大量乙酸, 并且在低铝时达到峰值, 高铝时开始下降。
3 讨论
3.1 活性铝对受试菌株生物量的影响
在活性铝胁迫条件下, 菌丝生物量是指示菌根真菌抗铝能力的可靠指标之一[26]。线郁等[27]研究表明, 土壤中低pH值(3.8—5.5)和高铝浓度对菌根真菌的生长存在不同程度的影响。辜夕容等[28]研究分析表明, 在铝胁迫及pH值(4.5—5.5)条件下, 铝对耐铝型菌种715和04的生长无抑制作用, 却显著抑制敏感型菌种S238N、S238A和270的生长。本试验中, 活性铝胁迫对受试菌株生物量的影响显示(图1), 0.2 mmol·L–1Al3+浓度培养液中, 铝胁迫对的生物量无抑制作用, 显著增加其生物量, 甚至在1.0 mmol·L–1Al3+浓度培养液中,比对照增加了138%。这一结果与菌根真菌在活性铝胁迫下能显著增加菌液中菌丝生物量相似[29]。说明在这五种菌根真菌中对铝的抗性最强。然而不同菌株对铝的抗性是存在较大差异的。李华等[30]研究发现, Al3+可显著降低13的生物量, 对13的抑制作用显著大于715和04。低铝浓度处理时,和菌丝生物量均减少, 但和差异未达到显著水平,显著低于对照(<0.05); 高铝浓度处理时,和显著低于对照(<0.05),和差异未达到显著水平。说明受铝胁迫作用最显著。

表4 不同活性铝浓度梯度对5种菌根真菌的有机酸分泌量的影响/(mmol·g–1干重)
注: 不同小写字母表示相同菌株不同活性铝浓度处理的平均值0.05水平差异显著。
结合以上结论可得出:菌丝生物量受酸铝影响不显著, 在高铝浓度处理下生物量仍高于对照, 表现出较强的抗铝性;和抗铝性次之;抗铝性较差;抗铝性最差。说明和具有一定的铝吸收累积能力, 对铝显示出一定的耐受性。我国天山雪岭云杉森林林下土壤pH值小于5.6(酸雨pH值), 属于弱酸至强酸森林土壤, 活性铝含量较高。因此, 在天山雪岭云杉森林土壤中分离并筛选抗酸铝型本土菌株对促进云杉幼苗有重要意义。
3.2 活性铝对受试菌株有机酸分泌量的影响
在土壤中, 菌根真菌在铝胁迫下可释放低分子量的有机酸, 可与铝形成稳定的螯合物, 阻止菌丝和根系细胞对铝的吸收, 降低活性铝活性, 进而缓解铝毒害[31]。不同菌根真菌在活性铝胁迫下分泌的有机酸具有显著性差异。Cumming等[32]研究发现, 在活性铝胁迫条件下, 菌根真菌不仅能分泌草酸, 还能分泌其它种类的有机酸。
本试验5种受试菌株中, 仅的H+分泌量随培养液活性铝浓度的增加而增加, 其剩余4种受试菌株则与不同, 这一结果与周志峰[33]等发现有9个受试菌株的H+分泌量与培养液活性铝浓度呈极显著正相关不一致, 推测可能是由于不同地区导致菌根真菌的生理特性和对生态环境的适应性不同。分泌出的有机酸数量最多, 高达4种, 且乙酸含量在低铝时达到峰值, 同时分泌能有效抵抗铝毒害的草酸, 说明在活性铝胁迫过程中, 活性铝浓度已达到其生长的耐受限度, 因此分泌多种有机酸来拮抗铝毒。分泌3种有机酸, 无草酸分泌, 说明草酸并不是其拮抗铝毒的唯一途径, 可能通过分泌其他有机酸来缓解铝毒。这与研究发现对Al3+具有一定抗性的715, 其草酸分泌量低于试验中其他菌株, 却分泌出了大量的丁二酸, 说明分泌草酸可能不是所有菌根真菌耐铝性强弱的唯一指标结果[34]相似。、和均只分泌2种有机酸, 可能是由于活性铝浓度并未达到其生长耐受限度。因此, 有机酸分泌量增加有利于菌根真菌利用这些有机酸与重金属结合以缓解菌根真菌或菌根植物的铝毒害[35]。
3.3 活性铝对受试菌株氮磷钾含量的影响
研究表明, 高铝条件下低磷有效性和土壤酸度是菌根真菌生长的主要制约因素[36]。然而在高铝条件下, 菌根真菌对于促进植物及林木对营养养分(N、P、K)的吸收和利用率存在显著性差异[37-38]。
本试验中,和的N、P、K含量随活性铝浓度增加而增加, 显著高于对照, 这说明在活性铝毒害下, N、P、K含量的增加可能是其拮抗铝毒的重要途径, 这一结果与菌根真菌能促进氮含量的增加相似[39];和的N含量随活性铝浓度增加而降低, 均显著低于对照, 说明活性铝浓度抑制其含氮量的吸收, 使其生长受到限制,的P、K含量分别在低铝和高铝时达到峰值, 说明在低铝处理时, 促进了P、K含量的吸收从而抵抗铝胁迫, 但高铝处理时又抑制其吸收;和的N、P、K含量在低铝时达到峰值, 高铝时受到抑制, 这与张薇等[40]发现715、13和00在低铝处理时刺激其生长的研究, 反而高铝处理时抑制其生长相似。尽管不同菌株的养分含量对活性铝的响应有所不同, 仍能看出多数菌株表现为当适当活性铝胁迫后N、P、K含量有所增加, 这一结果与接种菌根真菌可显著提高菌液中N、P、K含量相似[41], 说明这可能是这些菌株用来拮抗铝毒的重要途径之一。
研究表明, 低磷胁迫下菌根真菌共生体系特殊的磷吸收转运系统对于改善植物磷营养状况可能具有重要意义[42]。菌根真菌增加P、K的吸收有利于降低Al3+的活性及促进生物代谢, 从而缓解铝毒[43]。因此, 在铝胁迫条件下, 菌丝体内的磷、钾浓度增加对于菌根真菌有积极意义。
4 结论
综上所述, 酸性环境单菌种液体培养条件下, 受试各菌株(拟青霉除外)均不同程度受活性铝浓度抑制作用, 有机酸分泌量存在显著性差异, 菌丝N、P、K含量也呈现显著性差异。5种受试菌株中,、和受酸铝影响不显著, 属抗酸铝型菌株, 而和属酸铝敏感型菌株。因此, 筛选出抗酸铝菌根真菌应用于天山雪岭云杉森林中, 为天山雪岭云杉幼苗更新提供理论依据。
[1] LOFTON J, GODSEY C B, Zhang H. Determining Aluminum Tolerance and Critical Soil pH for Winter Canola Production for Acidic Soils in Temperate Regions[J]. Agronomy Journal, 2010, 102(1): 327–332.
[2] SCANLAN C A, BRENNAN R F, DANTUONO M F, et al. The interaction between soil pH and phosphorus for wheat yield and the impact of lime-induced changes to soil aluminium and potassium[J]. Soil Research, 2017, 55(4): 22–30.
[3] KAY M C, DAVID E E, MARTIN J H. The amelioration of aluminium toxicity by silicon in higher plants: Solution chemistry or an in planta mechanism?[J]. Physiologia Plantarum, 2010, 104(4): 608–614.
[4] KOCHIAN L V, PINEROS M A, HOEKENGA O A. The Physiology, Genetics and Molecular Biology of Plant Aluminum Resistance and Toxicity[J]. Plant & Soil, 2005, 274(1/2): 175–195.
[5] 陈保冬, 孙玉青, 张莘, 等. 菌根真菌重金属耐性机制研究进展[J]. 环境科学, 2015, 36(03): 1123–1132.
[6] 胡玉金, 高春梅, 刘杏忠, 等. 保护地黄瓜根内和土壤中丛枝菌根真菌和深色有隔内生真菌多样性研究[J]. 菌物学报, 2017, 36(02): 164–176.
[7] AGUILERA P, BORIE F, SEGUEL A, et al. Fluorescence detection of aluminum in arbuscular mycorrhizal fungal structures and glomalin using confocal laser scanning microscopy[J]. Soil Biology & Biochemistry, 2011, 43(12): 2427–2431.
[8] 汪建飞, 沈其荣. 有机酸代谢在植物适应养分和铝毒胁迫中的作用[J]. 应用生态学报, 2006, (11): 2210–2216.
[9] 张彤彤, 耿增超, 许晨阳, 等. 秦岭辛家山林区落叶松外生菌根真菌多样性[J]. 微生物学报, 2018, 58(3): 443– 454.
[10] 徐丽娇, 郝志鹏, 谢伟, 等. 丛枝菌根真菌根外菌丝跨膜H+和Ca2+流对干旱胁迫的响应[J]. 植物生态学报, 2018, 42(7): 764–773.
[11] 高悦, 吴小芹, 孙民琴. 马尾松不同菌根苗对氮磷钾的吸收利用[J]. 南京林业大学学报(自然科学版), 2009, 33(4): 77–80.
[12] 郑来友, 童品璋, 孙宣军, 等. 板栗接种食用菌根真菌的菌根化效果及对幼苗促生效应的研究[J]. 林业科学研究, 2017, 30(1): 81–87.
[13] 孙雪娇, 常顺利, 张毓涛, 等. 矿区道路两侧雪岭云杉叶片重金属富集效应[J]. 生态学报, 2018, 38(9): 3155–3164.
[14] 丁程锋, 张绘芳, 李霞, 等. 天山中部云杉天然林水源涵养功能定量评估——以乌鲁木齐河流域为例[J]. 生态学报, 2017, 37(11): 3733–3743.
[15] XU Wenqiang, CHEN Xi, LUO Geping, et al. Soil properties at the tree limits of the coniferous forest in response to varying environmental conditions in the Tianshan Mountains, Northwest China[J]. Environmental Earth Sciences, 2011, 63(4): 741–750.
[16] 王婷, 任海保, 马克平. 新疆中部天山雪岭云杉种群动态初步研究[J]. 生态环境学报, 2006, 15(3): 564–571.
[17] Xie Z M, Ye Z H, Wong M H. Distribution characteristics of fluoride and Aluminum in soil profiles of an abandoned tea plantation and their uptake by six woody species[J]. Environment International, 2001, 26(5): 341–346.
[18] 俞元春, 丁爱芳. 模拟酸雨对酸性土壤铝溶出及其形态转化的影响[J]. 生态环境学报, 2001, 10(2): 87–90.
[19] JANA Z, MILAN S, JELKA S, et al. Influence of Aluminum on the membranes of mycorrhizal fungi[J]. Water, Air, & Soil Pollution, 1993, 71(3): 101–109.
[20] BRASEL T L, DOUGLAS D R, WILSON S C, et al. Detection of AirborneMacrocyclic Trichothecene Mycotoxins on Particulates Smaller than Conidia[J]. Applied & Environmental Microbiology, 2005, 71(1): 114–22.
[21] Du Z Y, ALVARO J, HYDEN B, et al. Enhancing oil production and harvest by combining the marine alga Nannochloropsis oceanica and the oleaginous fungus[J]. Biotechnology for Biofuels, 2018, 11(1): 174–178.
[22] ROY S, DUTTA T, SARKAR T S, et al. Novel xylanases fromobclavatum MTCC 9604: comparative analysis of production, purification and characterization of enzyme from submerged and solid state fermentation[J]. Springer Plus, 2013, 2(1): 1–10.
[23] 彭丽媛, 熊兴政, 李艳, 等. 锰对外生菌根真菌生长、养分吸收、有机酸分泌和菌丝体中锰分布的影响[J]. 生态学报, 2016, 36(10): 2819–2825.
[24] 王明霞, 黄建国, 袁玲, 等. 铝胁迫下外源钙对外生菌根真菌抗氧化保护酶活性的影响[J]. 环境科学, 2012, 33(10): 3675–3679.
[25] 辜夕容, 倪亚兰, 江亚男, 等. 接种双色蜡蘑对酸性铝胁迫下马尾松幼苗生长、养分和铝吸收与分布的影响[J]. 林业科学, 2018, 54(2): 170–178.
[26] KHOSLA B, REDDY M S. Response of ectomycorrhizal fungi on the growth and mineral nutrition of eucalyptus seedlings in Bauxitemined soil[J]. American-Eurasian Journal of Agricultural & Environmental Sciences, 2008, 3(1): 123–126.
[27] 线郁, 王美娥, 陈卫平. 土壤酶和微生物量碳对土壤低浓度重金属污染的响应及其影响因子研究[J]. 生态毒理学报, 2014, 9(1): 63–70.
[28] 辜夕容, 黄建国. 铝对外生菌根真菌草酸分泌及磷、钾、铝吸收的影响[J]. 生态学报, 2008, 30(2): 357–363.
[29] 裘浪, 毕银丽, 江彬, 等. 覆膜与接种AM真菌对半干旱区玉米根际土壤理化性质的影响[J]. 菌物学报, 2017, 36(07): 904–913.
[30] 李华, 黄建国, 袁玲. 铝和锰对外生菌根真菌生长、养分吸收及分泌作用的影响[J]. 环境科学, 2013(1): 315–320.
[31] 韦莉莉, 卢昌熠, 丁晶, 等. 丛枝菌根真菌参与下植物—土壤系统的养分交流及调控[J]. 生态学报, 2016, 36(14): 4233–4243.
[32] CUMMING J R, SWIGER T D, KURNIK B S, et al. Organic acid exudation byandexposed to aluminium in vitro[J]. Canadian Journal of Forest Research, 2001, 31(4): 703–710.
[33] 周志峰, 王明霞, 袁玲, 等. 不同生境外生菌根真菌对铝胁迫的响应[J]. 生态学报, 2016, 36(10): 2842–2850.
[34] 张英伟, 柴立伟, 王东伟, 等. Cu和Cd胁迫下接种外生菌根真菌对油松根际耐热蛋白固持重金属能力的影响[J]. 环境科学, 2014, 35(3): 1169–1175.
[35] BORIE F, REDEL Y, Rubio R, et al. Interactions between crop residues application and mycorrhizal developments and some soil-root interface properties and mineral acquisition by plants in an acidic soil[J]. Biology & Fertility of Soils, 2002, 36(2): 151–160.
[36] 许小丽, 张金彪. 森林土壤-植物系统铝毒害及防治研究进展[J]. 生态学杂志, 2017, 36(4): 1106–1116.
[37] 王薪琪, 王传宽, 张泰东. 森林土壤碳氮循环过程的新视角: 丛枝与外生菌根树种的作用[J]. 植物生态学报, 2017, (10): 1113–1125.
[38] HODGE, CAMPBELL C D, FITTER A H. An arbuscular mycorrhizal fungus accelerates decomposition and acquires nitrogen directly from organic material[J]. Nature, 2001, 413(6853): 297–299.
[39] 杨岳, 闫伟, 魏杰. 内蒙古地区白桦根围土壤外生菌根真菌群落结构[J]. 菌物学报, 2018, 37(3): 294–304.
[40] 张薇, 黄建国, 袁玲, 等. 外生菌根真菌对Al3+胁迫和低钾土壤的响应[J]. 环境科学, 2014, 35(10): 3862–3868.
[41] 郭理想, 杨婕妤, 龙明秀, 等. AMF对不同水分条件下紫花苜蓿生态化学计量学特征的影响[J]. 草业科学, 2018, 35(2): 398–406.
[42] 徐丽娇, 姜雪莲, 郝志鹏, 等. 丛枝菌根通过调节碳磷代谢相关基因的表达增强植物对低磷胁迫的适应性[J]. 植物生态学报, 2017, 41(8): 815–825.
[43] 张宇亭, 朱敏, 线岩, 等. 接种AM真菌对玉米和油菜种间竞争及土壤无机磷组分的影响[J]. 生态学报, 2012, 32(22): 7091–7101.
Response of mycorrhizal fungi to acid aluminum stress
WANG Yanyang1, CHANG Shunli1,*, WANG Shihui1, Gulihanati Bolatibike1, ZHANG Yutao2
1.Key Laboratory of Oasis Ecology, College of Resource and Environment Science, Xinjiang University, Urumqi 830046, China 2.Institute of Forest Ecology, Xinjiang Academy of Forestry, Urumqi 830063,China
Increased concentration of active aluminum in an acidic environment may inhibit the growth of mycorrhizal fungi. In order to further explore the response mechanism of mycorrhizal fungi to active aluminum under acidic conditions in Tianshan forest area, this paper used five mycorrhizal fungi ofsp.,,,spp.,,,and,. The test material was set up in a single pure culture of PDA liquid mediumat a pH of 5.5 to set three Al3+concentration gradient controls (CK), low Aluminum (0.2 mmol·L-1), and high Aluminum (1.0 mmol·L-1). The effects of changes in active aluminum concentration on the biomass, organic acid secretion, and N, P, and K contents of mycorrhizal fungi were studied. The results showed that: (1) Except for, other strains were inhibited by active aluminum concentration to varying degrees;biomass was positively correlated with active aluminum concentration, and low content of aluminum was increased by 238% compared with control (<0.05); the biomass of,,anddecreased, among which,anddecreased by 38.1% and 72.5%, respectively. (<0.05). (2) There were significant differences in the secretion of organic acids by five mycorrhizal fungi. Except for, the H+secretion of,,andwas lower than CK at a high content of aluminum, and there was a significant difference in(<0.05). Onlydetected oxalic acid, and the amount of oxalic acid secretion was 1.12 times higher than CK. (3) The contents of N, P and K in five mycorrhizal fungi were significantly different from the concentration of active aluminum. The contents of P and K inandwere positively correlated with the concentration of active aluminum (<0.05). The N content of,was significantly negatively correlated with the active aluminum concentration (<0.05). The P and K contents ofreached the peak at low and high content of aluminum, respectively. The N, P and K contents ofandpeaked at low content of aluminum. It was suppressed in high content of aluminum. (4),andwere not significantly affected by acid aluminum and belonged to the acid-aluminum resistance strain.andwere acid-aluminum sensitive strains.
mycorrhizal fungi; active aluminum; acidity; organic acid content; Tianshan forest area
10.14108/j.cnki.1008-8873.2020.03.005
Q945.79
A
1008-8873(2020)03-031-07
2019-01-05;
2019-06-27
国家自然科学基金项目(U1503187); ”十二五”农村领域国家科技计划课题(2015BAD07B03-03)
王艳阳(1992—), 女, 河南驻马店人, 硕士研究生, 主要研究方向为森林生态学, E-mail: 1491021271@qq.com
常顺利, 男, 博士, 副教授, 主要研究方向为森林生态学, E-mail: ecocsl@163.com
王艳阳, 常顺利, 王诗慧, 等. 菌根真菌对酸铝胁迫的响应[J]. 生态科学, 2020, 39(3): 31–37.
WANG Yanyang, CHANG Shunli, WANG Shihui, et al. Response of mycorrhizal fungi to acid aluminum stress[J]. Ecological Science, 2020, 39(3): 31–37.
