CRISPR 技术在病毒学研究中的应用
2020-06-08赵东明步志高
高 帅,李 芳,李 赞,王 涛,赵东明,步志高
(1.天津大学生命科学学院,天津 300072;2.中国农业科学院哈尔滨兽医研究所,兽医生物技术国家重点实验室,黑龙江哈尔滨 150069;3.国家动物疫病防控高级别生物安全实验室,黑龙江哈尔滨 150069)
CRISPR/Cas(clustered regularly interspaced short palindromic repeats/CRISPR-associate) 是只存在于细菌及古生菌中的获得性免疫系统,自1987 年被Nakata 研究组偶然发现以来,科学家们对其功能和机制的研究不断深入,逐渐对其有了全面的认识。2013 年,CRISPR 技术首次作为一种基因编辑手段应用于哺乳动物和人类细胞的基因编辑[1-2],随后发展态势迅猛,由于其具有操作简单、效率高、成本低等优势,现在已经应用于改良农作物、构建细胞或动物模型、探索疾病机理及精准治疗等生物学的各个领域,已成为当今生命科学领域最受欢迎的基因编辑技术。本文主要聚焦于近几年CRISPR 技术在病毒学研究中的应用,并对其发展前景进行展望,为相关领域研究工作的开展提供理论参考和技术依据。
1 CRISPR/Cas 系统
根据Cas 编码复合物的不同,CRISPR/Cas 系统主要分为1 类系统(I、III、IV 型,12 个亚型)[3]和2 类系统(II、V、VI 型,9 个 亚型)[4]。1 类CRISPR/Cas 系统需要利用多个效应蛋白复合物,而2 类CRISPR/Cas 系统只需单个效应蛋白就可以发挥作用[5]。目前2 类II 型CRISPR/Cas9 系统、V 型CRISPR/Cas12a(也称为Cpf1)系统以及VI 型CRISPR/Cas13a 系统应用最为广泛。CRISPR/Cas9 系统由Cas9 蛋白和gRNA(guide RNA)构成。gRNA 包括CRISPR RNA(crRNA)和反式激活RNA(tracrRNA),它可以指导Cas9 蛋白靶向切割DNA 或RNA 从而发挥基因编辑作用[6]。而Cas12a 切割DNA 和Cas13a 切割RNA 仅需crRNA 协助。三种系统在分子量大小、结构组成、生理生化功能及作用机制(图1)上均存在明显差异[7],但各有优势,可以根据实验需要,选择性应用于生物学相关研究。
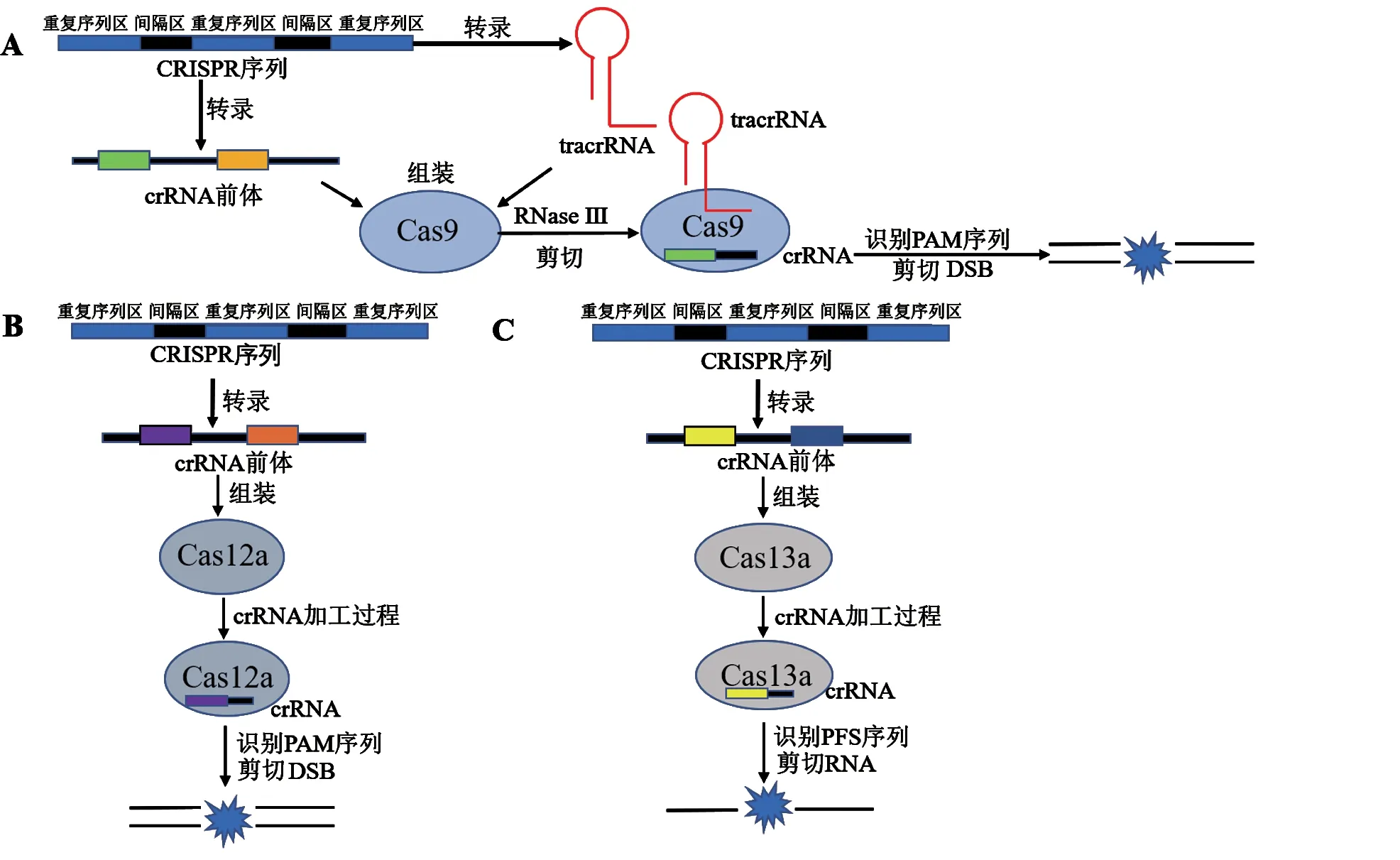
图1 CRISPR/Cas9、CRISPR/Cas12a 和CRISPR/ Cas 13a 三大主要CRISPR 系统的作用机制
随着研究人员对1 类CRISPR/Cas 系统研究的深入,CRISPR 技术的相关理论知识与实践应用不断得到扩展延伸。Dolan 等[8]发现,1类I 型CRISPR/Cas3 系统可以剪切较长片段的DNA;Pickar-Oliver 等[9]发现,I 型CRISPR/Cas系统不仅可以激活和关闭靶基因的表达,而且可以实现人类细胞基因组的特异性转录调控等。目前对CRISPR 2 类系统中的Cpf1 研究多围绕AsCpf1[10]和LbCpf1[11]展开,但是它们只能识别非常特殊的PAM(protospacer adjacent motif)序列,因而其应用范围受到极大限制。Tu 等[12]发现,与AsCpf1 和LbCpf1 相比,FnCpf1 可以更加灵敏地识别PAM 序列,不仅具备较高的保真性,而且可以应用于人类基因组编辑。这些研究成果为进一步利用CRISPR 技术开展病毒性疾病的基础研究和基因治疗的应用研究提供了新工具。
2 CRISPR/Cas 系统用于抗病毒药物靶点筛选
目前,病毒性疾病的治疗方法十分有限,治疗效果仍有待提高。CRISPR 技术的出现与发展为病毒病的预防控制和临床治疗带来了希望。利用CRISPR 技术可以更方便快捷地找到抑制病毒复制的潜在药物靶点,为病毒性疾病的治疗和预防提供更加安全可行的策略与方案。
2.1 筛选黄病毒潜在药物靶点
登革热、小头症、森林脑炎分别是由黄病毒科的登革热病毒(DENV)、寨卡病毒(ZIKV)和森林脑炎病毒感染人所引起的传染性疾病。人群对黄病毒普遍易感,但是目前还没有针对DENV和ZIKV 的特异性抗病毒疗法或疫苗,因此利用CRISPR 技术筛选黄病毒潜在药物靶点,对于有效控制和预防黄病毒感染具有重大意义。2016 年6月,Savidis 等[13]利用CRISPR/Cas9 系统筛选出受体酪氨酸激酶家族AXL 蛋白是DENV 和ZIKV 侵入宿主细胞的关键蛋白,同时鉴定出内质网膜蛋白复合物在黄病毒早期感染中发挥着关键作用。同期,研究人员发现,利用CRISPR/Cas9 系统关闭宿主细 胞SPCS1(signal peptidase complex subunit 1)基因的表达,不仅可以特异性降低黄病毒感染,而且也不会对宿主细胞造成损害[14]。另外,还有研究人员利用CRISPR 全基因组筛选技术鉴定出IFI6(interferon alpha-inducible protein6)可以靶向抑制黄病毒感染[15-16]。针对这些可作为潜在治疗靶标的宿主蛋白,设计新型药物,开发新型靶向疗法,有利于提高黄病毒感染的治疗效果。
2.2 筛选人类免疫缺陷病毒潜在药物靶点
艾滋病是由人类免疫缺陷病毒(HIV)攻击人类免疫系统,从而使机体易被外界病原体感染的一种严重传染性疾病,病死率较高,严重威胁人类生命安全。至今还未研制出根治和预防艾滋病的特效药物和有效疫苗。目前,CRISPR 技术已被运用到HIV 感染的研究中。2016 年12 月,有研究利用CRISPR/Cas9 系统进行全基因组筛选,发现了5 种HIV 感染必需的宿 主 蛋 白CD4、CCR5、TPST2(tyrosylprotein sulfotransferase 2)、SLC35B2(solute carrier family 35 member B2) 和ALCAM(activated leukocyte cell adhesion molecule)。其 中:CD4和CCR5 作为受体共同促进HIV 感染T 细胞;TPST2 和SLC35B2 可以使CCR5 的酪氨酸残基硫酸化,从而促进HIV 包膜的识别;ALCAM 可以调节细胞聚合,用于HIV 的细胞间传播[17]。针对这5 种HIV 感染必需的宿主蛋白,设计开发新型药物,可以有效防止耐药性HIV 毒株的出现,是一种具有广阔前景的治疗手段。
2.3 筛选肠道病毒潜在药物靶点
肠道病毒主要包括脊髓灰质炎病毒(PV)、柯萨奇病毒和埃可病毒。自然状态下,该类病毒只感染人这唯一宿主,在世界各地均有分布。目前还没有研制出针对肠道病毒的特效治疗药物,除了脊髓灰质炎疫苗可以起到极好的预防效果外,其他肠道病毒疫苗都还没有研制成功,而CRISPR 技术的出现大大推动了此研究领域的发展。2019 年5 月,研究人员利用CRISPR/Cas9系统对埃可病毒进行高通量功能性筛选,发现除了CD55 这一已知的病毒受体外,首次鉴定出FcRn是B 族肠道病毒一种新的脱衣壳受体,从而为肠道病毒新型药物的研发提供了理论依据[18]。
利用CRISPR 宿主全基因组筛选技术鉴定抗病毒靶点,是目前抗病毒药物的研究热点。筛选潜在药物靶点可以为创新药物的设计研发和病毒性疾病的治疗开拓新思路。与靶向病毒蛋白这类传统治疗方法不同,靶向宿主蛋白是一种新型治疗方法,具有病毒不易产生抗药性,且药物具有潜在广谱抗病毒特性的优势,对病毒性传染病防控具有极大的指导意义。
3 CRISPR/Cas 系统用于疫苗开发
非洲猪瘟病毒(African swine fever virus,ASFV)是感染猪科动物并引起烈性传染病的大DNA 病毒,是威胁全球养猪业的“头号杀手”。自1921 年首次发现非洲猪瘟以来,对其相关防控工作以及疫苗开发研究一直在推进。2018 年,研究人员利用CRISPR/Cas9 系统将Georgia07毒株中基因组的8-DR基因用红色荧光蛋白替代并获得重组病毒,首次实现了利用CRISPR 技术改造ASFV 基因组的目标[19-20];随后,有研究利用CRISPR/Cas9 系统靶向ASFV 的p30基因(CP204L),敲除p30基因后,可以高效抑制病毒复制,因此p30基因可以作为潜在的疫苗设计靶点,利用其开发减毒或单循环活疫苗[21]。2018 年ASFV 在我国沈阳市首次被发现后[22],开发疫苗有效预防疫情暴发的形势更加紧迫。未来CRISPR 技术可以进一步应用于ASFV 基因缺失活疫苗的研究,为世界范围内非洲猪瘟疫情防控提供候选疫苗。相比同源重组置换基因设计疫苗的方法,利用CRISPR/Cas 系统制备ASFV 多基因缺失弱毒疫苗则更方便快速,可以为非洲猪瘟疫情控制争分夺秒。
4 CRISPR/Cas 系统应用于病毒性疾病诊断
目前常见的病毒性疾病诊断方法主要有PCR检测、ELISA 抗体检测、红细胞吸附试验等。一般情况下这些方法耗时长,操作步骤繁琐,且要求操作人员具备一定的专业水准。CRISPR 技术的出现与发展,为病毒性疾病的快速简便诊断带来了新契机。2016 年5 月,CRISPR/Cas9 系统首次被应用于核酸检测诊断,开辟了CRISPR 技术应用于病毒核酸检测的新纪元[23]。2017 年4 月,基于CRISPR/Cas13a 系统的病毒核酸检测工具SHERLOCK(specific high sensitivity enzymatic reporter unlocking)问世。该系统首先使用重组聚合酶恒温扩增技术(RPA)对病毒核酸样品进行扩增,以提高其检测灵敏度,接下来利用Cas13a 的“附属切割”活性,切割单链RNA 上的报告基团,产生可定量的荧光信号,这样可以灵敏、特异、快速地检测到血液或尿液样本中ZIKV 的存在,但缺点是一次只能检测一种核酸序列,且需要额外的设备收集荧光数据[24]。为解决这些不足,Gootenberg 等[25]对SHERLOCK进行改进获得SHERLOCKv2:一是在检测体系中引入辅助性CRISPR 酶 Csm6,进一步提高其检测灵敏度;二是加入多种Cas 蛋白,根据蛋白酶不同的切割偏好,选取不同的特异性荧光报告基团,实现一次性检测多种类型病毒核酸的目的;三是将纸基传感器引入检测系统,使操作简单方便,可直接用肉眼观察试验结果。此外,SHERLOCKv2 与HUDSON(heating unextracted diagnostic samples to obliterate nucleases)配套使用,可在2 h 内直接对患者样品进行DENV 检测[26]。这些研究成果证明了CRISPR/Cas 系统在RNA 病毒性疾病的核酸检测诊断领域具有巨大的应用价值,对病毒性传染病的及早发现与控制治疗意义非凡。
CRISPR/Cas 系统除了可以诊断RNA 病毒引起的疾病外,还可以诊断DNA 病毒如人乳头瘤病毒(HPV)和ASFV 引起的疾病。与SHERLOCK 类 似,基 于CRISPR/Cas12a 系 统 的DETECTR(DNA endonuclease targeted CRISPR trans reporter)核酸检测系统首先通过RPA 扩增DNA 样品,随后激活Cas12a 的DNase 活性,随意切割带有荧光报告基团的单链DNA,释放荧光信号指示特定的DNA 是否存在,可以从感染多种HPV 亚型的样本中,准确测定出高风险的HPV16和HPV18[27]。DETECTR 不仅为DNA 病毒性疾病的诊断提供了方便快捷的平台,而且有望在抗生素抗性监测和单核苷酸多态性检测等方面发挥巨大的应用潜力[28]。侧向流动检测作为免疫反应最常用的分析技术之一,Wang 等[29]将其与CRISPR/Cas9 系统结合开发了CASLFA(CRISPR/Cas9-mediated lateral flow nucleic acid assay),它可以在短时间内特异性地检测到非实验室环境下可疑样品中的ASFV DNA;Bai 等[30]将重组酶辅助扩增技术(RAA)与CRISPR/Cas12a 系统相结合,可以检测到低至10 amol/L 的ASFVp72基因水平,与横向流条带读数相结合,可供现场即时检测。这些基于CRISPR 的DNA 检测系统,具有便携、简单、灵敏和特异性高的优势,无需医疗专业知识和复杂的辅助设备即可在医疗现场使用,在资源匮乏或非实验室环境中具有巨大的基因分析潜力。
CRISPR 技术的病毒核酸诊断系统为病毒病的及早发现、及早确认和及早控制提供了快捷便利的工具,有望对人类公共卫生安全事业做出重大贡献。目前CRISPR 技术在病毒病检测诊断领域的应用仍在不断发展,HOLMES[31]、CRISDA[32]和CRISPRChip[33]等检测系统的出现以及新发现的Cas14[34]和CasX[35]蛋白的进一步应用,都拓展了CRISPR/Cas 系统在病毒学领域的应用范围。
5 CRISPR/Cas 系统应用于病毒性疾病的临床治疗
5.1 清除患者体内的乙型肝炎病毒
乙肝是由乙型肝炎病毒(HBV)感染所引起的,可通过母婴垂直传播的一种常见传染性疾病。HBV 的共价闭合环状DNA(cccDNA)在慢性乙肝患者中可以稳定存在,作为病毒复制与表达的模板,导致人体内的病毒形成持续性感染。彻底清除宿主细胞内的HBV DNA 是治愈乙肝的标准。虽然乙肝疫苗可以有效阻断乙肝的垂直传播,起到很好的保护作用,但是至今还没有可以彻底清除乙肝患者或病毒携带者体内病毒的有效手段。CRISPR技术是目前可以完全治愈乙肝患者的最有前景优势的工具。2014 年,Lin 等[36]针 对HBV-A 型设计了8 条gRNA,在体内和体外依靠CRISPR/Cas9 系统,对带有HBV 基因组的重组质粒进行切割破坏,从而抑制HBV 感染;2015 年,Wang等[37]针 对HBV-A-D 型设计了15 条gRNA,其中每两条gRNA 自由组合所形成的11 种双gRNA组合介导的CRISPR/Cas9 系统,可以更高效地对HBV 基因组产生破坏,抑制HBV 复制;最近新发现,嗜热链球菌(St)CRISPR/Cas9 系统可以安全、高效、精准地在HBV 的cccDNA 中引入突变或者缺失,从而导致cccDNA 失活[38],这是目前唯一可以让组织中的cccDNA 永久性失活的方法[39]。这些针对HBV 基因组及cccDNA 的研究,证明了CRISPR 技术对HBV 基因组进行编辑的高效性和有效性,为完全清除乙肝患者及病毒携带者体内的HBV 提供了最有前景的治疗策略,为其进一步应用于临床治疗提供了理论基础。
5.2 治疗艾滋病
自1981 年在美国发现首例艾滋病病例以来,HIV 已肆虐到世界各地。目前研究人员针对艾滋病的临床治疗主要聚焦在抗HIV 药物研发、基因疗法、免疫疗法与红细胞诱导等方面,但突破性成果寥寥无几。自CRISPR 技术问世以来,研究人员已将其探索性地应用到艾滋病临床治疗领域,为艾滋病治疗提供新思路和新方向。Kaminski 等[40]针对HIV-1 基因组的长末端重复序列设计gRNA,经Cas9 编辑后,HIV-1 基因组缺失了9 709 个核苷酸,基本上完全清除了HIV-1 基因组;2019 年7 月,研究人员开发出一种持续递送抗逆转录病毒的给药系统,与CRISPR/Cas9 系统联合后,可以有效治疗艾滋病,将其应用于小鼠动物实验中,近三分之一的小鼠体内没有检测到HIV[41];2019 年9 月,Xu 等[42]首次利用CRISPR/Cas9 系统在体外敲除正常造血干细胞中的CCR5基因,再将编辑后的干细胞移植到艾滋病和急性淋巴细胞白血病并发的患者体内,经过19 个月的观察,发现携带CCR5突变的供体细胞能够在受体体内长期存活,且无脱靶效应,这个试验虽然缓解了急性淋巴细胞白血病,但是没有将HIV 感染效果抑制到预期水平。该研究初步探索了CRISPR 技术用于艾滋病临床治疗的可行性和安全性,为艾滋病的完全治愈带来了新希望。
虽然CRISPR/Cas 系统在疾病的模型构建和病毒病的治疗领域显示出强大的应用潜力,但是基因编辑技术现阶段应用于临床治疗还有许多亟待解决的问题,如脱靶和免疫反应等,研究人员需继续努力,以克服这些障碍。
6 展望
CRISPR/Cas 系统在病毒学领域的应用主要包括抗病毒药物靶点的筛选、疫苗开发、病毒性疾病的核酸检测诊断、临床治疗等方面,发展潜力巨大,未来前景可观。本实验室已建立了基于CRISPR/Cas9 系统的人和小鼠的全基因组筛选平台,用于筛选调控流感病毒、狂犬病病毒以及艾滋病病毒等复制的关键宿主基因,目前已取得不错进展。调控病毒复制的关键宿主基因的筛选鉴定及其作用机制研究,将为阐明这些病毒的致病机制提供重要帮助。
随着对CRISPR/Cas 系统研究的不断深入,更高效、更精确、更安全的CRISPR 相关技术层出不穷,如Campa 等[43]把Cas12a、CRISPR 序列和多个RNA 分子,按顺序依次保存在Pol II 启动子下的转录本中,可以同时修饰调节25 个靶点;CRISPR-AID 技术可以同时实现基因的激活、干扰以及删除[44];新开发的CRISPR Live FISH 技术,可以实时观测活细胞中基因组编辑的动态情况[45]。这些研究成果丰富了CRISPR 技术的理论内容,奠定了操作性强的实践基础,为病毒学领域的科学研究不断提供可靠的理论支撑和强有力的工具。
虽然CRISPR/Cas 系统已被证明是有效的基因编辑技术,但是仍不可忽视其存在的致癌风险[46-47]、脱靶效应[48]以及递送系统的安全准确性不足等问题。以CRISPR/Cas9 系统为例,目前对其优化的主要策略分3 种:一是筛选Cas9 蛋白的小分子抑制剂和研究抗CRISPR 蛋白作用机理,有效控制CRISPR/Cas9 系统[49-51];二是在Cas9上引入特定的多肽链调控其活性[52],或者开发Cas9 的同系物和蛋白突变体[53-54],还可以设计sgRNA 的二级结构等[55],这都可以降低系统脱靶率,提高特异性;三是开发纳米胶囊或化学修饰的sgRNA 脂质纳米颗粒,精准递送CRISPR/Cas 系统[56-57]。CRISPR 技术的不断完善、改进与创新,为其进一步在病毒学领域的应用研究提供了理论基础和创新思路,极大地推动了病毒学的发展。
