一种新型羧酸化合物的合成研究
2020-06-08张传磊姚志龙
张传磊,姚志龙
(安庆师范大学化学化工学院,安徽安庆246133)
半刚性三角形羧酸化合物因其独特的结构和性质引起化学家的广泛关注[1-3]。目前报道的羧酸类化合物多表现为刚性或纯柔性,半刚性化合物研究较少且含亚甲基的半刚性化合物更是鲜有报道[4-5]。刚性化合物一般具有良好的稳定性,在光致发光、吸附分离、气体存储等方面应用广泛[6-9];柔性化合物相对刚性化合物来说,具有一定灵活性,在人造器官、柔性皮肤等方面有很高的应用价值[10-14]。半刚性化合物兼具柔性化合物和刚性化合物的特点,可使组装体系呈现出一种灵活多变的状态,同时其在溶液中可以保持很高的稳定性,使该类组装体系在吸附分离、气体存储、分子识别、药物缓释等方面展示出更好的应用。
羧酸类化合物种类繁多、结构多样、性能稳定,以其为基础的组装材料在气体吸附、小分子识别等诸多方面被广泛应用[6-8,15]。例如,Yaghi等小组利用一系列刚性羧酸配体得到了具有不同形状和尺寸的孔洞配位聚合物IRMOF-1,IRMOF-8,IRMOF-11,MOF-177等,这些配位聚合物的结构具有较大的刚性和稳定性,对于研究气体的吸附有很大的指导意义[16-17]。Ghosh课题组利用2-苯基-5,4′-吡啶二羧酸(H2L)构筑了Zr-MOF:Zr6O(4OH)(4L)6,研究结果显示除去客体分子的Zr-MOF在水介质中甚至在有其他硝基化合物存在条件下能够高选择性和灵敏地检测出2,4,6-三硝基苯酚(TNP),该工作第一次展示出MOF在实时检测水体系中爆炸物分子的潜力[18]。Ma 等报道了含有2,2′-联吡啶-3,3′-二羧酸(H2BPDC)和草酸(H2OX)混合配体的4d-4f 混合金属-有机框架(HMOF)化合物{[Ln3Ag3(BPDC)5(OX)(H2O)7]·7H2O}n(Ln=Tb,Gd),研究结果显示,丙酮和3-戊醇的存在可显著降低HMOF 中稀土金属Tb 离子的发光强度,表明HMOF可以用于识别丙酮和3-戊醇分子[19]。
基于此,本文通过多步反应合成一种半刚性的三角形羧酸化合物:4',4'',4'''-(nitrilotris(methylene))tris([1,1'-biphenyl]-4-carboxylic acid)(H3L),该化合物中亚甲基因具有一定的旋转度表现出柔性特性,二联苯环则表现出刚性特性。H3L兼具柔性和刚性的优点,为后续的相关材料合成研究提供更多的选择性,同时为更多的类似化合物的合成提供了一个思路。
1 仪器与试剂
1H NMR 谱用 BruckerAM-400 (400 MHz)型核磁共振仪,DMSO 为溶剂,内标为TMS,δ(10-6);13C NMR谱用BruckerAM-400型核磁共振仪,DMSO为溶剂,内标为TMS,δ(10-6),Nicolet iS50型傅里叶变换红外光谱仪(KBr压片);日立F-4500荧光分光光度计(CHCl3为溶剂);予华X-4数字显示显微熔点测定仪,温度计未经校正;柱层析硅胶(烟台江友硅胶开发有限公司)200~300目。
四(三苯基膦)钯根据文献[20]合成,剩余试剂中除1,2-二氯乙烷,二恶烷,甲醇,氢氧化钠和硫酸为分析纯外,其余试剂均为化学纯,溶剂都经过干燥处理。
2 实验方法
2.1 实验步骤
(1)三(4-溴苄胺)的合成
在装有冷凝回流管的两口瓶中加入3.74 g(20 mmol)对溴苄胺和9.25 g(50 mmol)对溴苯甲醛,抽真空后鼓泡加入50 mL 1,2-DCE,室温下搅拌至完全溶解后加入10.60 g(50 mmol)三乙酰氧基硼氢化钠,再次抽真空。室温搅拌下24小时,整个实验装置处于N2保护下。真空蒸除溶剂后将反应混合物用饱和NaHCO3水溶液中和后用CHCl3萃取。合并有机相后,在萃取液中加入无水硫酸镁干燥,并用真空蒸除溶剂。将残余物在硅胶柱上色谱分离(洗脱剂为纯石油醚),真空蒸除溶剂得到白色固体9.65 g,产率约为92.1%。产率较文献[20]报道的71%有较大提升。m.p 77.5~79.0oC;m/z(DTT:TG=1:1 as a matrix)524([M+],35%),526([M++2],45%),528([M++4],40%),530([M++6],18%);1H NMR(400 MHz,DMSO,25oC,TMS,×10-6)δ =7.44(d,6H),7.22(d,6H),3.45(s,6H)。
(2)L-COOCH3的合成
在装有冷凝回流管的两口瓶中加入5.24 g(10 mmol)三(4-溴苄胺)、8.0 g(44 mmol)4-甲氧羰基苯硼酸和3.0 g碳酸钾,氮气保护下,鼓泡加入150 mL二恶烷和75 mL蒸馏水,100 ℃下搅拌反应72小时。冷却至室温,旋转蒸发掉溶剂,用CHCl3/H2O萃取三次,合并有机相,加入无水硫酸镁干燥,抽滤并旋干溶剂。将残余物在硅胶柱上进行色谱分离(洗脱剂为石油醚:乙酸乙酯=10:1),旋干溶剂得白色固体2.85 g,产率约为41.2%(基于三(4-溴苄胺))。1H NMR(400 MHz,DMSO,25oC,TMS,×10-6),δ=8.02-8.04(d,6H),7.82-7.85(d,6H),7.75-7.77(d,6H),7.56-7.58(d,6H),3.65(s,6H),3.88(s,9H)。
(3)目标产物H3L的合成
把合成的L-COOCH3加至圆底烧瓶中,然后分别加入150 mL CH3OH 和溶入6 g NaOH 的20 mL 水溶液,80 ℃下回流反应24 小时待反应物变为乳白色粘稠物。把所得粘稠物真空蒸除溶剂后加入蒸馏水,抽滤,滤渣用蒸馏水洗涤。合并滤液并滴加稀硫酸酸化,调节pH至5.0,出现大量白色沉淀。抽滤,滤饼用蒸馏水洗涤3 次,红外灯干燥后得到灰白色固体1.58 g,产率约为59.2%(基于L-COOCH3)。1HNMR (400 MHz,DMSO,25oC,TMS,×10-6),δ= 12.96 (s,3H),8.00-8.02(d,6H),7.79-7.81 (d,6H),7.73-7.75(d,6H),7.54-7.57(d,6H),3.35-3.63(s,6H).13C NMR (101 MHz,25oC,DMSO,TMS,×10-6)δ=167.58,144.52,139.78,138.17,130.41,129.94,129.62,129.55,127.42,127.27,127.12,57.21.FTIR(v,cm-1):3 423.57(s);2 922.97(w);1 687.09(vs);1 607.86(vs);1 525.59(m);1 426.26(w);1 385.40(m);1 313.75(m);1 277.85(s);1 178.13(s);1 118.30(m);1 005.72(s);823.13(m);773.11(vs);701.37(m).
2.2 合成路线
半刚性三角形羧酸H3L的合成路线如图1所示。
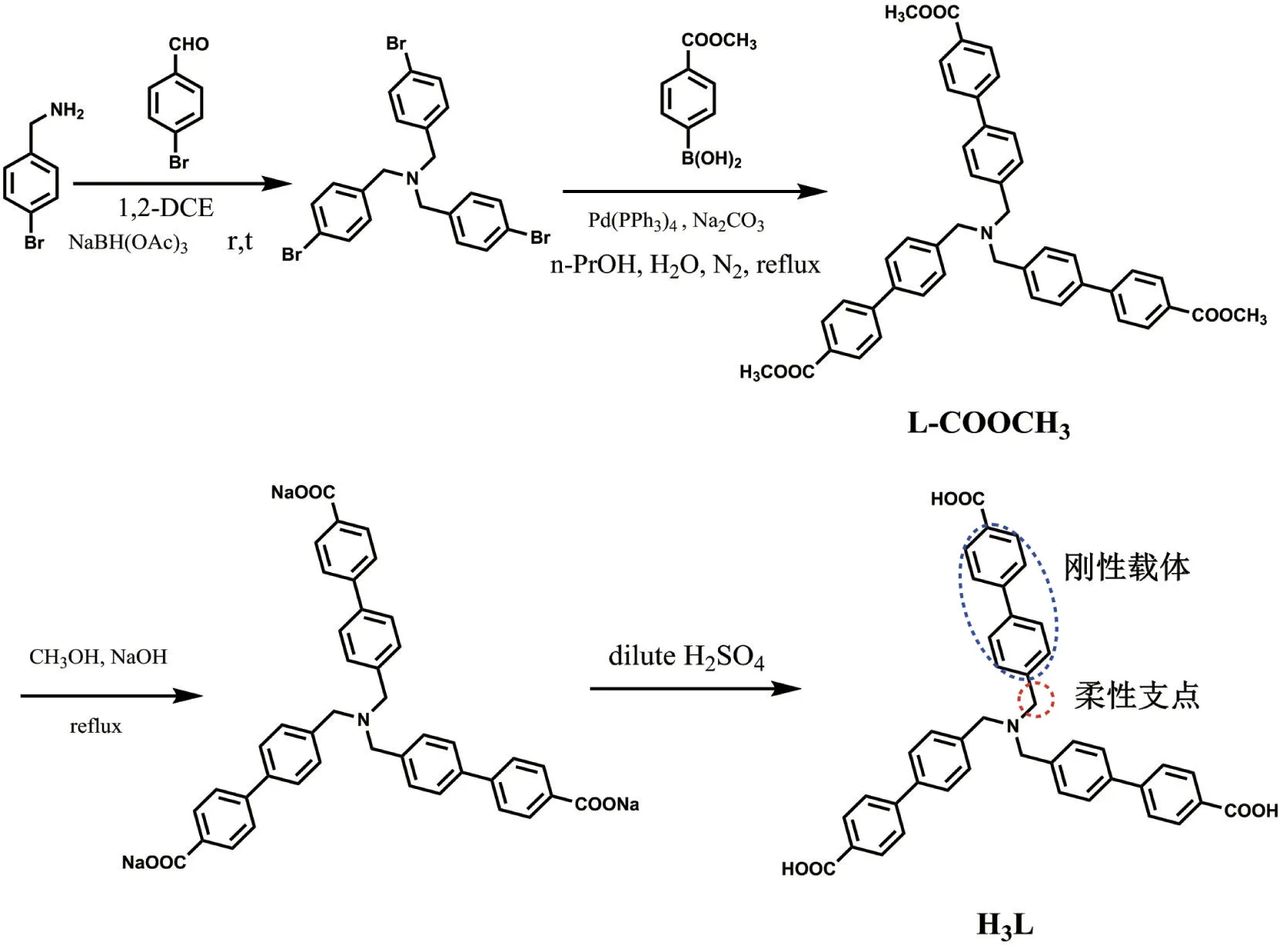
图1 半刚性三角形羧酸H3L的合成路线
3 结果与讨论
3.1 1HNMR分析
采用1H NMR对L-COOCH3和所得目标产物H3L的化学结构进行表征,溶剂均为氘带DMSO。在图2中,共有6组氢谱峰:δ1=3.65×10-6对应于单峰亚甲基上的氢位移;δ2=3.88×10-6对应于酯基上的氢位移;δ3=7.56 ×10-6和7.58 ×10-6,δ4=7.75 ×10-6和7.77 ×10-6,分别对应于亚甲基端苯环上的两组双重峰;δ5=7.82 ×10-6和7.85 ×10-6,δ6=8.02 ×10-6和8.04 ×10-6分别对应于酯基端苯环上的两组双重峰。6组峰面积比值为A1:A2:A3:A4:A5:A6:=1 :1.5 :1 :1 :1 :1。6组氢谱峰的氢位移和峰面积均与ChemBioDraw软件(美国CambridgeSoft 公司)模拟所得L-COOCH3的核磁氢谱一致(图3)。图4 中,同样有6 组氢谱峰:δ1=3.63 ×10-6对应于单峰亚甲基上的氢位移;δ2=7.54 ×10-6和7.57 ×10-6,δ3=7.73 ×10-6和7.75 ×10-6,分别对应于亚甲基端苯环上的两组双重峰;δ4=7.79 ×10-6和7.81×10-6,δ5=8.0 ×10-6和8.02 ×10-6分别对应于羧基端苯环上的两组双重峰;δ6=12.96×10-6对应于羧基上的氢位移。6 组峰面积比值为A1:A2:A3:A4:A5:A6:=2 :2 :2 :2 :2 :1。6组氢谱峰的氢位移和峰面积均与ChemBioDraw软件模拟所得H3L的核磁氢谱一致(图5)。
3.2 13CNMR分析
采用13C NMR对所得目标产物H3L的化学结构进行表征,溶剂均为氘带DMSO。在图6中,共有10组碳谱峰:δ1=167.58 ×10-6对应于羧基上的碳位移;δ2=144.52 ×10-6和δ3=139.78 ×10-6分别对应于二联苯环连接部位的碳位移(δ2=144.52×10-6对应于连接羧基的苯环上的碳位移);δ4=138.17×10-6对应于亚甲基与苯环连接部位的碳位移;δ5=130.41×10-6对应于羧基与苯环连接部位的碳位移;δ6=129.62×10-6和127.27×10-6依次对应于羧基端苯环上未取代双碳的碳位移;δ7=127.42×10-6和δ8=127.12×10-6依次对应于亚甲基端苯环上未取代双碳的碳位移;δ10=57.21×10-6对应于亚甲基上的碳位移。10组峰面积比值为A1:A2:A3:A4:A5:A6:A7:A8:A9:A10≈ 1 :1 :1 :1 :2:1 :2 :2 :2 :1。 10组碳谱峰的位移和峰面积之比均与ChemBioDraw软件模拟所得H3L的核磁碳谱一致(图7)。
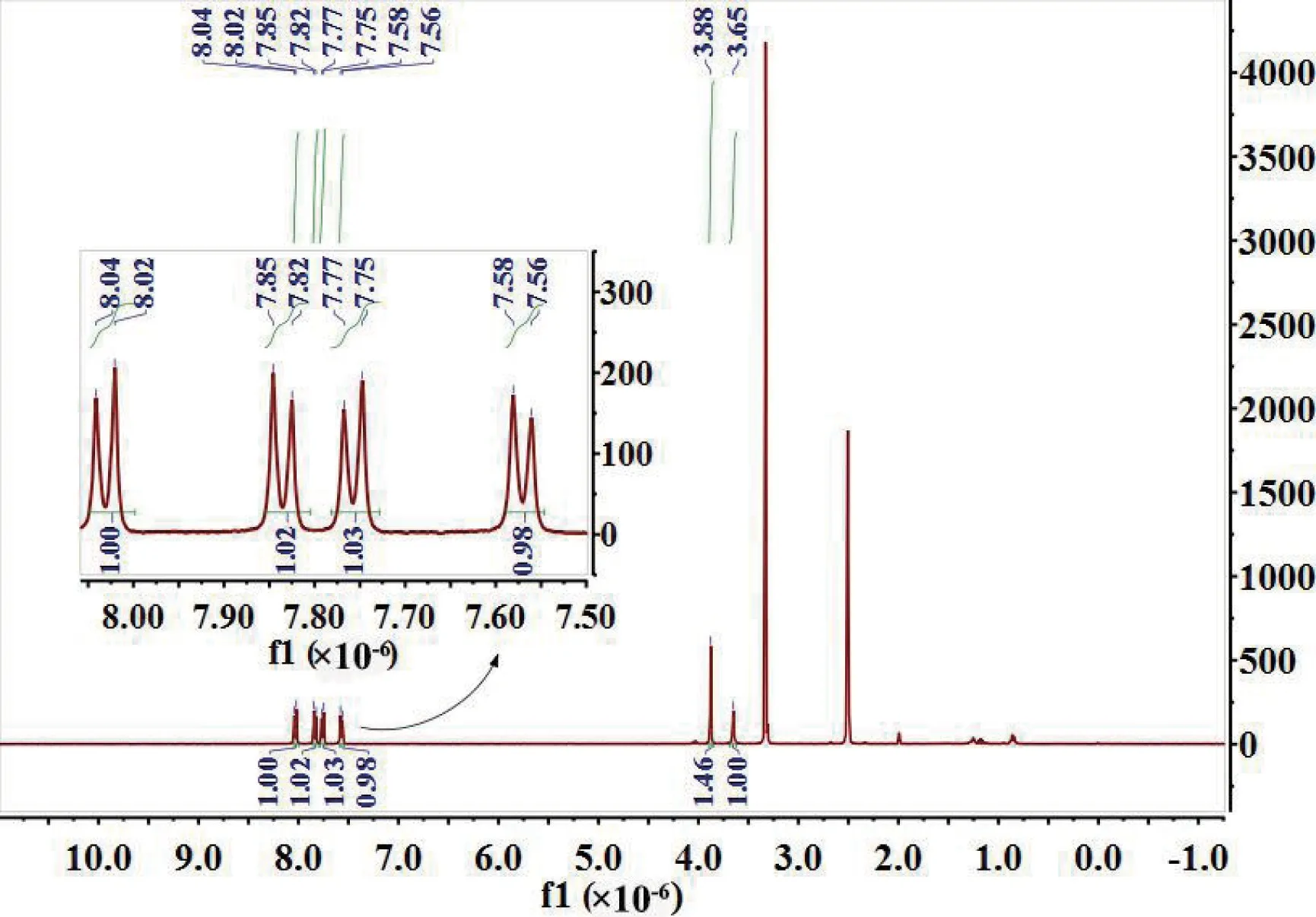
图2 L-COOCH3的核磁氢谱图

图3 ChemBioDraw软件模拟的L-COOCH3核磁氢谱图

图4 H3L的核磁氢谱图

图5 ChemBioDraw软件模拟的H3L核磁氢谱图
3.3 红外光谱
从产物的红外光谱图(图8)可知,3 423.57 cm-1处强而较宽的峰表明产物中存在-OH基团,2 922.97 cm-1处为-CH2的伸缩振动峰,1 687.09 cm-1处强峰表明存在C=O官能团,1 607.86 cm-1和1525.59 cm-1处是苯环的骨架伸缩振动峰,1 385.40 cm-1处是芳环的C-H的伸缩振动峰,1 277.85 cm-1处是C-O伸缩振动峰,1 178.13 cm-1处是C-C伸缩振动峰,1 118.30 cm-1处为C-N的伸缩振动峰,1 005.72 cm-1处是芳环C-H的面内变形振动峰,指纹区823.13 cm-1,773.11 cm-1和701.37 cm-1等特征吸收峰表明结构中含有苯环结构。
3.4 荧光光谱
共轭良好的刚性化合物往往具有较好的发光性能,如TPA(tris(4′-carboxybiphenyl)amine)[21],TPY(Tris[4-(3-terpyridinylphenyl)phenyl]amine)[22],此类化合物由于刚性太强,发射波长往往在紫外区(200 nm~380 nm)。而柔性化合物虽具有可调的结构多样性,但是纯柔性化合物的共轭效果太差,一般显示不出发光性能或者发光性能较差。为了获得在可见光区具有良好发光性能的有机化合物,可以从有机化合物骨架的刚柔性出发,设计兼具柔性和刚性的化合物。半刚性目标产物H3L 的荧光光谱如图9 所示,在309.6 nm 的光照激发下,H3L 中含共轭双键结构的二联苯环吸收激发光的能量由基态跃迁到激发态,而后由不稳定状态的激发态辐射跃迁到基态时得到最大发射波长为402.6 nm 的可见蓝紫光。这一发光特征有望为有机发光材料的研究提供一定的借鉴作用。

图6 H3L的核磁碳谱图
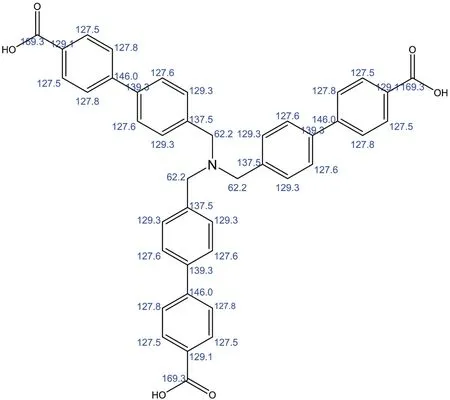
图7 ChemBioDraw软件模拟的H3L核磁碳谱图
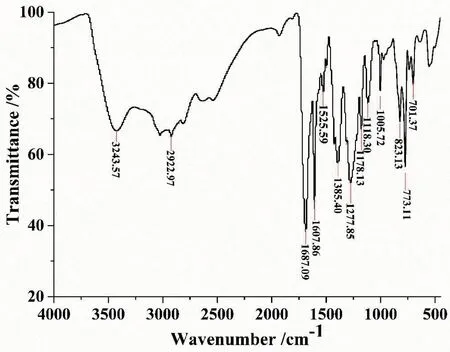
图8 H3L的红外光谱图

图9 H3L的荧光光谱图
4 总 结
综上,以对溴苄胺和对溴苯甲醛为起始原料,经取代反应、钯催化的Suzuki偶联反应、碱性水解反应及酸化反应,合成了一种新型半刚性三角形羧酸化合物H3L,产品的最终产率为24.4%(基于三(4-溴苄胺))。本文的制备方法具有原料廉价易得、反应条件相对温和、产品质量稳定等特点。H3L兼具柔性和刚性的优点,为有机发光二级光(OLED)等材料的合成提供了一种选择,同时为更多的类似化合物的合成提供了一种思路。
