基于ITS和RLKs序列的苦荞种质资源遗传多样性分析
2020-06-01张久盘常克勤杨崇庆穆兰海杜燕萍
张久盘 常克勤 杨崇庆 穆兰海 杜燕萍

摘 要 为明确苦荞资源的遗传多样性水平及遗传关系,对45份苦荞地方品种的ITS和RLKs序列进行基因测序和序列比较分析。结果显示,苦荞ITS和RLKs扩增序列较为保守,基因多态位点数分别占10.6%和7.7%。云贵川地区苦荞材料的遗传多样性最丰富,陕西、山西及宁夏地区次之,甘肃及内蒙古地区最低。四川和贵州地区的苦荞品种均能够单独聚为一类,基于ITS序列构建的NJ树中,陕西地区以北的苦荞品种未形成明显的分支,而云南地区的苦荞穿插在不同的分支中;基于RLKs基因构建的NJ树中,同一地区的苦荞材料较为明显地形成地域聚类,但自展值均较低。
关键词:苦荞;遗传多样性;ITS;RLKs
荞麦(Fagopyrum tataricum)又称乌麦、三角麦、花荞、荞子,属于蓼科(Polygnaceae)荞麦属(Fagopyrum),起源于我国西南地区[1]。目前,发现荞麦共有28个种、亚种和变种,而荞麦栽培种仅有甜荞和苦荞,其生物学特征及栽培适宜区域均有所不同[2]。荞麦营养成分均衡,富含赖氨酸[3-5]及黄酮类化合物,具有降低“三高”、软化血管、保护视力和预防脑溢血的作用[6-7],是药食兼用的保健和功能产品。由于荞麦具有抗逆性强、适应性广、耐瘠薄耐粗放等优点,成为生产条件较差的地区大量种植的粮食作物。
过去国内外学者多采用形态学标记、细胞学标记、种子蛋白标记和同工酶标记等方法对荞麦亲缘关系及遗传多样性进行分析,但分子标记技术已成为近年来最主要的种质资源遗传多样性分析手段,国内外广泛使用RAPD、AFLP、SSR等分子标记来评价荞麦遗传多样性。胡亚妮等[8]基于ITS和ndhF-rpl32序列构建的进化树将71份荞麦材料分为大粒组和小粒组,而ndhF-rpl32序列构建的进化树还能区分栽培甜荞和野生甜荞,具有更好的聚类效果。李敏等[9]利用PAL基因将67份苦荞地方品种分为7个类群,分类与地理类群无关,仅来源于西藏的5份材料单独聚为一枝;PAL基因在苦荞中遗传较稳定,多数材料之间变化差异较小,在西藏部分材料中可能存在突变的热点区。梁成刚等[10]研究表明荞麦属MAPK基因序列高度保守,通过聚类分析发现野生甜荞与左贡野荞被聚为一类,野生苦荞、毛野荞、大野荞、金荞麦、细柄野荞和硬枝万年荞被聚为一大类。
本研究以45份苦荞为试验材料,通过PCR直接测序的方法获得ITS和RLKs基因序列,进行序列差异和聚类分析,阐明苦荞地方品种的遗传多樣性水平,旨在揭示我国苦荞种质资源间的遗传关系,为苦荞种质资源的收集、保护、利用提供依据。
1 材料与方法
1.1 试验材料
试验材料为苦荞地方品种,共45份,分别收集自四川、贵州、云南及宁夏等8个省份(自治区),供试材料的代码、名称及来源见表1。
1.2 试验方法
1.2.1 DNA提取
采集供试材料3~4片叶龄时的嫩叶0.5 g,利用Tiangen公司植物基因组DNA提取试剂盒(DP305)提取样本DNA,用1%琼脂糖凝胶电泳和分光光度计检测DNA的纯度和浓度。
1.2.2 PCR扩增、测序
用于扩增目的片段ITS和RLKs的引物序列如下。
ITS: F5'-TCCTCCGCTTATTGATATGC-3',R5'-TCCGTAGGTGAACCTGCGG-3'。RLKs:F5'-GT-GTTGCTCACCAGTTGGATT-3',R5'-TTC-TATCCAGTGGGGTGACTG-3'。引物序列由北京擎科生物技术有限公司合成。
PCR反应体积20 uL,包括2×Taq PCR预混试剂Ⅱ2.8 uL、10 mM引物各0.6 uL、DNA模板1 uL、ddH2O 15 uL。PCR反应程序:95 ℃预变性3 min;94℃ 变性30 s,54 ℃/56 ℃(ITS/RLKs)退火30 s,72 ℃延伸90 s,共30个循环;72 ℃延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测后送至北京擎科生物有限公司进行测序。
1.2.3 数据分析
通过Chromas 1.45软件获得原始序列数据,用ClustalX 1.83程序对测得的DNA序列进行比对,并加以人工校对,用DnaSP 5.1软件[11]统计多态位点。用Modeltest 3.06软件[12]选择2个基因片段核苷酸的最佳替换模型,根据最佳替换模型运用Mega 5.0软件[13]进行遗传多样性指数、差异位点的统计分析及遗传距离的计算。基于Jukes-Cantor距离法,进行1 000次自展重复检测支持率,构建Neighbor-Joining(邻接法)系统发育树。
2 结果与分析
2.1 ITS和RLKs序列特征及遗传多样性参数分析
经PCR扩增、测序分别获得43条ITS和45条RLKs同源序列。经过DNA序列比对,切除两端引物序列后,获得ITS和RLKs同源序列片段长度分别为539 bp和815 bp。利用MEGA 5.0和DnaSP 5.1软件对ITS、RLKs序列数据进行分析,在ITS序列539个位点中,变异位点为57个,基因多态位点百分比为10.6%;在815 bp的RLKs序列矩阵中,变异位点63个,基因多态位点百分比为7.7%。苦荞各地方品种两序列的变异信息及遗传多样性参数见表2。
不同地区的苦荞品种ITS序列的核苷酸多样度π的变化范围为0.001 9~0.010 5,平均杂合度θ的变化范围为0.001 9~0.015 1;RLKs基因的核苷酸多样度π的变化范围为0.002 2~0.009 0,平均杂合度θ的变化范围为0.002 4~0.012 2。从ITS和RLKs序列的π值和θ值看出,贵州、四川和云南地区苦荞材料的遗传多样性最丰富,陕西、山西及宁夏地区次之,甘肃及内蒙古地区的苦荞材料的遗传多样性最低。
2.2 基于ITS和RLKs序列的苦荞组内及组间遗传距离分析
利用MEGA 5.0软件,基于Jukes-Cantor距离模型分析ITS和RLKs序列数据,将来源相同省(自治区)的苦荞品种进行分组,得到不同地方来源苦荞的组内平均遗传距离(表3)及组间平均遗传距离(表4)。
由表3和表4可知,基于ITS序列的组内遗传距离为0.002~0.011,贵州、四川及陕西苦荞材料组内遗传距离相对较大;内蒙古与云南、四川地区的苦荞材料组间遗传距离较大,陕西与云南地区、内蒙古与贵州地区的苦荞材料组间遗传距离次之。基于RLKs序列组内遗传距离为0.002~0.010,贵州、四川及云南苦荞材料组内遗传距离相对较大;内蒙古与云南地区、四川地区的苦荞材料组间遗传距离较大,陕西与云南地区的苦荞材料组间遗传距离次之。
从结果来看,无论是相同地方的苦荞品种间还是不同地方的苦荞品种间,遗传距离基本处于同一水平。北方产区的苦荞资源变异较小,而南方产区苦荞变异较为丰富,且北方产区苦荞与南方产区苦荞组间遗传距离相对较大。
2.3 基于ITS和RLKs序列的系统发育树分析
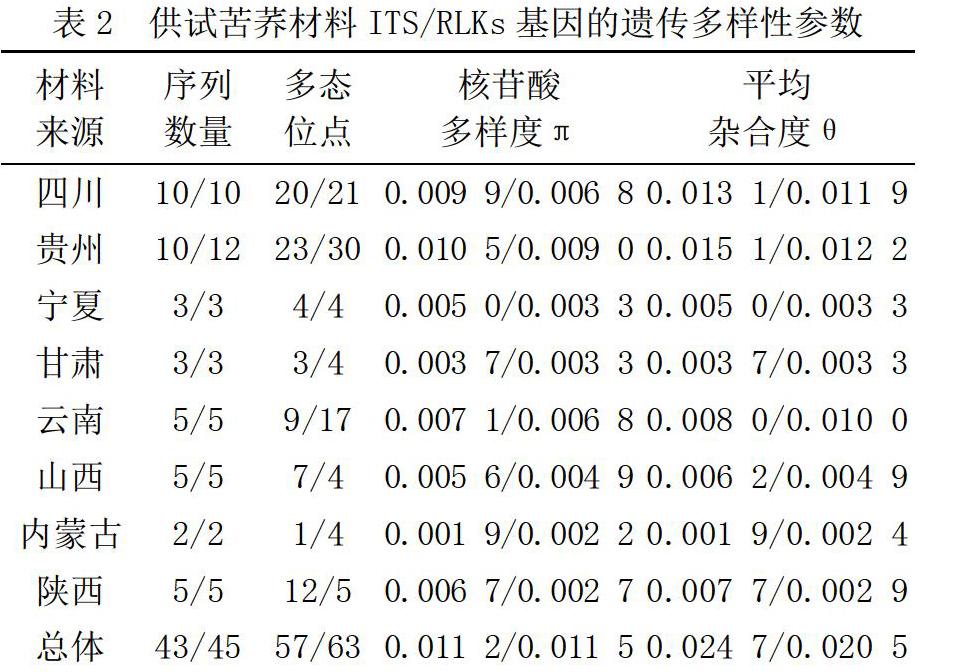
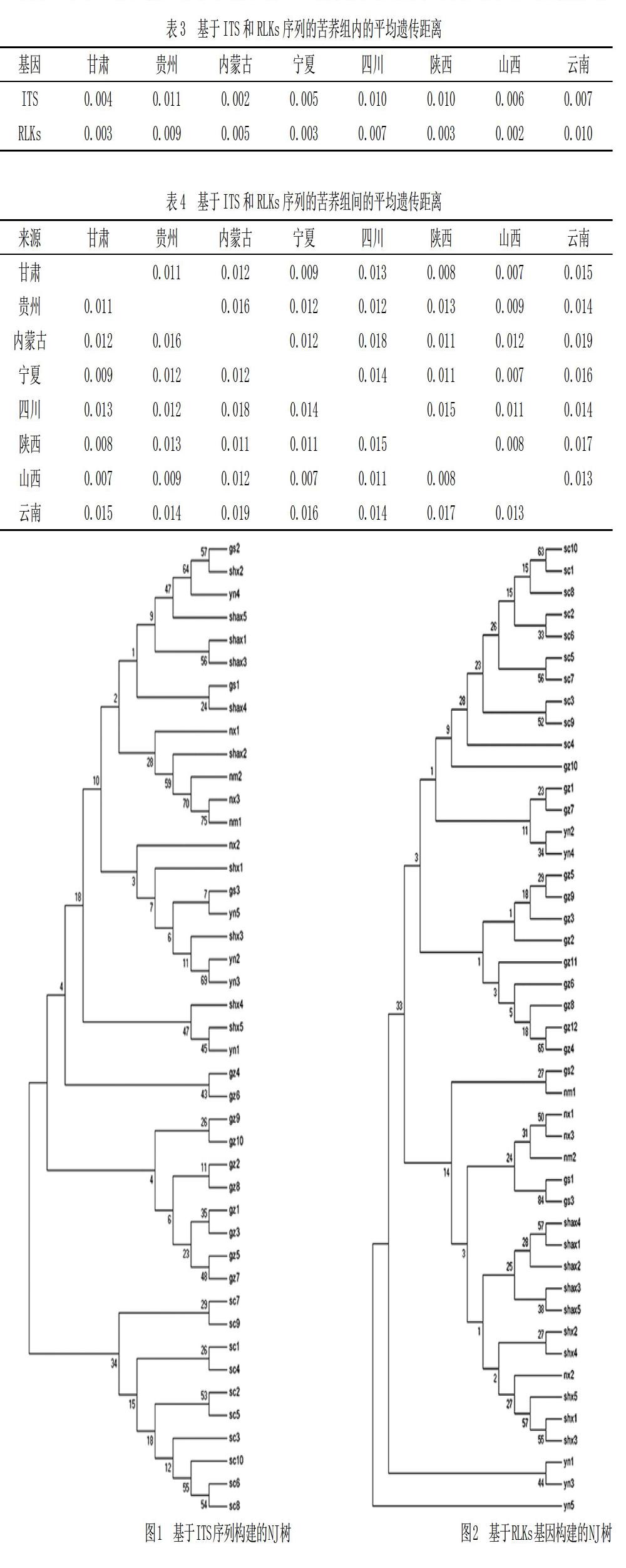
利用ITS和RLKs序列数据构建的系统发育树如图1、图2所示。
从图1和图2可以看出,基于ITS和RLKs序列构建的NJ系统发育树中,四川和贵州地区的苦荞品种均能够单独聚为一类,具有明显的地域聚类特点。基于ITS序列构建的发育树中,陕西地区以北的苦荞品种未形成明显的分支,组成较为分散,而云南地区的苦荞穿插在不同的分支中。基于RLKs基因构建的NJ树中,同一地区的苦荞材料较为明显的形成地域聚类,但自展值均较低。
3 讨论与结论
3.1 基于ITS和RLKs序列的苦荞遗传多样性
遗传多样性是物种多样性的重要及核心组成部分,代表着生物携带的遗传信息总和,对物种的遗传、进化和变异具有决定性作用[14]。核苷酸多样度(π)是个体间待检测位点的平均多样性,代表一个基因的遗传变异程度[15]。本研究中,ITS和RLKs基因序列的核苷酸多样度(π)分别为0.011 2和0.011 5,均高于苦荞PAL基因的核苷酸多样度(π=0.003 4),但两基因序列的平均杂合度(θ)(ITS/0.024 7,RLKs/0.020 5)均低于苦荞PAL基因中的平均杂合度(θ=0.014 3)[15]。以上研究结果表明核苷酸多样性的变异程度,随作物基因类型的不同而不同。
本研究中,无论是基于ITS和RLKs序列的数据分析结果均表明,贵州、四川和云南地区苦荞材料的遗传多样性最丰富,陕西、山西及宁夏地区次之,甘肃及内蒙古地区的苦荞材料的遗传多样性最低,这与屈洋等[16]研究得出的北方苦荞产区的多样性水平低于西南苦荞产区的结论一致,在一定程度上支持了西南地区的云南、四川、贵州地区一带是苦荞麦的现代分布中心和起源地之一[17],贵州地区更接近中国荞麦次生起源地之一的川中南部地区[18]等学说。
3.2 基于ITS和RLKs序列的聚类分析
本研究基于ITS和RLKs序列分别对所收集的苦荞材料进行聚类分析,据系统进化树来看,四川和贵州地区的苦荞品种均能够单独聚为一类,但自展值均较低。形成这一结果的原因可能是该地区苦荞材料在遗传组成上与其他地区差异较大,产生了遗传分化,也有可能与自然环境、产地的气候有关,具体原因需要借助進一步的研究来挖掘。
基于ITS序列构建的发育树中,陕西地区以北的苦荞品种未形成明显的分支,组成较为分散,表明该地区的苦荞材料在遗传组成上差异较小,未形成明显的遗传分化。而云南地区的苦荞穿插在不同的分支中,说明云南地区的苦荞材料既产生了遗传分化,也具有遗传相似性。基于RLKs基因构建的NJ树中,同一地区的苦荞材料较为明显地形成地域聚类,但系统进化树中自展值均较低。
参考文献:
[1] 陈庆富.荞麦属植物科学[M].北京:科学出版社,2012.
[2] 任长忠,赵钢.中国荞麦学[M].北京:中国农业出版社,2015.
[3] Ahmed A,Khalid N,Ahmad A,et al.Phytochemicals and biofunctional properties of buckwheat: a review[J].Journal of Agricultural Science,2014,152(3):349-369.
[4] 林汝法.苦荞举要[M].北京:中国农业科技出版社,2013.
[5] Jacquemart A L,Ledent J F O,Quinet M,et al.Isbuckwheat (Fagopyrum esculentum Moench) still a valuable crop today?[J].European Journal of Plant Science & Bio-technology,2012,6(2):1-10.
[6] 徐珑珀.荞麦营养与化学成份研究进展[J].四川化工,2014,17(4):4-8.
[7] 张玲,高飞虎,高伦江,等.荞麦营养功能及其利用研究进展[J].南方农业,2011,5(6):74-77.
[8] 胡亚妮,张宗文,吴斌,等.基于ITS和ndhF-rpl32序列的荞麦种间亲缘关系分析[J].生物多样性,2016,24(3):296-303.
[9] 李敏,张宗文,李艳琴,等.基于PAL基因序列的地方苦荞品种遗传多样性分析[J].植物遗传资源学报,2017,18(3):530-537.
[10] 梁成刚,陈晴晴,石桃雄,等.荞麦属植物MAPK基因片段序列比较与进化关系研究[J].浙江农业学报,2016,28(10):1631-1636.
[11] Librado P,Rozas J.DnaSP v5: A software for comprehensive analysis of DNA polymorphism data[J].Bioinformatics,2009,25(11):1451-1452.
[12] Posada D,Crandall K A.Modeltest: Testing the model of DNA substitution [J].Bioinformatics,1998,14(9):817-818.
[13] Tamura K,Peterson D,Peterson N,et al.MEGA5: Molecular Evolutionary Genetics Analysis Using Maximum Likelihood, Evolutionary Distance, and Maximum Parsimony Methods[J].Molecular Biology & Evolution,2011,28(10):2731-2739.
[14] 蒲艷艳,宫永超,李娜娜,等.中国大豆种质资源遗传多样性研究进展[J].大豆科学,2018,37(2):315-321.
[15] 陈吉宝,景蕊莲,员海燕,等.小麦TaDREB1基因的单核苷酸多态性分析[J].中国农业科学,2005,38(12):2387-2394.
[16] 屈洋,周瑜,王钊,等.苦荞产区种质资源遗传多样性和遗传结构分析[J].中国农业科学,2016(11):2049-2062.
[17] 杨学乐,何录秋,邱博,等.荞麦生物学研究进展[J].作物研究,2018,32(2):169-174.
[18] Tsuji K,Ohnishi O.Phylogenetic relationships among wild and cultivated Tartary buckwheat(Fagopyrum tataricum Gaert.) populations revealed by AFLP analyses[J].Genes & Genetic Systems,2001,76(1):47-52.
(责任编辑:赵中正)
