检测金黄色葡萄球菌的微叉指电极阻抗生物传感器研究
2020-05-29王春皓崔传金谷学静陈宏硕张学超李静
王春皓,崔传金,*,谷学静,陈宏硕,2,张学超,李静
(1.华北理工大学电气工程学院,河北唐山063210;2.山西农业大学工学院,山西太谷030801;3.贵州铜仁学院,贵州铜仁554300)
金黄色葡萄球菌(金葡,Staphylococcus aureus)是一种可以通过食物、水、空气等多种途径传播的食源性致病菌,其可能会引起食物中毒、急性肺炎等症状,也可能给皮肤造成很大的伤害等[1-3],给人们带来极大恐慌。目前对于金黄色葡萄球菌的检测主要通过聚合酶链式反应技术、酶联免疫技术等免疫手段来实现[4],然而这些方法存在诸多缺陷、并不适用于现场快速检测,相比之下电化学传感器的性能则更为优越,特别是电化学阻抗生物传感器,这类传感器主要通过测量电化学反应中阻抗的变化,实现对被测物的快速检测[5]。
微叉指电极是一种可以在阻抗传感器中作为信号转换器的电极形式[6],其检测时,首先将电极连入电化学工作站来获得分布在其周边的电场,由于细菌等待测物可与电极表面的抗体等目标受体发生特异性反应,引起周围电场变化,因而可以通过电化学阻抗谱技术检测到其表面发生的阻抗变化,从而进一步检测出待测微生物的浓度。其在微生物的检测方面应用较为广泛,Uria等[7]等制备了检测牛奶中大肠杆菌的铂叉指电极阻抗传感器,其检测范围为102cfu/mL~106cfu/mL。刘双等[8]设计了一种基于金微叉指电极的检测牛奶中体细胞数的阻抗生物传感器,其不仅能够正确区分出的不同浓度的试验奶样,而且还得出了其传感器等效电路中常相位角元件阻值与其检测的牛奶中体细胞数具有较好线性关系的结论,但是据资料显示,目前基于微叉指电极阻抗生物传感器检测金黄色葡萄球菌的研究甚少,所以本文设计了基于纳米氧化锌的微叉指电极阻抗生物传感器来实现金黄色葡萄球菌检测。
本试验首先用COMSOL仿真设计出氧化铟锡(indium tin oxide,ITO)微叉指电极结构,并用电化学方法在叉指电极上沉积纳米ZnO[8-9],随后将链酶亲和素修饰在纳米ZnO上,并将生物素化的金黄色葡萄球菌抗体固定到传感器的表面[10-12],最后进行金黄色葡萄球的检测。试验中,COMSOL仿真的应用,可以优化电极设计结构,为传感器的构建提供一个性能优越的基底,纳米ZnO的修饰,为抗体的固定提供了更多的有效空间,而亲和素与生物素之间的作用,不仅会放大传感器的检测信号,也会提高抗体的有效固定率,最终实现传感器检测能力的提升。
1 材料与方法
1.1 试验药品及设备
金黄色葡萄球菌菌株(ATCC29740):华北理工大学基础医学院;抗金黄色葡萄球菌抗体704(小鼠单克隆抗体,其与金黄色葡萄球菌、蛋白a阴性金黄色葡萄球菌和表皮葡萄球菌特异性反应):abcam中国公司;链霉亲和素(streptavidin,SA):ABExBIO 公司;磷酸缓冲盐溶液(phosphate buffer saline,PBS,pH=7.4):Biosharp赛国生物科技;生物素琥珀酰亚胺脂(NHS-biotin)、戊二醛溶液(glutaraldehyde,GA,50%GA in H2O)、吐温-20(Tween-20)、3-氨丙基三乙氧基硅烷(3-aminopropyltriethoxysilane,APTES):上海梯希爱化成工业发展公司;牛血清蛋白(bovine serum albumin,BSA):Bovogen北京沃卡威生物技术公司;六水合硝酸锌:天津恒兴化学试剂制造公司;磷酸盐吐温缓冲液(100 mL PBS+50 μL Tween-20,自制)。
电化学工作站(Reference 600):美国Gmary公司;生化培养箱(LRH-250):上海慧泰仪器制造公司;恒温摇床(TS-100B):上海合恒仪器设备公司;低温恒温槽(DC0515):上海舜宇恒平科学仪器公司;离心机(C1-20B):上海菲恰尔分析仪器公司;立式压力蒸汽灭菌器(LDZX-30KBS):上海申安医疗机械厂;超纯水机(XYF2-10-H):北京湘顺源科技公司。
1.2 方法
1.2.1 ITO微叉指电极设计
影响微叉指电极性能的因素主要有两部分,一部分是电极构成材料,主要材料有金、银、ITO等,金、银电极性能较好,但是其价格较昂贵,性价比较低,而ITO电极不仅成本低,而且性能也不错,是目前叉指电极研究较热的材料。另一部分影响因素则是电极结构,主要有叉指数、指长、指宽比、指间距以及电极厚度等,这些参数都会给传感器的检测效果带来很大影响,因此,需要设置适宜结构参数的电极来进行试验,但是由于实际操作验证传感器的性能比较困难,所以需要引进仿真技术来验证传感器的性能。
试验选用的仿真技术是COMSOL仿真,仿真的主要内容是设计出适宜的电极叉指数、电极叉指指长、指宽、指间距等,通过仿真,可以得出其电场、阻抗、容抗等的变化关系[13]。根据Pourmir等[14]的仿真实验分析并结合本试验的具体需要进行了仿真,其部分仿真示意图如图1所示。
图1是电极仿真时检测10万cfu/mL金葡细胞时的示意图,其中左图是其二维示意图,而右图为其三维电场分布示意图,细胞随机的分布在溶液中或贴壁分布传感器表面,在接近传感器的表面时电场分布比较均匀,采用抗体抗原绑定技术,将细胞固定在传感器的表面时,会极大的提高检测的灵敏度。当选择ITO电极时,通过仿真得出,叉指指宽为30 μm,指间距为30 μm,指长为10 mm,叉指数为64对时,其电场分布最为均匀,检测的灵敏度最高。

图1 基于COMSOL仿真设计的叉指电极检测金葡时二维(左)、三维(右)示意图Fig.1 Two-dimensional(left)and three-dimensional(right)schematic diagrams of the interdigited electrode based on COMSOL simulation
1.2.2 金黄色葡萄球菌培养
首先分别自制固态琼脂培养基和液态营养肉汤培养基,用接种环将金葡从原菌菌株中转接到固态培养基上(采用平板划线法),将其置于生化培养箱中37℃孵育24 h,取出后再次用接种环将其从孵育完的固态培养基上转接到液态培养基(100 mL)中,置于摇床摇动振荡24 h(37℃、180 r/min),随后继续转接到液态培养基(100 mL)并用摇床摇动振荡2 h来稀释金黄色葡萄球菌,稀释后用液枪取1 mL菌液(4组)并将其离心重悬 3 次(7 000 r/min、3min),然后取 10 μL重悬后的菌液用PBS溶液梯度稀释为101cfu/mL~108cfu/mL的待测样品并置于4℃备用。
1.2.3 传感器的构建原理
检测细菌的阻抗生物传感器构建时主要考虑两个方面,一方面是抗体的有效固定量,这主要取决于传感器的结构及抗体与传感器界面的亲和力;另一方面是传感器的非特异性吸附,基于此构建了本传感器。首先,在ITO叉指电极上修饰纳米ZnO,随后利用APTES对纳米ZnO表面进行改性,这一步主要利用了纳米ZnO表面的-OH与APTES的上的-Si-共价偶联形成-Si-O-键,而且APTES上还存在着可用于功能化修饰的-NH,随后用戊二醛来继续修饰传感器,其可与APTES的-NH形成-C-N=C-键,从而交联在传感器上,而链酶亲和素修饰到传感器上后,其上的-NH可与戊二醛上另一端的醛基共价偶联,从而将其固定到传感器的表面,随后利用生物素和链霉素的强亲和力作用,将金葡抗体固定到传感器的表面上,从而提高了抗体的固定效率。而为了降低传感器的非特异性吸附,本方法向固定好抗体的传感器上加入了BSA。
1.2.4 传感器的构建流程
首先用10%的稀盐酸充分浸泡ITO电极以去除其表面异物、随后将其放入丙酮、无水乙醇中来充分超声清洗,最后用超纯水冲洗来去除清洗过程遗留的无水乙醇等,清洗完毕后利用电化学方法将纳米ZnO沉积到叉指电极上,沉积时,采用三电极沉积体系,其中,沉积溶液为 0.1 mol/L 的 Zn(NO3)2·6(H2O)水溶液,沉积电压为-1.1 V,沉积时间为300 S,温度为70℃,其制备原理如下:
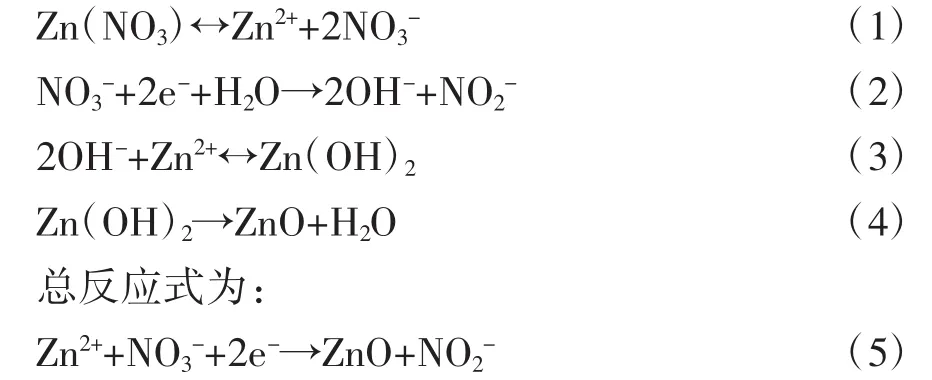
接下来将沉积纳米ZnO的电极工作区在室温下用APTES水溶液(体积比1∶200)浸泡24 h,来实现传感器表面纳米ZnO的硅烷化,随后将其工作区浸入戊二醛水溶液(0.01 mol/mL PBS+0.2 mmoL/mL GA)中,室温阴暗环境浸泡4 h,至此,ZnO表面改性完毕,接下来向其工作区加入100 μL链霉亲和素溶液(0.2 mg SA+0.1 mLPBS),并置于 4℃环境 10 h,完成后用PBST冲洗。
抗体的固定是传感器构建的重要环节,为了将金黄色葡萄球菌抗体更好的固定到传感器表面,需要将抗体用生物素琥珀酰亚胺脂生物素化,首先将抗体溶液(1 mg Ab+1 mLPBS)与生物素琥珀酰亚胺脂溶液(0.1 mg NHS-bition+50 μL PBS)充分混合均匀,随后将其0℃孵育3 h,待孵育完成将其透析,随后进行金黄色葡萄球菌抗体的固定,向传感器工作区滴加100 μL处理过的抗体(Biotin-Ab,B-Ab),4 ℃孵育 10 h,随后用PBST冲洗工作区,最后向传感器的工作区滴加50 mL 1wt%BSA来封闭非特异性位点。传感器的组装流程图如图2所示。

图2 检测金葡的传感器构建流程图Fig.2 Construction flow diagram of sensor for detecting Staphylococcus aureus
1.2.5 金黄色葡萄球菌的检测
将梯度浓度的金葡菌液(100 μL)分别滴加到传感器工作区,37℃孵育60 min,并设置对照组(向工作区滴加100 μL无菌PBS溶液),随后进行检测,首先分别将传感器与电化学工作站连接,向其工作区滴加85 μL PBS溶液作为测试溶液,并设置测试频率参数100 mHz~100 kHz,测试电压参数5 mV等,随后在两电极体系中进行电化学测试,得出的结果用阻抗归一化方法(normalized impedance change,NIC,公式 6)分析,选取某一频率点来分析阻抗幅值与控制值的差异,其测试模型如图3所示。
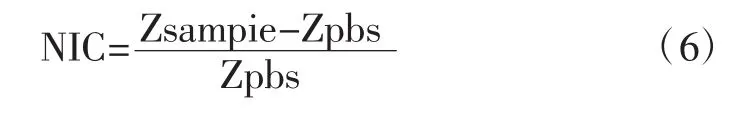
式中:Zsample为测试不同浓度金黄色葡萄球菌时某一频率下产生的总阻抗的模值;Zpbs为同一频率下测试PBS溶液产生的总阻抗模值。
图3 传感器检测金黄色葡萄球菌模型图Fig.3 Model diagram for detecting Staphylococcus aureus by sensor
1.2.6 数据处理
本试验测试结果分析采用归一化方法、probit概率分析方法,作图软件为Origin软件、Excel软件及Visio软件。
2 结果分析与讨论
2.1 传感器的表征
为了更好的分析及验证传感器的组装情况,需要对传感器的组装过程表征,首先用场发射扫描电镜表征分析了叉指电极表面纳米ZnO的修饰情况,随后依次对修饰的各个阶段进行了循环伏安测试。传感器修饰后的电镜图及循环伏安曲线图见图4。


图4 传感器修饰后的电镜图及循环伏安曲线图Fig.4 Electron micrograph and cyclic voltammetry curve after sensor modification
由图4b发现,沉积纳米ZnO的ITO电极的电流氧化还原峰远远低于未处理的ITO的氧化还原峰,而结合电镜图,很容易分析出其峰值变化的原因在于传感器修饰后形成了更为致密的纳米片状结构,电荷在其表面转移难度会大幅度增加,因而修饰后的氧化还原峰大幅下降。
随后,又对修饰的各个阶段进行了电化学阻抗测试,由其曲线图见图5。
由图5发现,随着逐层的修饰,传感器的总阻抗不断增大,结合图7等效电路分析,总阻抗模值变大的原因可能是当不同材料修饰到传感器的表面,其在电极上可能起着分隔层或绝缘层的作用,从而阻碍了传感器表面电子的传递,而且随着逐层的修饰,其阻碍作用会越来越明显,而图4b的循环伏安曲线变化趋势也印证了这一点。

图5 传感器组装电化学阻抗谱测试曲线(Bode图)Fig.5 Bode diagram of sensors assembly
以上电化学表征方法可以说明传感器的修饰过程中的阻抗变化趋势,但是对于其修饰物的成分却无法证明,为此需要通过激光拉曼光谱和红外吸收光谱对其表面材料的修饰进行表征,图6为其光谱图。
在图6a拉曼光谱中,其在325、428、580 cm-1有3个特征峰,结合图4电镜图以及孙倩等[15]的试验,可以确认其是纳米ZnO。


图6 传感器修饰后的拉曼光谱图及红外光谱图Fig.6 Raman spectrum and infrared spectrum after sensor modification
在图6b傅里叶变换红外光谱中,ZnO光谱中在501 cm-1、3 300 cm-1有明显特征峰,结合相关试验[16]分析,501 cm-1处为Zn-O吸收峰,而3 300 cm-1处应为-OH吸收峰,当修饰上APTES/GA后,由1 105 cm-1处(Si-O-Si),1 678 cm-1处(-NH-),2 959 cm-1处(-C-NH2-),1 708 cm-1处(C=O)的特征峰表明在纳米ZnO表面已经修饰APTES和GA。
结合CV、FESEM、EIS技术、激光拉曼光谱、红外吸收光谱等多种表征方法,表明传感器表面已修饰各种材料,传感器构建完成。
2.2 传感器等效电路分析
传感器检测金黄色葡萄球菌时发生的阻抗变化,可以用模拟等效电路来分析,传感器的等效电路是根据Nguyen等实验[17]的等效电路分析改进而来,其电路图如图7所示。

图7 金葡检测电路拟合图Fig.7 Circuit fitting diagram for detection of Staphylococcus aureus
电路图主要由双电层电容和溶液阻抗以及法拉第阻抗三部分构成,其中Rw为测试体系中产生的电荷转移电阻和Warburg电阻,Cw是测试体系中产生的Warburg电容,Cdl是传感器表面产生的双电层电容,其拟合时需要用性能更好的常相位角元件替代,Cs为测试体系中产生的介质电容,而Rs为测试体系中产生的溶液电阻,根据Kim等[18]的试验了解到Rs、Rw、Cw代表电解质溶液的本体性质以及其扩散特性,它们不受电极表面发生的物理化学转变的影响。所以本试验进行拟合时重点围绕双电层电容以及介质电容与总阻抗之间产生的影响来分析。
2.3 金黄色葡萄球菌的检测分析
在金黄色葡萄球菌检测时,根据试验经验,将测试频率选在100 mHz~100 KHz的范围内,测试时分别检测0~108cfu/mL的金黄色葡萄球菌得出其Bode图,见图8。

图8 传感器检测无菌PBS、102cfu/mL~107cfu/mL金黄色葡萄球菌Bode图Fig.8 BODE diagram of PBS and Staphylococcus aureus in different concentrations by sensors
图8中曲线分别为测试无菌PBS溶液以及102cfu/mL~107cfu/mL的金黄色葡萄球菌的阻抗曲线,其中,10 cfu/mL阻抗曲线与无菌PBS阻抗曲线基本一致,108cfu/mL阻抗曲线与107cfu/mL阻抗曲线基本一致,其无法区分,故不再体现。从图8中明显可以看出在高频阶段,各浓度测试的阻抗曲线图基本趋于一致,而在低频阶段,则有明显的差异,检测的金黄色葡萄球菌浓度越大,其总阻抗的模值越大,结合Joung等[19-20]的试验进行分析。
当传感器检测细菌时,在低频阶段,电荷在液相导体和金属导体中的移动速度不同,液体中离子移动的速度要远远小于金属中电子的转移速度,因而其在电极表面形成了电荷堆积,从而形成了双电层电容Cdl,Cdl计算公式为公式7,同一频率下,随着检测的细菌浓度增大,细菌细胞对传感器表面的阻碍会越来越强,因而A会越来越小,而其它量基本不变,因此,随着细菌浓度的增大,溶液与传感器表面产生的双电层电容会越来越小,总阻抗的模值也就越来越大。

式中:ε和ε0分别为电解质与真空的介电常数;d为双电层厚度;A为溶液与电极的接触面积。
当在高频阶段时,通过细菌细胞间的电流会越来越大,电荷转移受到细胞间的相对阻碍也就越来越小,其通过细胞也会越来越容易,因而双电层电容对传感器的影响也就越来越小,此时,传感器产生的阻抗变化则应是体系内的介质电容主导的,而介质电容并不会随待测菌的浓度增大而发生很大变化,因而随着细菌浓度的增大,传感器的总阻抗并不会明显增大,反而会随着频率的增大而趋于一致。所以本传感器在低频时,双电层电容占据了主导趋势,而高频时,介质电容占据了主导趋势。
为了更好地分析传感器检测不同浓度时其总阻抗模值与频率的关系,截取了图8中的100 Hz~1 kHz频率区间部分得出图9,并引用数学方法来协助分析。

图9 100 Hz-1 kHz Bode图Fig.9 Bode diagram from 100 Hz to 1 kHz
从图9上发现,当频率为100 Hz时其各浓度间的阻抗曲线可以明显区分,利用公式6计算出该频率下各浓度的NIC数值,并分别计算4组平行试验平均值,将其数据拟合成相关曲线(图10),其中,R2为0.973 8,拟合线性方程为 y=0.055x+0.016 6(n=4,y为不同浓度NIC值,x为浓度对数),可见,传感器检测不同浓度金黄色葡萄球菌时产生的总阻抗模值归一化数值与其浓度对数呈较好的线性关系。

图10 传感器检测不同浓度金葡的NIC线性拟合图(n=4)Fig.10 NIC linear fitting diagram of sensors for detecting the concentration of Staphylococcus aureus in different concentration(n=4)
检出限是评价传感器的一个重要指标,本传感器检测时,发现传感器检测10 cfu/mL时其阻抗曲线与无菌PBS阻抗曲线基本一致,而当浓度为100 cfu/mL时,其在Bode图上曲线与无菌PBS曲线可以明显区分,因而可以确定传感器的检出限应该在0~100 cfu/mL之间,但是其具体值无法通过Bode图来体现,所以需要引入概率知识来分析其检出限,首先将50 cfu/mL~100 cfu/mL浓度等分为5个区间,分别在每个浓度区间测试2次,来检测其中有无金黄色葡萄球菌,结果发现,每次都检测到了金黄色葡萄球菌,显而易见,传感器的检出限并未在此区间,于是再将0~50 cfu/mL等分为5个区间,其具体检测情况如表1所示。

表1 基于probit方法对传感器检出限的概率分析Table 1 Probability analysis of LOD based on probit method
在表1中,将得出的数据用spss23中的probit概率分析处理得出,在95%置信区间内,可以检测到的金葡最低浓度为42.678 cfu/mL的概率为95%,因而通过试验并结合数学方法大致可以推算出传感器的检出限为43 cfu/mL。
2.4 特异性验证
进行传感器的特异性试验分析时,首先用同批制备的传感器分别检测102、104、106cfu/mL的金黄色葡萄球菌、E.coli O157:H7、沙门氏杆菌以及布鲁氏菌,并分别测试无菌PBS(设置3组平行试验),最后分别选取其在100 Hz时阻抗值,用公式6处理,将每次测试的NIC值进行统计(表2)。
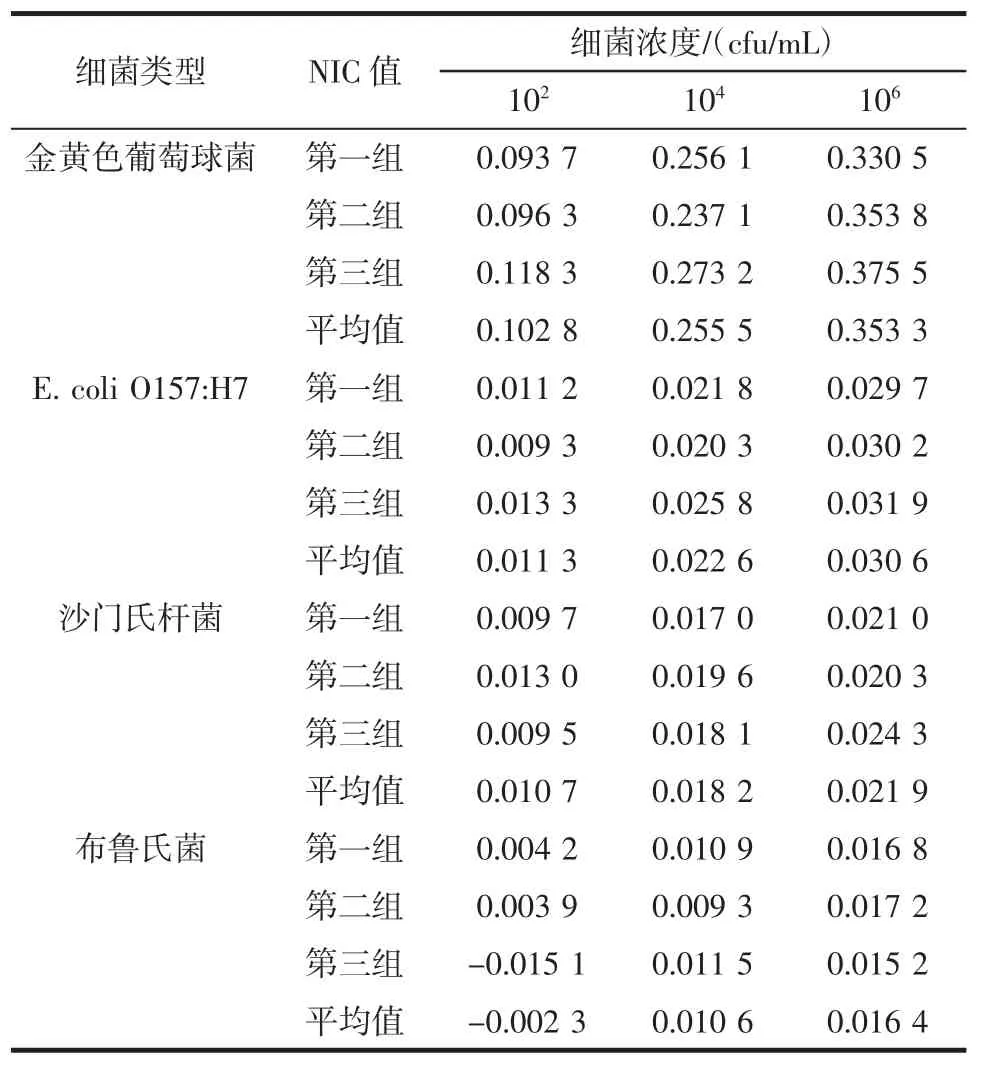
表2 传感器的特异性验证统计表(n=3)Table 2 Statistical table of sensor specificity test(n=3)
从表2中清晰看出,当检测金黄色葡萄球菌时,传感器的NIC明显增大,而检测其它菌时,其NIC变化相对于金黄色葡萄球菌的变化很小,说明传感器的特异性较强。
2.5 稳定性测试
传感器构建完成后,其稳定性也是必须考虑的因素,为了验证传感器的稳定性,将制备好的3组传感器进行阻抗测试(测试无菌PBS),分别取频率100 Hz时阻抗模值,测试完毕后将其放入冰箱保存(工作区用PBS浸泡),在7、14 d后再次对无菌PBS进行阻抗测试,其在100 Hz时阻抗模值分别为R2、R3。表3是不同传感器在7 d~14 d后阻抗变化情况(变化率公式为公式8)。

表3 传感器稳定性测试Table 3 Stability test of sensors

式中:Rc为阻抗变化率;R为7 d~14 d后测试阻抗模值。
由表3发现,其变化率在7 d时为10%以下,14 d时变化率在12%左右,可见,传感器的稳定性较好。
2.6 实际样品检测
本试验中,传感器检测金黄色葡萄球菌针对的都是纯菌,但是生活中的细菌检测不可能是纯菌检测,为了能够更好的研究传感器在实际样品中的检测能力,分别将105cfu/mL的金黄色葡萄球菌加入到1 mL未开封的纯牛奶、橙汁以及早餐奶中,然后分别用本传感器来检测。传感器实际样品检测见表4。

表4 传感器实际样品检测Table 4 Actual sample detection of sensors
由表4中检测数据得出传感器的样品回收率大概在91%~112%,传感器基本上具备了实际检测的能力。
3 结论
本试验设计了一种基于纳米材料修饰叉指电极的快速检测食品中金黄色葡萄球菌的阻抗生物传感器,其利用COMSOL仿真设计了适宜的叉指电极结构参数,利用纳米ZnO修饰叉指电极来增大了传感器的抗体固定空间,利用生物素与亲和素的作用来提高抗体固定效率,利用激光拉曼光谱、FESEM、循环伏安法、红外吸收光谱等对传感器的形貌与构建进行了表征,利用电化学方法对滴加不同浓度金葡的传感器进行了阻抗测试,检测结果用阻抗归一化方法分析,得出传感器检测金黄色葡萄球菌的总阻抗模值归一化数值与其浓度对数(102cfu/mL~107cfu/mL)呈线性关系的结论,同时,结合probit概率分析得出其检出限为43 cfu/mL,相比其它方法,本传感器的检出限与检测范围都得到了提升,此外通过试验也证明了其特异性较强,稳定性好,而且检测时间快,制造成本低,具备了实际样品检测能力。
