耐碳青霉烯类鲍曼不动杆菌医院感染暴发调查及危险因素分析
2020-05-22王永红周中丽黄中秀黄俊文丰马华兰
王永红,周中丽,黄中秀,黄俊,文丰,马华兰
随着大量广谱抗菌药物的不合理使用,鲍曼不动杆菌(Aci net obact er baumanni i)耐药率呈快速升高趋势,特别是碳青霉烯类耐药鲍曼不动杆菌(CRAB)导致的感染给患者治疗带来了极大困难[1]。而ICU作为危重症患者的收治科室,由鲍曼不动杆菌引起的医院感染较严重,常出现CRAB的克隆传播[2]。以下是针对重庆市黔江中心医院ICU 2017年12月24日-2018年2月12日发生的CRAB感染暴发事件进行的流行病学调查及危险因素分析。
1 材料与方法
1.1 调查及研究对象
20 1 7年1 2月24日-20 18年2月1 2日,本院ICU连续报告了8例CRAB引起的医院获得性肺炎(HAP),诊断标准依据卫生部2001年颁布的《医院感染诊断标准(试行)》[3]。具体纳入标准:①无明确潜伏期,规定入院4 8 h后发生的感染;②患者有发热、咳嗽,肺部听诊有湿啰音;③X线显示肺部有炎性浸润性病变;④血常规检查白细胞总数和/或嗜中性粒细胞比例增高。病原学检查痰液定量培养分离病原菌数需 ≥106CFU/ mL,人工气道吸引采集的下呼吸道标本病原菌数需≥105CFU/mL,且连续两次分离到相同病原体,或者血培养分离到病原体。
8例HAP患者从吸引痰中均分离到CRAB,因此以这期间该ICU所有住院患者及痰液和环境生物学监测标本中分离到的CRAB菌株为研究对象开展调查。
1.2 流行病学调查
1.2.1 确定感染暴发存在核实已报告的CRAB医院感染病例临床诊断及实验室诊断,排除非感染或实验室诊断错误导致的假暴发报告。调查该时间段CRAB医院感染罹患率:CRAB医院感染罹患率(%)=(该时间段CRAB医院感染新病例数/同期ICU患者数)×100%[4],并将罹患率与上年同期进行比较。
1.2.2 现场调查收集患者人口统计学特征及相关临床资料,包括性别、年龄、床位、入出院时间、诊断、微生物培养结果、药物敏感试验结果、抗菌药物使用情况、侵袭性操作、基础疾病等。同时对ICU的监护仪表面、输液泵按钮、治疗车、床头柜、床架、呼吸机表面、电脑键盘和鼠标及医务人员手和鼻腔进行规范采样,标准参照2012年发布《医疗机构消毒技术规范》。将采样棉拭子放入装有10 mL无菌检验用洗脱液的试管中送检。取洗脱液1 mL接种培养基平皿,置于37 ℃孵箱,培养48 h后计数菌落数,并对目标菌落进行菌种鉴定。
1.2.3 同源性分析对患者分离到的CRAB菌株及环境采集标本分离到的CRAB菌株进行同源性分 析。
1.2.4 暴发危险因素推测根据现场调查收集资料为依据,采用病例对照研究。将8例CRAB引起的HAP患者作为病例组(CRAB组),42例同时期入住综合ICU>48 h并排除有医院感染的患者作为对照组(非CRAB组)进行危险因素单因素分析。8例病例组与40例对照组(从42例对照组患者中以进入ICU时间为条件筛选40例与病例组配对)进行1∶5配对logistic回归分析。
1.3 实验室检测
1.3.1 细菌鉴定及药敏试验气管插管机械通气患者,痰标本采集由医护人员经管道吸出痰液,置于带螺纹盖的无菌容器中送检。同时,病原菌的培养、分离、鉴定及药敏均参照《全国临床检验操作规程》标准执行[5]。鉴定及药敏分析仪为法国生物梅里埃VITEK 2-Compact,药敏折点参照CLSI 2018年标准进行。质控菌株为铜绿假单胞菌ATCC 27853。CRAB组痰培养分离到CRAB 8株,剔除同一患者的重复菌株。环境生物学监测标本中分离到CRAB 5株。
1.3.2 碳青霉烯酶耐药基因检测菌落采用37 ℃过夜培养18~24 h纯菌落,DNA提取按照DNA抽提试剂盒说明书进行。引物参照文献[6],引物序列见表1。PCR反应体系(40 µL):premix Ta q酶2 0µL,上下游引物各0.8µL(浓度为10 µmol/ L),DNA模板4 µL,超纯水14.4 µL。扩增条件:94℃预变性5 min,94℃变性30 s、退火30 s(退火温度见表1)、72℃延伸30 s共35个循环,最后72 ℃延伸10 min。扩增完毕,PCR反应产物进行琼脂糖凝胶电泳检测,选取阳性产物送测序。测序结果在NCBI上进行BLAST比对。
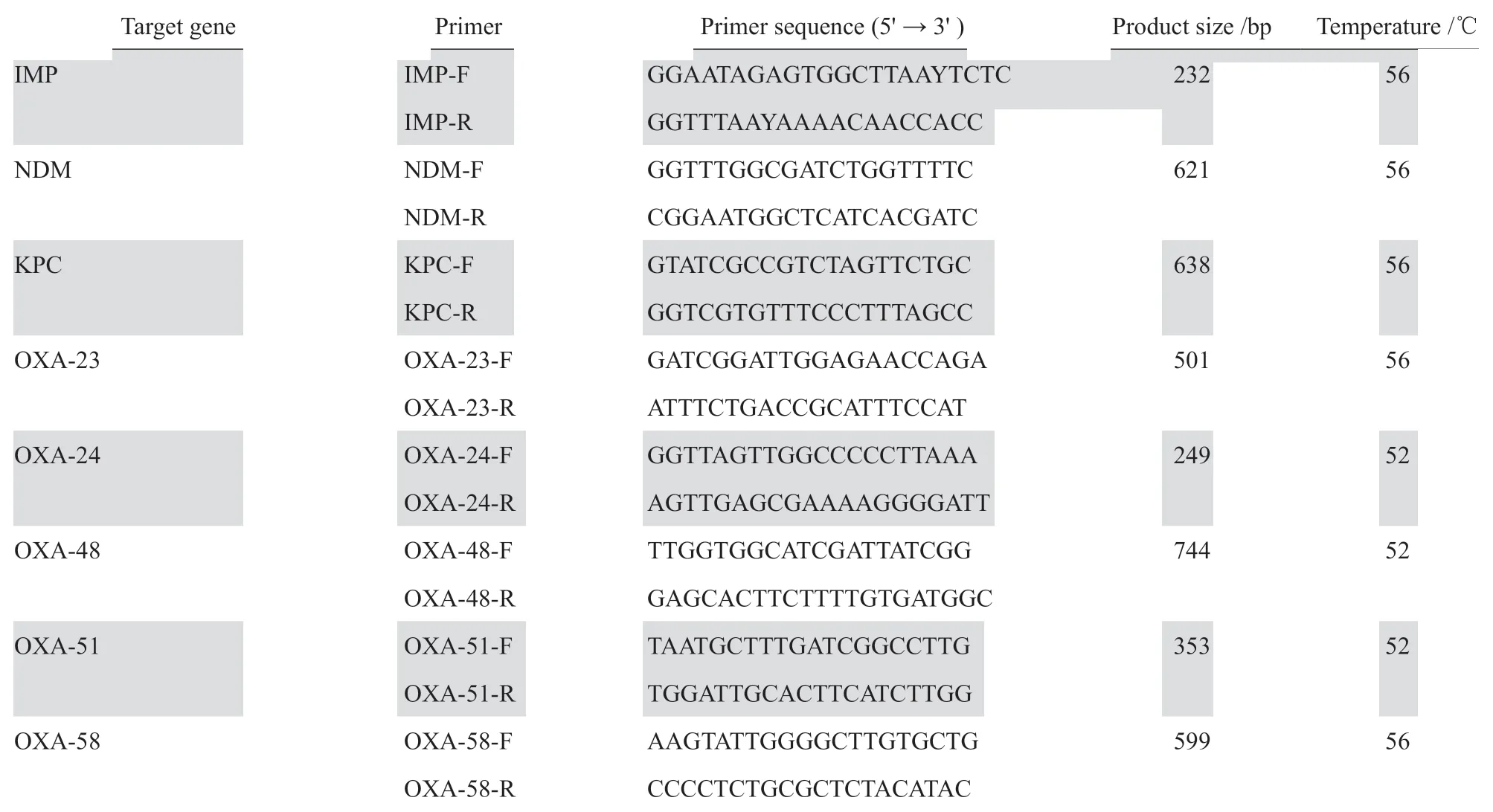
表1鲍曼不动杆菌碳青霉烯酶基因引物序列Table 1 Primers and their sequence for amplifying carbapenemase genes in Acinetobacter baumannii strains
1.3.3 脉冲场凝胶电泳(PFGE)参照文献制备DNA胶块、细胞壁裂解、洗胶、胶块DNA酶切、加样、电泳等[7]。电泳条件为:温度14 ℃,电泳时间22 h,电泳方向角度变化120°,电压6 V/cm,线性梯度变化5~20 s。应用BioNumerics软件对图像进行聚类分析,条带完全相同判定为同一克隆株,条带差异1~3条判定为亚克隆株。
1.4 统计学方法
采用SPSS 20.0软件进行分析,用χ2检验分析二分类变量资料;计量资料以±s表示,采用t检验分析;危险因素多因素分析采用1∶5配对logistics回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 基本情况
2017年12月24日-2018年2月12日ICU共发生8例CRAB所致医院获得性下呼吸道感染,结合临床表现、影像学检查及实验室检查确定该8例患者为感染而非定植或污染。在该时间段内,CRAB医院感染新病例数为8例,同时期ICU患者总数为89例,CRAB医院感染罹患率为9.0%(8/89),较上年同期CRAB医院感染罹患率1.2%(1/82)明显升高。根据绘制的CRAB感染病例时间轴图(见图 1),确定2017年12月26日分离到CRAB的患者P1为初始病例,2018年2月12日分离到CRAB的患者P8为末尾病例。8例患者基本情况见表2。
2.2 环境微生物学调查
综合I CU共采集4 6份环境表面及医务人员手和鼻拭子标本,其中3 2份标本总菌落数超过国家标准(>5 CFU/cm2),不合格率为69.6%(32/46),6份医务人员手的标本菌落数超标,均不合格。同时,CRAB检出率为10.9%(5/46),其中监护仪CRAB检出率为2/8,医务人员手为1/6,输液泵按钮为1/6,治疗车为1/8,其他床头柜按钮、床架、电脑键盘鼠标、呼吸机表面、医务人员鼻拭子均未检出CRAB。
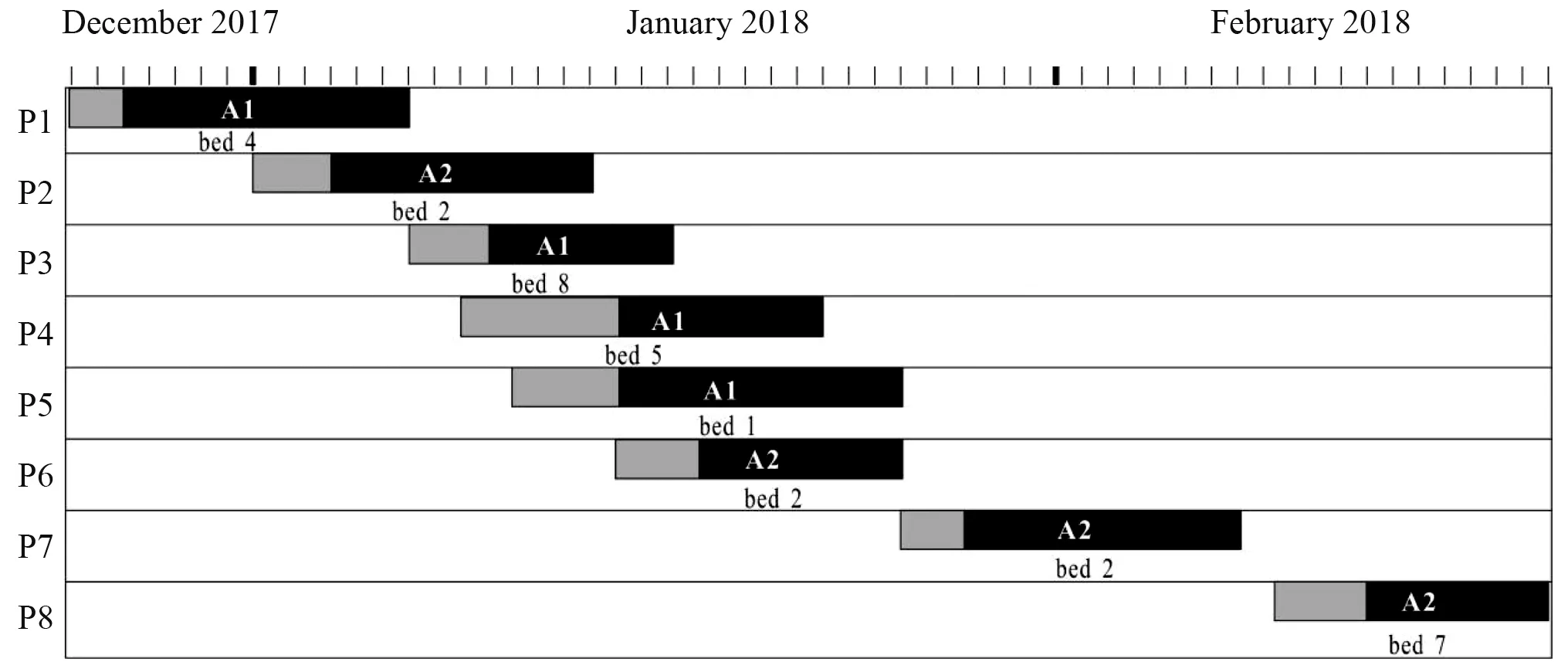
图1 8例CRAB感染病例时间轴和床位分布情况Figure 1 Timeline and bed occupancy of all the eight patients with carbapenem-resistant Acinetobacter baumannii infection
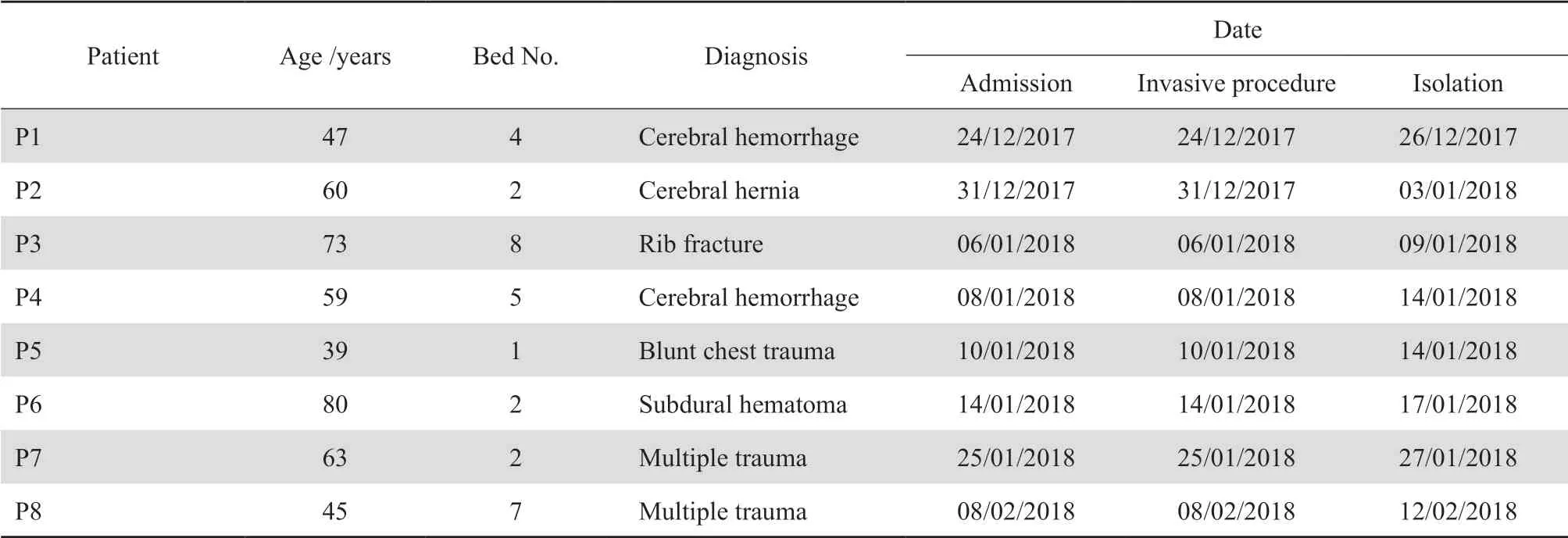
表2 8例CRAB下呼吸道感染患者基本情况Table 2 Basic condition of 8 patients with lower respiratory tract infection caused by carbapenem-resistant Acinetobacter baumannii
2.3 病原学鉴定及药敏
从患者分离到的8株CRAB中,第1、3、4、5菌株药敏结果相同,第2、6、7、8菌株药敏结果相同。药敏结果提示8株CRAB耐药表型相似,疑似暴发。患者痰标本分离的CRAB药敏结果见表 3。
2.4 病例空间分布
综合ICU共15张病床,大厅8张,大间4张,3张小间隔离床位。所有感染患者均位于大厅床 位。
2.5 耐药基因检测及同源性分析
对从环境中分离到的5株鲍曼不动杆菌和患者分离到的8株鲍曼不动杆菌进行耐药基因检测和PFGE同源性分析。所有菌株均携带OXA-23、OXA-51基因,未检测到KPC、IMP、NDM及其他OXA基因。PFGE结果提示患者和环境分离菌株为同一克隆,共有2个亚群A1和A2。结果见图2、图 3。
2.6 危险因素分析结果
采用病例对照研究,将CRAB组和非CRAB组按基本信息、抗菌药物使用相关因素、侵袭性操作相关因素、ICU相关因素及基础疾病分类进行比较分析。危险因素的单因素分析结果显示检出细菌前使用抗菌药物时间、机械通气、气管插管/切开、留置引流管、入住ICU天数、手术、混合感染为CRAB医院感染暴发的危险因素,P<0.05。见表 4。
将单因素分析中有统计学意义(P<0.05)的因素进行1∶5配对logistic回归分析,结果未发现独立危险因素,见表5。
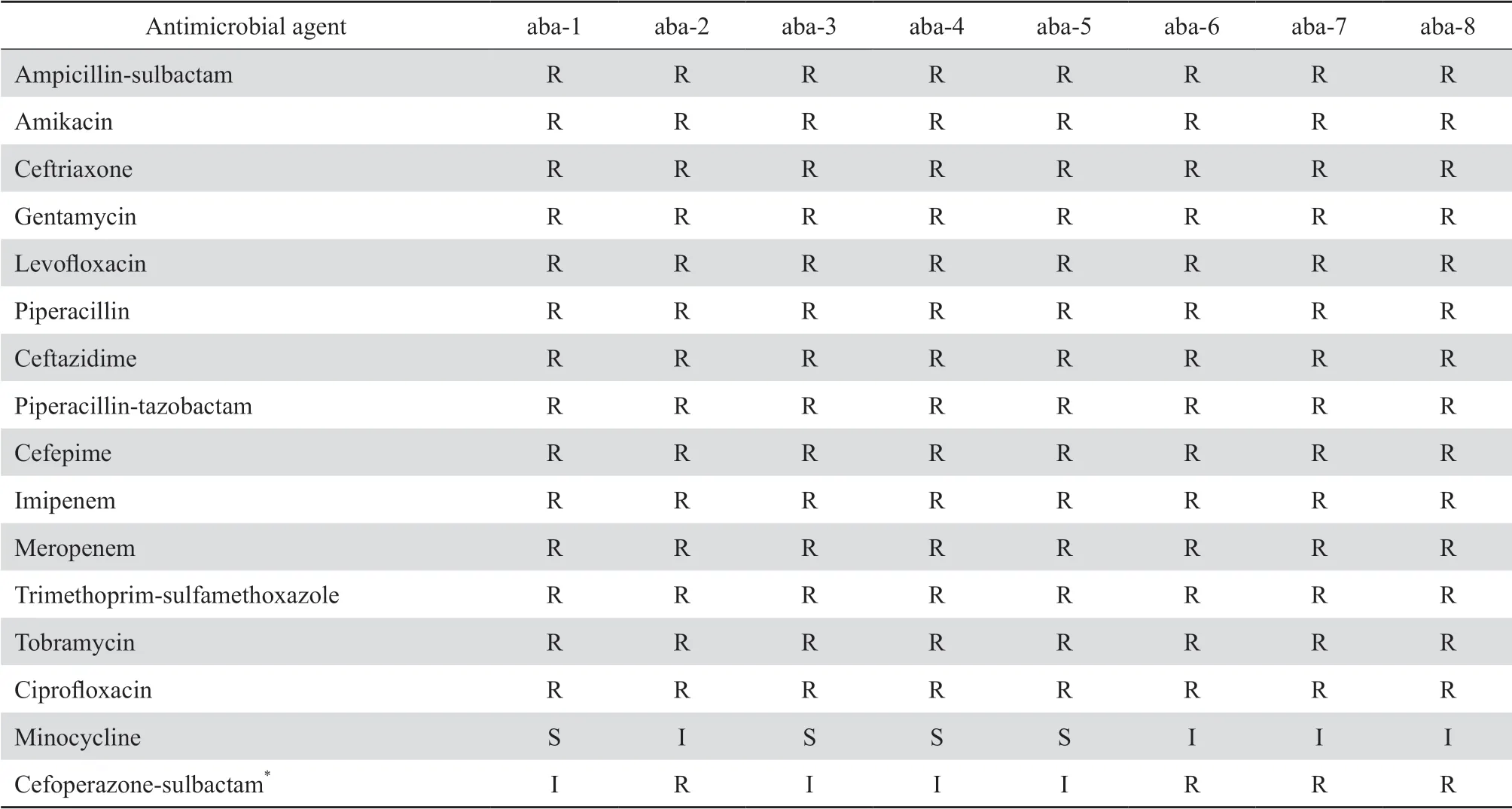
表3 8株耐碳青霉烯类鲍曼不动杆菌药敏结果Table 3 Antimicrobial susceptibility patterns for 8 carbapenem-resistant Acinetobacter baumannii strains
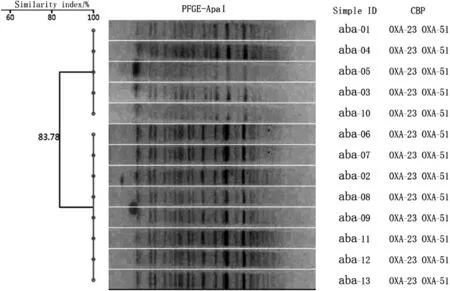
图3 5株环境调查分离菌株和8株患者分离菌株PFGE及耐药基因分析Figure 3 Pulsed-field gel electrophoresis and resistance gene analysis of the Acinetobacter baumannii isolated from ICU patients(n=8) and environment (n=5)
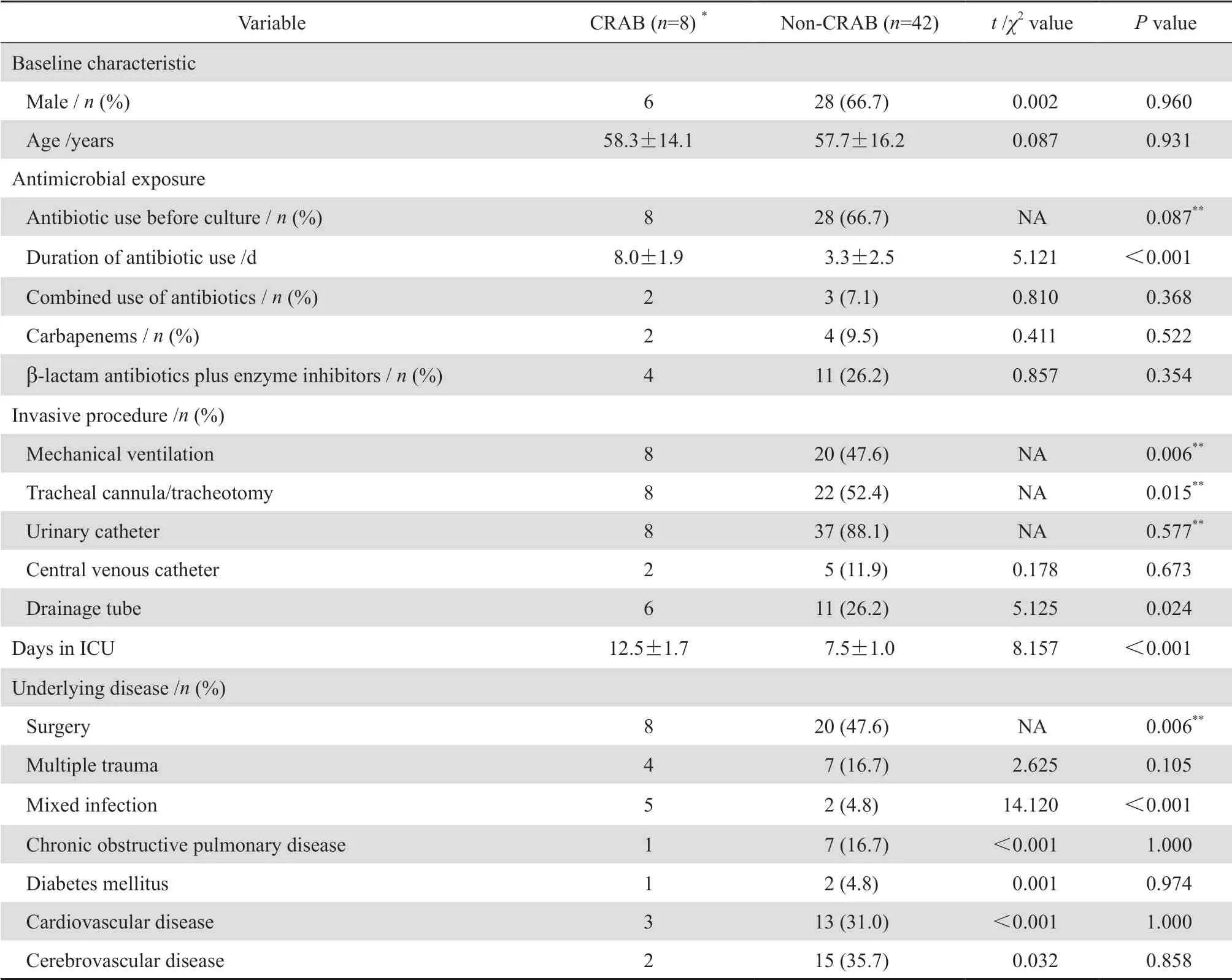
表4 CRAB医院感染危险因素的单因素分析Table 4 Univariate analysis of risk factors for healthcare-associated infections caused by carbapenem-resistant Acinetobacter baumannii
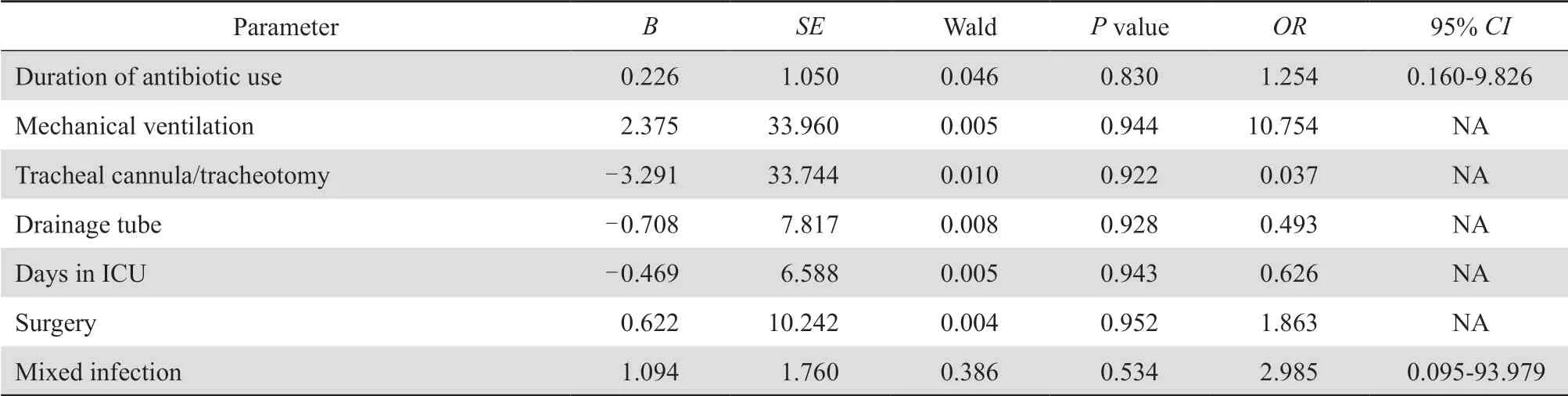
表5 CRAB医院感染危险因素的1∶5配对logistic回归分析Table 5 Matched (1∶5) logistic analysis of risk factors for healthcare-associated infections caused by carbapenem-resistant Acinetobacter baumannii
3 讨论
2017年全国细菌耐药监测网数据显示,鲍曼不动杆菌对碳青霉烯类耐药率为56.1%。随着CRAB分离率的增高,由CRAB引起的医院感染暴发也严重威胁着人们的健康[8]。鲍曼不动杆菌引起的医院感染主要包括呼吸机相关性肺炎、血流感染、尿路感染等,特别是入住ICU的患者均有较高的感染风险[9]。鲍曼不动杆菌对碳青霉烯类抗生素耐药的主要机制包括:产β内酰胺酶(主要为B类和D类)、药物作用靶位的改变、外膜通透性改变及外排泵的过度表达[10]。其中,产酶机制是引起鲍曼不动杆菌耐药的主要因素,又以OXA基因的表达流行为主。本研究中,所有菌株均含有OXA-23和OXA-51基因,此两种亚型是D类β内酰胺酶中流行最广泛的基因。这也是本研究中分离的鲍曼不动杆菌呈高水平耐药的原因。
在本次感染暴发调查中,该ICU在较短时间(6周)内连续发生8例医院获得性CRAB下呼吸道感染,且均为入住综合ICU 48 h后发生的感染,CRAB感染罹患率较本底显著增高。此次CRAB下呼吸道感染流行病学特征是时间短、范围小,临床症状、影像学检查及病原菌耐药谱相似,排除定植和污染可能。同时通过PFGE分子流行病学方法证实下呼吸道感染分离CRAB菌株与环境分离CRAB菌株为同一克隆,调查结果证明该事件为一起CRAB引起的综合ICU医院感染暴发。
本研究中,单因素危险因素分析提示检出细菌前使用抗菌药物时间、机械通气、气管插管/切开、留置引流管、入住ICU时间、手术、混合感染可能为CRAB医院感染暴发的危险因素,但多因素条件logistic回归分析未发现独立危险因素。初诊患者P1因脑左侧基底节区出血于2017年12月24日手术后入住ICU,气管插管后呼吸机辅助通气,术后患者出现高热,于48 h后首次痰培养CRAB阳性,推测该患者入院前上呼吸道定植有CRAB菌株,经侵袭性操作后引起肺部感染,而成为本次感染暴发的首发病例。8例CRAB医院感染患者均伴有较严重的基础疾病导致免疫功能低下,如:多发伤、硬膜下血肿、胸部钝性伤和脑出血等,均处于昏迷状态,行气管切开、机械通气及引流管留置等操作,且执行上述操作的护理人员和医师均相对固定。环境微生物调查结果显示上述医务人员手标本菌落数均超标,同时分离到1株相同克隆CRAB。除此以外,在监护仪、输液泵和治疗车上采样标本中同样分离到相同克隆CRAB菌株。由此推断,患者P1为感染源,传播途径主要为医务人员未按要求严格执行手卫生,随着呼吸机使用、引流管使用、气管插管和气管切开等侵袭性操作的进行,导致了CRAB对环境的污染而在不同患者之间的水平传播。虽然本研究根据危险因素分析结果对首发病例的出现及其他病例CRAB医院感染的发生做了推测,但由于病例组例数较少,可能导致危险因素分析出现偏倚[11]。在此次暴发后期,通过加强医务人员手卫生依从性、彻底消毒、隔离和积极治疗,CRAB在ICU内传播得到有效控制,继续监测2个月再无新发病例发生。因此,严格进行环境物表消毒和医务人员手卫生,通过合理使用抗生素,积极隔离医院感染患者,可有效防控CRAB医院感染暴发及蔓延。
