植物糖原-槲皮素复合物的制备及特征
2020-04-25韦倩倩樊金玲朱文学白喜婷任国艳
韦倩倩,樊金玲*,朱文学,白喜婷,任国艳
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
槲皮素(quercetin,Qu)是一种天然存在的多羟基黄酮醇(3,3’,4’,5,7-五羟基黄酮),是黄酮中最强的抗氧化剂之一,广泛存在于人类的日常饮食中,在莴苣、洋葱、葡萄酒、浆果和茶中含量尤为丰富[1-2],具有抗氧化、抗炎、抗病毒、抗肿瘤、抗糖尿病、保护心血管等多种生理活性[3-5]。但是Qu在水中的溶解度低(2.84~8.28 μg/mL)[6-8];低溶解度一方面是槲皮素在体内的吸收效率差、生物利用率低的重要原因[9];另一方面也极大程度限制了其在水溶性基质的食品和药品等相关领域的应用。因此,提高Qu的水溶性是保证其生物学效应、开发其潜在应用价值的重要途径。
目前提高Qu溶解度的材料和体系主要有:基于脂质体的微乳液、纳米乳剂、固体脂质体纳米颗粒[10]、纳米结构脂质载体[11]、自乳化体系[12];基于人工合成或天然聚合物的胶束[13]、纳米颗粒;形成分子复合物,如环糊精包合物[14-15]、磷脂复合物[16]。但是上述方法多数不适用于食品,例如:脂质体制备需要大量的表面活性剂;大多数天然高分子聚合物通常需要修饰,而合成聚合物的生物相容性低等;此外,还存在体系稳定性差、制备过程复杂及成本过高等问题。
植物糖原(phytoglycogen,PG)是由α-1,4和α-1,6糖苷键连接的可溶性α-D-葡聚糖[17],广泛存在于植物的su1突变体胚乳中。PG是支链淀粉的结构类似物,但与后者相比,PG的平均链长更短、分支度更高;具有外紧内松的球形树枝状分支模式,易溶于冷水[18-20]。王攀等[21]以PG为载体负载姜黄素(curcumin,CCM)制备了PG-CCM复合物,成功提高了CCM在水体系中的溶解度。Chen Hua等[8]以PG负载叶黄素和Qu,显著提高了叶黄素和Qu的溶解度;但其方法存在乙醇用量大(占总体系体积的25%)、负载效率低(仅4.53%)、超声效果不易控制等缺陷,制备体系的乙醇浓度高,不仅增加了制备成本,而且得到的 PG-Qu复合物溶液不能直接应用于食品体系;同时,高浓度乙醇也增加了对后续操作中干燥设备的影响和要求;负载效率低则意味着Qu用量大,制备成本高。本研究采用低浓度乙醇体系(体积分数1%),并省去超声处理,制备PG-Qu复合物。本方法具有制备简单、不添加任何表面活性剂、体系安全无毒等优点。
本实验着重研究了PG、Qu、体系pH值和盐对Qu表观溶解度、负载能力、负载效率的影响规律;在此基础上,进一步研究了PG-Qu复合物的抗氧化活性和癌细胞抑制能力;并采用动态激光光散射法、透射电子显微镜(transmission electron microscope,TEM)、傅里叶红外变换光谱(Fourier transform infrared spectrometer,FTIR)仪、X射线衍射(X-ray diffraction,XRD)仪对PG-Qu复合物的粒径、形貌、分子相互作用等结构表征进行了分析。
1 材料与方法
1.1 材料与试剂
MCF-7细胞 ATCC细胞库;A549细胞 国家实验细胞资源共享服务平台(北京总部);玉米种子(加强甜型,‘中甜8号’) 北京金农科种子科技有限公司;槲皮素(纯度≥95%,色谱纯) 美国Sigma公司;乙醇(国产分析纯) 天津市德恩化学试剂有限公司;磷钨酸 天津市科密欧化学试剂有限公司;碳支持膜(400 目) 中镜科仪(北京)膜科技有限公司;DMEM高糖培养基 美国HyClone公司;胎牛血清江苏恩莫阿赛生物技术有限公司;0.25%胰酶(含0.02%EDTA) 美国Biosharp公司;其他试剂均为国产分析纯,购自天津市德恩化学试剂有限公司。
1.2 仪器与设备
L5S紫外-可见分光光度计 上海仪电分析仪器有限公司;H2050R高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;SCIENTZ-10N真空冷冻干燥机 宁波新芝生物科技股份有限公司;Nano-ZS90动态散射激光粒度仪 英国马尔文仪器有限公司;TENSPOR27 FTIR仪、D8ADVANCE XRD仪 德国Bruker仪器公司;JEM-2100 TEM 日本电子公司;E191IR恒温培养箱 美国西蒙公司;CKX41SF倒置电子显微镜日本OLYMPUS公司;SW-CJ-2FD双人单面净化工作台苏州净化设备有限公司。
1.3 方法
1.3.1 PG的提取
PG的提取参照王攀等[21]的方法。将su1突变体‘中甜8号’玉米种子粉碎后,加4 倍体积去离子水,4 ℃冰箱中静置浸提4 h,过滤,收集滤液,滤渣重复浸提2 次,合并滤液并调节pH值至4.8;于4 ℃冰箱中静置2 h,离心(5 000×g、30 min)收集上清液,静置24 h,二次离心(5 000×g、30 min)后收集上清液,并调节其pH值至7;高压灭菌锅中高温(121 ℃、20 min)处理后再次离心(10 000×g、20 min)。取上清液,加3 倍体积的无水乙醇沉淀PG,布氏漏斗抽滤,至滤液无色,收集漏斗中的PG置于通风橱中挥干,以除去残余的乙醇,得到PG固体粉末。PG平均得率为10.4%。分别采用二硝基水杨酸法[22]和考马斯亮蓝法[23]测得PG中还原糖质量分数为0.88%,蛋白质量分数为0.12%。
1.3.2 PG负载Qu的方法
取4.95 mL不同质量浓度的PG水溶液(或盐溶液),加入0.05 mL不同质量浓度的Qu乙醇溶液,在气浴恒温振荡器(200 r/min、25 ℃)中振荡平衡30 min,离心(10 000×g、30 min),弃去不溶的Qu沉淀,上清液即为PG-Qu的负载液。将PG-Qu负载溶液进行真空冷冻至粉状,置于干燥器中,4 ℃冰箱中保存,备用。
1.3.3 影响PG负载Qu的因素探讨
分别按要求配制溶液,按照1.3.2节中所述方法负载Qu,研究PG质量浓度、Qu质量浓度、PG溶液的pH值和盐离子对负载的影响,按表1进行操作。

表1 影响PG负载Qu的因素试验设计Table 1 Experimental design of factors affecting Qu loading onto PG
1.3.4 表观溶解度、负载能力及负载效率的测定
Qu质量浓度测定的标准曲线绘制:用体积分数80%乙醇配制2.5、5、7.5、10、12.5、15、17.5、20 μg/mL的Qu标准溶液,于372 nm波长处测定吸光度并绘制标准曲线。Qu质量浓度在0~20 μg/mL的范围内与吸光度呈良好的线性关系,线性回归方程为:y=0.075 35x-0.004 29,R2=0.999 91。
样品中Qu表观溶解度的测定:取1.3.2节中的上清液(负载液)1 mL(或将PG-Qu冻干粉复溶于去离子水中配制一定质量浓度的复溶液,取复溶液1 mL),以体积比1∶4的比例加入无水乙醇,混匀后离心(10 000×g、30 min),取上清液,测其在372 nm波长处的吸光度。按照公式(1)~(3)分别计算Qu的表观溶解度、负载能力和负载效率。

1.3.5 抗氧化活性的测定
样品准备:分别配制一定质量浓度的VC水溶液、Qu-乙醇溶液和PG-Qu水溶液3 组样品,3 组样品按以下方法进行实验,体系中Qu的终质量浓度均为0~80 μg/mL。
总还原力测定:参考黄晓霞[24]的方法并做适当修改,取0.5 mL样品液于试管中,加入1.5 mL、10 mg/mL铁氰化钾(K3Fe(CN)6)溶液,50 ℃水浴保温20 min;冷却后加入2.5 mL、100 mg/mL三氯乙酸溶液;取混合液2.5 mL,依次加入2.5 mL去离子水和0.5 mL、1 mg/mL FeCl3溶液,充分混匀,静置10 min后,于700 nm波长处测定吸光度。用等体积去离子水或无水乙醇代替样品分别作VC(去离子水)、PG-Qu(去离子水)和Qu(无水乙醇)的空白对照,用去离子水调零。总还原力以样品吸光度减对应的空白对照吸光度的差值表示。以样品终质量浓度为横坐标,吸光度差值为纵坐标进行作图。以VC作阳性对照。吸光度差值越大表示还原能力越强。
羟自由基清除能力按水杨酸法测定。取0.25 mL样液于试管中,加入1 mL 6 mmol/L的硫酸亚铁(FeSO4)溶液和0.25 mL 6 mmol/L的水杨酸乙醇溶液,最后加入1 mL 6 mmol/L的H2O2溶液启动反应,37 ℃水浴2 h,于513 nm波长处测定吸光度,记为A1;用等体积去离子水或无水乙醇代替样品分别作VC(去离子水)、PG-Qu(去离子水)和Qu(无水乙醇)的空白对照,用去离子水调零,测得吸光度A0;用等体积去离子水代替H2O2作背景组,以减去Qu的本底吸光度。以样品质量浓度为横坐标,羟自由基清除率为纵坐标绘图,其中PG-Qu组样品清除率为PG-Qu中Qu的清除率。以VC作阳性对照。样品对羟自由基的清除率按式(4)计算。

1.3.6 癌细胞抑制作用
样品准备:将Qu分散至DMEM培养基中配制Qu悬浊液,记为Qu/H2O组;将Qu溶于二甲基亚砜(dimethyl sulfoxide,DMSO)中配制成质量浓度为1 mg/mL的母液,再以DMEM培养基稀释得到不同质量浓度的样品(DMSO体积分数控制在1%以下),记为Qu/DMSO组;将PG-Qu复合物冻干粉复溶于DMEM培养基中配制不同质量浓度PG-Qu样品液,记为PG-Qu组;上述3 组样品浓度以Qu计,均为0~100 μmol/L。同时,将PG溶于DMEM培养基配制与PG-Qu组相同PG质量浓度的样品,记为PG组。
采用噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT)法研究样品对MCF-7细胞和A549细胞增殖的抑制作用。具体为:MCF-7和A549细胞用含体积分数10%胎牛血清、100 U/mL双抗的DMEM高糖培养基培养,37 ℃、含体积分数5% CO2的恒温培养箱中培养至细胞80%铺满瓶底;贴壁细胞用0.25%胰酶(含0.02% EDTA)消化1 min后,弃去胰酶,用DMEM培养基将细胞吹打下来,制成细胞悬液,以1×105个/mL的细胞浓度接种至96 孔板,每孔200 μL,培养24 h。弃去旧培养基,加入200 μL新鲜培养基或样品液,继续培养24 h。弃去旧培养基,磷酸盐缓冲溶液(phosphate buffered saline,PBS)清洗两次,每孔加入200 μL新鲜培养基和10 μL MTT(5 mg/mL),继续培养4 h。利用酶标仪测490 nm波长处样品吸光度,记为A2,加等体积培养基的吸光度记为A1,加等体积PBS的孔中溶液吸光度记为A0,根据式(5)计算抑制率,PG-Qu组抑制率为扣除PG组抑制率之后的数据,n=6。

1.3.7 PG-Qu的结构表征
1.3.7.1 粒径分布的测定
配制4、5、6、8、10 mg/mL的PG溶液分别和6 mg/mL的Qu溶液,按照1.3.2节中的方法进行负载,得到不同PG质量浓度的PG-Qu复合物负载液。负载液分别用去离子水稀释至PG终质量浓度为2 mg/mL,漩涡振荡器混匀,使用Nano-ZS90动态光散射激光粒度仪测定其粒径分布、聚合物分散指数(polymer dispersity index,PDI)。
1.3.7.2 TEM分析样品内部结构
将PG-Qu复合物溶于0.02 mol/L的醋酸钠缓冲溶液(pH 5.5)中,配制成0.01 g/100 mL的PG-Qu复合物溶液,取一滴滴在碳涂层上,干燥后再次重复上一步操作;用15 mg/mL的磷钨酸染液滴一滴在加有样品的铜网上进行负染,2 min后用滤纸吸去多余的染色液,样品在室温下干燥过夜后进行TEM成像处理[25]。
1.3.7.3 FTIR光谱的测定
精确称取Qu和PG,并以1∶100质量比混合均匀,制成Qu与PG的物理混合物,分别称取Qu、PG、Qu与PG的物理混合物和PG-Qu复合物冻干粉4 种样品各1~2 mg,将样品分别与100 mg溴化钾(KBr)粉末加入研钵中并研磨均匀,用压片机压片,用不加样的KBr压片作为背景空白,扫描范围500~4 000 cm-1,分辨率4 cm-1,扫描32 次。
1.3.7.4 XRD图谱测定
工作条件:Cu靶,扫描速率8°/min,测定管压40 kV,管流40 mA,扫描范围5°~35°(2θ)。分别对Qu、PG、PG和Qu的物理混合物以及PG-Qu复合物进行XRD测定。
1.4 数据处理与统计
所有实验重复3 次,结果以平均值±标准差表示;利用DPS软件中实验统计-完全随机设计-单因素试验统计分析进行数据的差异显著性分析(P<0.05);用Origin 8.5软件作图。
2 结果与分析
2.1 不同因素对PG负载Qu的影响
本研究将少量高质量浓度(6 mg/mL)的Qu乙醇溶液分散于一定质量浓度的PG溶液中,使体系中Qu处于过饱和状态,乙醇体积分数为1%。此时,即存在Qu分子相互聚集从而生成沉淀的过程,同时也存在Qu与PG分子相互作用形成PG-Qu复合物的过程,两个过程彼此竞争;通过离心操作除去Qu沉淀,得到可溶性PG-Qu复合物。

图1 不同因素对PG负载Qu的影响Fig. 1 Influence of different factors on Qu loading onto PG
如图1A所示,当体系中不存在PG时,由于Qu的溶解度很低,吸光度小于本实验检测方法的最低检测限(分光光度法),无法测得准确数值。当PG质量浓度在1~5 mg/mL范围内,Qu表观溶解度随PG质量浓度增大而显著增大;随后继续提高PG质量浓度,表观溶解度不再增加。PG对Qu的负载效率的影响呈类似规律,而负载能力则随PG质量浓度增大呈现减-增-减的变化趋势。当PG质量浓度为5 mg/mL时,表观溶解度、负载能力和负载效率达到最大值,分别为47 μg/mL、9.49 μg/mg和78.33%。
如图1B所示,当Qu质量浓度在1~6 mg/mL范围内,Q u表观溶解度和负载能力随Q u质量浓度增大而显著增大,表观溶解度提高了5.37 倍,负载效率无显著变化(7 0.9 8%~7 9.8 8%);随后继续提高Q u质量浓度至8 m g/m L,表观溶解度、负载能力和负载效率均呈逐步下降趋势。由于负载体系中Qu处于过饱和状态,同时存在Qu分子相互聚集生成沉淀以及Qu与PG分子相互作用生成可溶性PG-Qu复合物两个过程,彼此竞争;因此,当Qu质量浓度较小时(小于6 mg/mL),体系中存在的PG分子数量足以用于负载Qu,即形成可溶性复合物的过程占优势;当进一步增大Qu质量浓度时,体系中的PG分子数量相对不足,Qu分子的相互聚集生成沉淀的过程占优势,从而导致Qu表观溶解度下降。
如图1C所示,当溶液pH值从2增至6时,Qu的表观溶解度未发生显著变化;pH值从6增至8时,Qu的表观溶解度提高了3.9 倍。负载效率和负载能力呈类似变化规律,最大值分别可达75.82%、9.19 μg/mg。据报道,Qu的—OH的去质子化顺序为4’—OH、7—OH、3—OH、3’—OH、5—OH,对应的pKa分别为6.41、7.81、10.91、11.53、12.91,Qu在pH 5以下的酸性环境中不会发生去质子化[26]。本实验中,当体系pH值小于6时,由于Qu几乎不发生去质子化,Qu分子趋向于相互聚集生成沉淀;当pH值大于6时,Qu的羟基发生去质子化而使分子带有部分电荷,呈电负性的Qu分子倾向于以游离的单分子形式存在,从而增大了其与PG相互作用的机率。

图2 NaCl(A)、醋酸盐(B)、磷酸盐(C)浓度对PG负载Qu的影响Fig. 2 Effect of NaCl (A), acetate (B), phosphate (C) concentrations on Qu loading onto PG
NaCl和醋酸盐浓度对负载无显著影响(图2A、B)。磷酸盐浓度则显著影响PG对Qu的负载,当磷酸盐浓度从0 mmol/L增至5 mmol/L时,Qu表观溶解度急剧下降了25.20%;继续增大磷酸盐浓度至20 mmol/L,Qu的表观溶解度持续下降至初始的66.57%(图2C)。
在上述研究结果基础上,采用5 mg/mL的PG溶液和6 mg/mL的Qu乙醇溶液在pH 8不含磷酸盐的条件下负载,制备了PG-Qu复合物溶液。将溶液冻干成粉,冷水复溶至PG质量浓度为50 mg/mL,得到黏度低、流动性强、状态稳定的复溶液。测得此条件下Qu的表观溶解度为509.46 μg/mL,与在水中Qu表观溶解度(2.84 μg/mL)相比提高近180 倍,负载效率为79.88%,负载能力为9.68 μg/mg。
当将PG-Qu复合物冻干粉复溶至PG质量浓度20 mg/mL时,Qu的表观溶解度虽然仅有201.56 μg/mL,与文献[8]的结果相比降低,但负载效率提高了近20 倍,减少了Qu的用量,降低了制备成本。
2.2 PG负载对Qu抗氧化活性的影响

图3 Qu、PG-Qu的总还原力(A)和羟自由基清除能力(B)Fig. 3 Total reducing power (A) and hydroxyl radical scavenging ability (B) of Qu and PG-Qu complex
如图3A、B所示,Qu组和PG-Qu组样品的总还原力和羟自由基清除能力均呈现良好的量效关系;当Qu质量浓度相同时,PG-Qu组样品的总还原力和羟自由基清除能力高于Qu组,与Lee[27]、刘康[28]等分别报道的Qu/二氧化硅纳米粒、Qu/壳聚糖纳米粒与Qu相比,对羟自由基和的清除作用有所提高的结果相同。因此,PG负载Qu形成PG-Qu复合物纳米粒后,其抗氧化活性与Qu相比增强,可能是因为Qu制备成纳米粒后的表面积增加,使其与活性自由基接触几率更大。
2.3 PG负载对Qu抑制癌细胞效果的影响

图4 Qu和PG-Qu对MCF-7(A)和A549(B)细胞的抑制作用Fig. 4 Inhibition of MCF-7 cells (A) and A549 cells (B) by Qu and PG-Qu complex
Qu可以通过调节细胞生长过程抑制结肠癌细胞、乳腺癌细胞、肺癌细胞、肝癌细胞等多种癌细胞的增殖[29-32]。如图4所示,不同组中,Qu对MCF-7细胞和A549细胞的抑制作用均呈剂量依赖性;细胞培养过程中,Qu浓度为20~100 μmol/L时,各组对这两种细胞的抑制率从大到小均依次为Qu/DMSO组>PG-Qu组>Qu/H2O组,且组间差异显著。表明PG负载Qu后能显著提高Qu对MCF-7细胞和A549细胞增殖的抑制作用。细胞实验中常用DMSO溶解Qu,再以培养基稀释制备Qu,并不是将Qu直接溶于DMEM培养基中,因溶剂中含有DMSO,故Qu/DMSO组的结果不能完全反映出游离Qu在水体系中的细胞抑制效果;Qu/H2O组和PG-Qu组均直接用培养基配制,PG-Qu组的细胞抑制率显著高于Qu/H2O组,表明PG-Qu复合物能显著提高Qu在水体系中的细胞抑制效果。

图5 Quu/H2O、PG-Qu、Qu/DMSO处理24 h后MCF-7(A)、A549(B)细胞显微镜图Fig. 5 Microscopic images of MCF-7 cells (A) and A549 cells (B) after 24 h treatment with Qu/H2 OO, PG-Qu, and Qu/DMSO
100 μmol/L的Qu/H2O、PG-Qu、Qu/DMSO和不加样品的培养基分别培养MCF-7细胞和A549细胞24 h后,置于倒置显微镜下观察细胞形态,结果见图5。对于MCF-7细胞,空白孔(图5A1)的细胞分布均匀,细胞形态完整,细胞边缘清晰可见;Qu/H2O组(图5A2)细胞边缘模糊,细胞形态发生变化;PG-Qu组(图5A3)细胞严重变形,细胞裂解成碎片;Qu/DMSO组(图5A4)细胞凋亡严重,瓶底仅剩少部分细胞碎片附着。对于A549细胞,空白孔(图5B1)的细胞分布均匀,细胞生长致密;Qu/H2O组(图5B2)细胞间隙增大,细胞出现空泡;PG-Qu组(图5B3)可见细胞数量明显减少,现存的细胞严重皱缩变形,细胞裂解;Qu/DMSO组(图5B4)细胞凋亡严重,瓶底仅剩少部分细胞碎片附着。
2.4 PG-Qu复合物的结构表征结果
2.4.1 PG-Qu复合物的粒径分布及Zeta电位
利用Nano-ZS90激光粒度仪测定PG负载Qu前后的粒径分布,结果见图6和表2。PG的平均粒径约为71.51 nm;不同质量浓度PG负载Qu得到PG-Qu复合物的粒径与PG相比无显著变化,均在68~72 nm之间;PG和PG-Qu复合物粒径的PDI均小于0.15,表明PG和PG-Qu复合物粒径分布均匀;PG的Zeta电位为-4.12 mV,负载Qu后PG-Qu的Zeta电位显著下降至约-10 mV,推测可能因为在负载条件下(pH 7.74)PG带负电荷,而Qu的羟基发生去质子化使Qu呈电负性,故PG负载Qu后所带负电荷显著增加。

图6 PG、PG-Qu复合物的粒径分布Fig. 6 Particle size distribution of PG and PG-Qu complex in aqueous solution

表2 PG-Qu和PG的平均粒径和PDITable 2 Average particle size and polymer dispersity index of PG-Qu complex and PG
2.4.2 TEM分析结果

图7 PG(A)、PG-Qu复合物(B)的TEM图像Fig. 7 TEM images of PG (A) and PG-Qu complex (B)
如图7所示,PG表现为分布均匀、表面光滑的球形结构,直径约30~50 nm,与Huang Lei[20]和Bi Lin[33]等采用TEM测定PG纳米粒的粒径结果相近。PG-Qu复合物形貌与PG相比无明显变化。TEM成像所测粒径小于采用激光粒度仪测定的平均粒径(68~72 nm)。采用TEM观察样品时,样品需做干燥处理,样品分子脱水,使测得的粒径小于溶液状态下水化分子时采用激光粒度仪测定的粒径。
2.4.3 FTIR结果

图8 Qu(a)、PG(b)、PG-Qu物理混合物(c)和PG-Qu(d)红外谱图Fig. 8 FTIR spectra of Qu (a), PG (b), physical mixture of PG and Qu (c)and PG-Qu complex (d)
如图8所示,在PG的光谱中,峰位3 368 cm-1出现一宽峰,为—OH的伸缩振动。在Qu的光谱中,3 312 cm-1处的峰为—OH的伸缩振动峰,1 664 cm-1处为C环上的—C=O的伸缩振动峰,1 612 cm-1处为C环上的—C=C的伸缩振动峰,1 512 cm-1和1 560 cm-1处的峰分别为Qu的A环和B环的苯环特征振动峰。在Qu与PG的物理混合物光谱中,上述Qu的特征吸收峰均存在;其中,1 664 cm-1处的-C=O伸缩振动峰移至1 662 cm-1处,1 560 cm-1的峰移至1 559 cm-1处。PG-Qu复合物红外光谱中,Qu光谱中1 664、1 612、1 560 cm-1和1 512 cm-1处的特征吸收峰均消失,PG的—OH的伸缩振动从3 368 cm-1红移至3 374 cm-1,表明PG与Qu发生了相互作用[8,34-35]。据文献报道,氢键是酚类化合物与聚合物发生相互作用的主要作用力[36]。本研究中,PG-Qu复合物光谱中,Qu C环—C=O的伸缩振动吸收峰消失,表明其可能参与了PG与Qu间氢键的形成。
2.4.4 XRD结果
由图9可知,Qu在衍射角(2θ)13.18°、16.85°、22.04°和26.70°处有明显的衍射峰存在,表明其为晶体结构[35,37];PG不是晶体,故其衍射光谱中没有明显衍射峰;Qu衍射峰在Qu与PG物理混合物的衍射图谱中基本上都存在,表明Qu以晶体形式存在于混合物中;PG-Qu复合物衍射图谱中所有衍射峰都消失,表明PG-Qu中Qu几乎以无定形的状态存在。PG可以通过形成氢键与Qu相互作用,从而破坏Qu的原始晶体结构,使Qu转化为无定形状态。物质的结晶状态影响其溶解度[38-40],Qu晶体结构紧密,导致其水溶性差;而PG-Qu复合物中Qu的无定形状态提高了其在水中的溶解度。
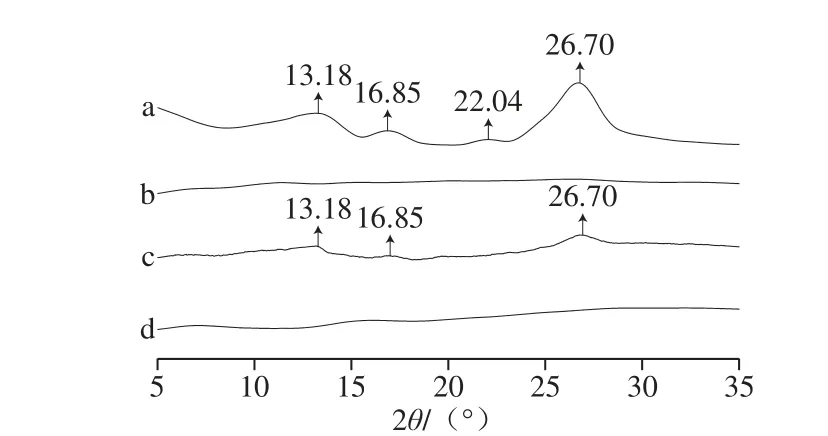
图9 Qu(a)、PG(b)、PG-Qu物理混合物(c)和PG-QQuu(dd)XRD谱图Fig. 9 XRD spectra of Qu (a), PG (b), physical mixture of PG and Qu (c) and PG-Qu complex (d)
3 结 论
PG是一种新型的载体,通过简单的步骤负载Qu得到PG-Qu复合物,粒度分布均匀且与PG相比粒径无显著差异;负载液冻干后复溶至PG质量浓度为50 mg/mL,Qu表观溶解度可提高近180 倍,负载能力为9.68 μg/mg,负载效率为79.88%。PG负载Qu前后均呈均匀光滑的球形结构,粒径无显著变化,利用激光粒度仪测定的平均粒径为68~72 nm。Qu在PG-Qu复合物中以无定形的非晶体形式存在,氢键是Qu与PG发生作用的主要作用力。PG-Qu复合物与Qu相比抗氧化性和对癌细胞(MCF-7细胞和A549细胞)的抑制作用均显著提高。综合以上可得出,PG是一种高效的载体,可显著提高Qu的表观溶解度,同时可提高Qu的抗氧化性和癌细胞抑制作用,因此有望被应用于功能食品中以促进Qu的药理作用。
