糖耐量异常患者与糖耐量正常人群肠道菌群差异性研究
2020-04-07王智峰徐心悦姜玫
王智峰 徐心悦 姜玫
【摘要】 目的 探讨糖耐量异常(IGT)患者和糖耐量正常人群肠道菌群的差异性。方法 选取20例糖耐量异常患者作为研究组, 另选20例接受健康体检的健康人群作为常规组。收集所有研究对象的新鲜粪便样品, 提取其中的细菌总DNA, 采用细菌通用扩增引物分别进行聚合酶链式反应(PCR)扩增, 对获得的PCR产物展开测序分析, 测序完成后, 使用ABI实时荧光定量PCR仪检验肠道中常见的细菌种类。比较两组肠道菌群种类及数量。结果 通过检测数据发现, 本研究所有样品中共检查出三类细菌, 分别为拟杆菌门、厚壁菌门和变形菌门, 而拟杆菌门细菌是人体肠道中的主要优势细菌。研究组拟杆菌门中普雷沃氏菌属与拟杆菌属细菌种类数量分别为(2.3±1.4)、(5.1±1.5)种低于常规组的(5.5±2.0)、(8.1±2.5)种, 差异有统计学意义(P<0.05)。研究组厚壁菌门中毛螺菌属与乳酸菌属细菌种类数量分别为(2.2±1.3)、(1.3±0.8)种低于常规组的(6.2±2.1)、(7.0±2.8)种, 差异有统计学意义(P<0.05)。研究组变形菌门中大肠埃希菌与志贺菌属细菌种类数量分别为(4.3±1.3)、(4.1±1.2)种, 对照组变形菌门中大肠埃希菌与志贺菌属细菌种类数量分别为(5.1±1.4)、(4.3±1.3)种, 两组比较差异无统计学意义(P>0.05)。结论 糖耐量异常患者肠道菌群中优势菌群的含量明显低于糖耐量正常人群肠道中优势菌群的含量, 需要针对性地展开治疗。
【关键词】 糖耐量异常;肠道菌群;差异性
DOI:10.14163/j.cnki.11-5547/r.2020.07.022
随着科技进步, 人们的生活质量越来越高, 糖耐量异常患者的肠道菌群情况逐渐成为医疗界的重点研究对象[1]。肠道菌群主要包括人体肠道中的小生物群或基因组。大量实验表明, 肠道菌群不仅会影响到人体的整体健康, 还是导致肥胖、糖尿病等慢性疾病的主要危险因素[2]。葡萄糖耐量是指人体对摄入葡萄糖的耐受能力, 糖耐量异常(IGT)的判断标准为人在用餐结束的2 h内, 血糖值大于正常值, 但尚未达到糖尿病的判断标准, 即称作糖耐量异常[3]。本课题重点研究了糖耐量异常患者的肠道菌群特点, 以及和健康人群之间的区别, 现报告如下。
1 资料与方法
1. 1 一般资料 选取2018年3~8月本院内分泌科收治的20例糖耐量异常患者作为研究组, 另选取于本院接受健康体检的20例健康人群作为常规组。研究组中, 男12例, 女8例;年龄31~45岁, 平均年龄(38.5±4.2)岁。
常规组中, 男9例, 女11例;年龄34~43岁, 平均年龄(38.2±4.1)岁。两组患者一般资料比较, 差异无统计学意义(P>0.05), 具有可比性。本次研究已经大连大学附属新华医院伦理委员会认证, 并且所有研究对象均详细了解整体过程, 同意进行研究并签订知情同意书。
1. 1. 1 纳入标准 ①与世界卫生组织(WHO)和国际糖尿病联盟(IDF)糖尿病专家委员会(1999年)指出的糖耐量异常判断标准完全吻合。②空腹时血糖值<7.0 mmol/L。③接受葡萄糖耐量实验2 h后, 血糖值<11.1 mmol/L[4]。
1. 1. 2 排除标准 ①患者年龄>25岁且<75岁。②处
于妊娠或者哺乳期的女性。③6个月前伴有严重高血压、心肌梗死或者脑血管意外病史的患者。④患者在研究前3个月内未服用过抗生素, 且在半个月内未服用益生元或益生菌等药物。⑤研究前3个月内未出现腹泻、便秘、痢疾等疾病[5]。
1. 2 方法
1. 2. 1 样本收集 在无菌环境下, 分别收集两组研究对象的新鲜粪便, 在粪便中心位置收集10~15 g, 置入无菌冷存管后冷藏, 样品收集的整体过程均和医院的伦理要求符合[4]。
1. 2. 2 DNA采集 实验样品中微生物总DNA的提取工作, 使用购自德国的QIAamp DNA Stool Mini Kit仪器进行, 样品量为100 mg, 详细的操作方法参考说明书进行。将收集的DNA使用購自美国的NanoDrop ND-1000分光光度计进行测定, 然后置于-80℃的环境下冷藏备用[6]。
1. 2. 3 聚合酶链式反应 参考获得的总DNA进行扩增工作和产物测序, 16S rRNA PCR引物的主要构成包括:测序接头引物、Index以及V3区引物。Index是一种主要构成为6bp核苷酸的序列, 主要用途为标记PCR产物的来源。PCR的扩增体系共包括25 μl, 扩增条件为:①在98℃的环境下预变性30 s;②在98℃环境下变性10 s, 在50℃的环境下退火30 s, 在72℃的环境下延伸30s, 持续循环20次;③在72℃的环境下延伸7 min, 并于4℃的环境下储存。反应完成后, 使用浓度为1.5%的琼脂糖凝胶电泳检验扩增片段的大小, 使用QIAquick Gel Extraction Kit仪器处理目的条带胶。使用美国的Illumina Miseq高通量测序平台对获得16S rRNA-V3区的PCR产物展开测序[7]。
1. 2. 4 生物信息学分析和荧光定量PCR 测序完成后, 对PCR产物的高质量序列展开提取, 然后使用ABI实时荧光定量PCR仪检验肠道中常见的细菌种类[8]。
1. 3 统计学方法 采用SPSS23.0统计学软件对数据进行处理。计量资料以均数±标准差( x-±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
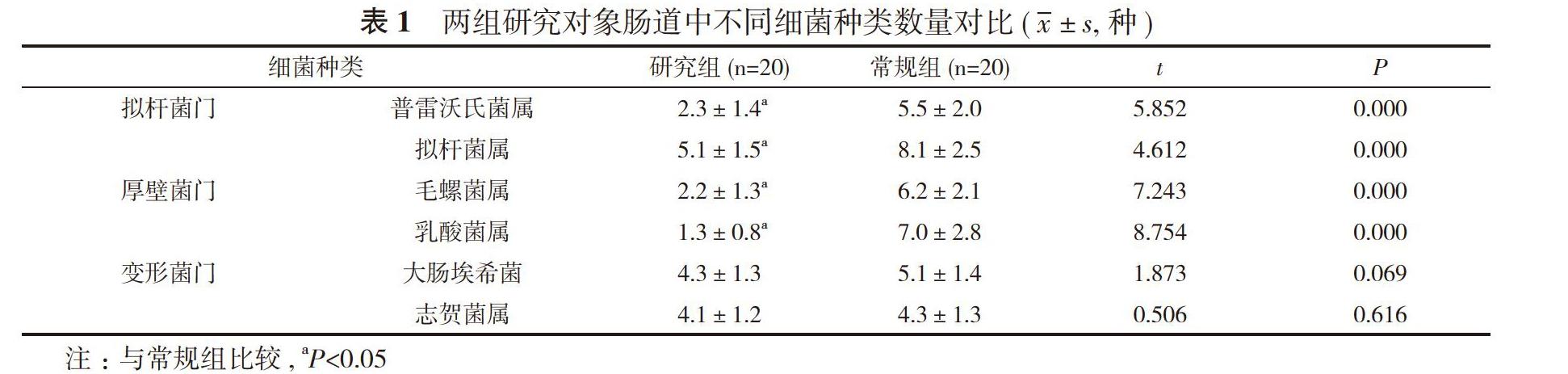
通过检测数据发现, 本研究所有样品中共检查出三类细菌, 分别为拟杆菌门、厚壁菌门和变形菌门, 而拟杆菌门细菌是人体肠道中的主要优势细菌。研究组拟杆菌门中普雷沃氏菌属与拟杆菌属细菌种类数量分别为(2.3±1.4)、(5.1±1.5)种低于常规组的(5.5±2.0)、(8.1±2.5)种,
差异有统计学意义(P<0.05)。研究组厚壁菌门中毛螺菌属与乳酸菌属细菌种类数量分别为(2.2±1.3)、(1.3±0.8)种低于常规组的(6.2±2.1)、(7.0±2.8)种, 差异有统计学意义(P<0.05)。研究组变形菌门中大肠埃希菌与志贺菌属细菌种类数量分别为(4.3±1.3)、(4.1±1.2)种, 对照组变形菌门中大肠埃希菌与志贺菌属细菌种类数量分别为(5.1±1.4)、(4.3±1.3)种, 两组比较差异无统计学意义(P>0.05)。见表1。
3 讨论
葡萄糖耐量是指机体对体内葡萄糖的耐受能力。若在饭后2 h血糖值超过正常指标, 即7.8 mmol/L, 但没有超过糖尿病判断标准(11.1 mmol/L);或者患者在空腹时血糖值虽然上升, 处于6.2~7.0 mmol/L之间, 但未达到糖尿病的判断标准, 即称作糖耐量异常[9]。现阶段, 医疗界已经将糖耐量异常作为糖尿病初期发病的黄金指标。相关资料[10]表明, 每年约有7%的糖耐量异常患者转化成2型糖尿病, 并且糖耐量异常患者发生心肌梗死、心绞痛等心血管疾病的几率也会随之上升。随着科技的不断进步, 关于肠道菌群的研究渐渐增加。肠道菌群属于肠道中的小生物群或者其他基因组织。大量实验指出, 肠道菌群不仅能够保持人体的整体健康, 还和肥胖、2型糖尿病等慢性代谢性疾病的发生、恶化具有紧密联系。在人类的胃肠道中, 已知的细菌数量超过1000种, 数量约为1014个。菌群的生物学分类从大到小分别为种、属、科、目、纲、门, 现阶段的研究大多集中在“门”与“属”这两个范围, 在此基础上研究不同菌群和机体代谢之间的联系[11]。
目前, 国内糖耐量异常的患者基数日益增加, 但是对于该类患者的干预治疗措施相对较少, 临床效果相对较差[12]。通过本研究能够明确不同糖耐量异常患者的肠道菌群特征, 分析糖耐量异常患者与糖耐量正常人群之间的差别, 通过调控肠道菌群来避免糖耐量异常患者发展成为糖尿病, 从而降低糖尿病的发病率, 以及因糖尿病并发症导致的社会问题及经济压力。
机体肠道中的微生物菌群与机体自身的代谢功能具有紧密联系, 其含量与种类的改变会直接引起各类慢性代谢类疾病。大量实验指出, 体内微生物菌群与机体的神经系统、内分泌系统以及免疫系统之间均具有紧密联系[13]。
综上所述, 糖耐量异常患者的肠道菌群和健康人群相比存在明显的差异, 因此需要针对性的实施治疗。
参考文献
[1] Lloyd-Price J, Mahurkar A, Rahnavard G, et al. Strains, functions and dynamics in the expanded Human Microbiome Project. Nature, 2017, 550(7674):61-66.
[2] Medina-Vera I, Sanchez-Tapia M, Noriega-López L, et al. A dietary intervention with functional foods reduces metabolic endotoxaemia and attenuates biochemical abnormalities by modifying faecal microbiota in people with type 2 diabetes. Diabetes Metab, 2018, 45(2):122-131.
[3] Balakumar M, Prabhu D, Sathishkumar C, et al. Improvement in glucose tolerance and insulin sensitivity by probiotic strains of Indian gut origin in high-fat diet-fed C57BL/6J mice. Eur J Nutr, 2018, 57(1):279-295.
[4] 蒋岚, 陈果, 高陈林, 等. 益生菌对T2DM患者肠道菌群和脂联素的影响. 中国现代医学杂志, 2018, 28(11):84-87.
[5] Liu F, Prabhakar M, Ju J, et al. Effect of inulin-type fructans on blood lipid profile and glucose level:a systematic review and meta-analysis of randomized controlled trials. Eur J Clin Nutr, 2017, 71(1):9-20.
[6] 吴琳英, 邓顺有, 王毅飞, 等. 阿托伐他汀对2型糖尿病小鼠肠道菌群的影响. 中国实用医药, 2017, 12(22):128-130
[7] 刘丹英, 叶小斌. 阿奇霉素联合莫沙必利对糖尿病胃轻瘫患者肠道菌群的影响. 中国微生态学杂志, 2018, 30(2):185-188.
[8] 胡文斌, 张婷, 张小花, 等. 文化程度和肥胖指标交互作用对糖尿病前期患病影响研究. 中国慢性病预防与控制, 2017, 25(9):658-661.
[9] 徐绮, 薛锦花, 刘连勇, 等. 某社区中年人群糖尿病患者综合管理现况与分析. 中华全科医学, 2017, 15(8):1374-1377.
[10] 张景雪. 一体化教育管理模式对糖耐量异常患者治疗依从性的影响. 河南医学研究, 2017, 26(1):160-161.
[11] 陳海燕. 社区综合干预管理模式在糖耐量异常患者中的应用效果观察. 中国医药科学, 2017, 7(2):113-115.
[12] 王一洒, 袁建军, 朱好辉, 等. 应用分层应变技术评估Ⅱ型糖尿病及糖耐量异常患者左心室各层心肌收缩功能改变. 中国超声医学杂志, 2017, 33(1):27-31.
[13] 贾爱华, 徐少勇, 明洁, 等. 我国不同诊断标准下肥胖流行病学特征分析. 中国糖尿病杂志, 2017, 9(4):221-225.
[收稿日期:2019-07-17]
