腌制蒸煮猪肉切片冷藏期间色泽变化与氮的存在形式及氧化状态的关系
2020-04-02
(湖北安琪酵母股份有限公司,湖北宜昌 443003)
腌制是传统的食品加工保鲜工艺,腌制肉制品是现代肉品加工中的重要环节[1]。它能够使肉品呈现特有色泽,产生特有风味,改善肉的品质,延长货架期[2]。肉制品的色泽是影响消费者购买的决定性因素,褪色容易给人一种腐败的错觉,褪色严重影响产品的外观品质[3],降低产品的商品价值,甚至无法销售,但由于生产工艺和贮藏条件等因素,蒸煮腌肉制品在冷藏期间褪色现象普遍存在,褪色是限制蒸煮肉制品发展的主要原因[4-5]。
有关腌制肉制品品质因素和货架期的关系的研究较多,大多集中在微生物因素、贮藏温度、贮藏时间、肉制品的质构特征和其他因素(包装方式、pH、水分活度)等方面[6]。段红敏[7]研究了包装材料对酱卤类低温肉制品品质影响;王新惠等[8]研究了储藏温度对腊肉品质的影响;王梓昂[9]报道了基于预测微生物学理论对真空包装酱牛肉进行货架期预测;苟惠天等[10]报道了细胞凋亡酶在肉品成熟过程中对其嫩度影响;Mancini等[11]报道表明高pH可以维持蒸煮猪肉产品的粉红色,而且可以延长冷藏期间产品红色的保持时间。目前对影响腌制品肉品质的多因素的综合研究还比较少。
本文通过主成分分析(PCA)法研究了猪肉切片的色泽、理化指标、游离氨基酸、生物胺和一些氧化指标,系统的了解了蒸煮腌制肉制品在冷藏期间的色泽变化同氮的存在形式及氧化状态的关系,对有效改善蒸煮腌制肉制品褪色等方面提供了理论指导。
1 材料与方法
1.1 材料与仪器
新鲜的猪肉 购于荆州市农贸市场,在实验室按照食品卫生标准自制成西式蒸煮火腿切片;色胺(TRY)、腐胺(TUT)、尸胺(CAD)、酪胺(TYR)、苯乙胺(PHE)、亚精胺(SPD)、精胺(SPM)、游离氨基酸(FAA)、衍生丹黄酰氯(dansyl chloride) 标准品,美国Sigma公司;乙腈、正己烷 色谱纯,天津科密欧化学试剂有限公司;丙酮、石油醚(沸程为30~60 ℃)、乙酸乙酯、NaNO2分析纯,天津科密欧化学试剂有限公司;抗坏血酸钠、磷酸盐 食品纯,国药集团化学试剂有限公司。
18W/830荧光灯管 飞利浦照明股份有限公司;FSH-II型高速电动匀浆器 江苏金坛市环宇科学仪器厂;Allegra X-30R多功能台式离心机 美国Beckman公司;日立全自动氨基酸分析仪L-890 日本日立公司;旋转蒸发仪N-1200B 日本EYELA东京理化;TU-1900紫外可见分光光度计 北京普析通用仪器有限责任公司;PURELAB classic系列纯水机 英国ELGA;CENTER®337照度计 台湾NORTHERN BANKER ART有限公司;TM-902C中心温度计 南京万达有限公司;CR 400便携式色差仪(D65光源) 日本Minolta公司;Waters Alliance 2695高效液相色谱仪(UV检测器:Waters 2487AgilentZORBAXXDB-C18柱,4.6 mm×250 mm,5 μm) 美国Waters公司。
1.2 实验方法
1.2.1 原料处理 根据Dineen等[12]、孙卫青等[13]的方法加以改善制备蒸煮腌制猪肉切片,将从农贸市场购买的新鲜的原料猪肉剔除脂肪、筋膜和表面血污,用消毒后的菜刀将粗处理后的原料肉分割成1 cm×1 cm×5 cm左右的肉块。按照每1 kg的肉加入NaNO2150 mg,抗坏血酸钠400 mg和食盐20 g的量配制腌制液,在用筛板孔径10 nm的绞肉机绞碎的肉块中加入10%腌制液,然后一起放入斩拌机中做成肉糜,用铝箔袋真空包装(1 kg/袋),放在(4±1) ℃下发色48 h后装入容量为1.25 kg的火腿模具,(80±1) ℃水浴加热50 min,中心温度达到了72 ℃左右,然后将模板取出放置在(4±1) ℃下冷却4 h。将火腿脱模切片后按照每袋25 g的量真空包装。模拟超市西式蒸煮火腿切片冷藏橱窗储存环境,将样品单层平铺在控温冰箱的隔板上,上面45 cm处固定2支荧光灯管,环境温度为(8±1) ℃,在1000 lx光照强度下。取样速冻在-80 ℃的冰箱直到实验结束,同时在1、7、14、21、28和35 d的时候测定样品表观色泽和色素含量,所有的指标都重复测3次。
1.2.2 色泽参数的测定
1.2.2.1 色泽的测定 猪肉切片表观色泽使用CR 400色差仪测定,先用标准板校对色差仪,用L*、a*、b*系统测定样品色泽参数。
Hue=tan-1(b*/a*)
式(1)
C=(a*2+b*2)1/2
式(2)
1.2.2.2 水分、pH、盐分及亚硝酸盐含量的测定 水分的测定参照GB/T 5009.3-2010方法[14];pH的测定参照GB/T 9695.5-2008方法[15];盐分的测定参照GB/T 12457-2008方法[16];亚硝酸盐的测定参照GB/T 5009.33-2010方法[17]。
1.2.2.3 亚硝基血色原(NH)的测定 参照Hornsey[18]的方法并改善。在微弱红光的暗室中,准确称取碎肉样品10 g,加入丙酮水溶液(40∶2.7,V/V)42.7 mL,在氮吹条件下搅拌均匀,密封后放在黑暗中静置10 min,然后离心(3000 r/min,5 min,4 ℃),过滤后在540 nm处比色,亚硝基血红素在540 nm吸光度乘以因子290为肉中亚硝基血红素浓度。
NH(mg/kg)=A540×290
1.2.3 生物胺及游离氨基酸含量的测定
1.2.3.1 生物胺的测定 按照孙卫青[19]的方法测定,HPLC设备和液相条件:Waters Alliance 2695 Separationgs Module高效液相色谱系统,紫外检测器:Waters 2487 Dual λ Absorbance Detector;XDB-C18柱。柱温为30 ℃;流速1.0 mL/min;注射体积为20 μL;检测波长为254.8 nm;流动相为水和乙腈。
1.2.3.2 游离氨基酸的测定 按照孙卫青[5]的方法,将处理好的样品用氨基酸自动分析仪检测,除羟脯氨酸在440 nm处检测外,其他的氨基酸都在570 nm处检测。
1.2.4 蛋白质和脂肪氧化相关指标的测定
1.2.4.1 蛋白质(Pr)和非蛋白氮(NPN)含量的测定 按照孙卫青[19]的方法处理后,用自动凯式定氮仪测定。
1.2.4.2 蛋白质羰基衍生物(CARB)的测定 参考Agnès等[20]、Mercier等[21]的方法做适当修改。量取500 mL肌原纤维蛋白溶液(9 mg/mL)在7 mL离心管中,离心(4 ℃,2000×g,10 min)取沉淀物,其中一份加入2 mL HCl,另一份加入2 mL 0.2%(w/v)的DNPH,在室温避光静置1 h,在此期间每隔10 min振荡一次,然后加入2 mL 10%沉淀羟基化蛋白反应物(TCA),离心(4 ℃,2000×g,10 min)取沉淀物,用2 mL乙醇和乙酸乙酯(1∶1,V/V)混合液洗沉淀,然后离心(4 ℃,2000×g,10 min)取沉淀,重复3次。加入2 mL 6 mol/L盐酸胍(20 mmol/L PBS,pH6.5),溶解沉淀,水浴(37 ℃,15 min),离心后取上清液,用盐酸胍溶液调零,HCl处理组(未加DNPH)为空白对照,在370 nm测定吸光值,结果以每毫克蛋白中羰基含量表示。
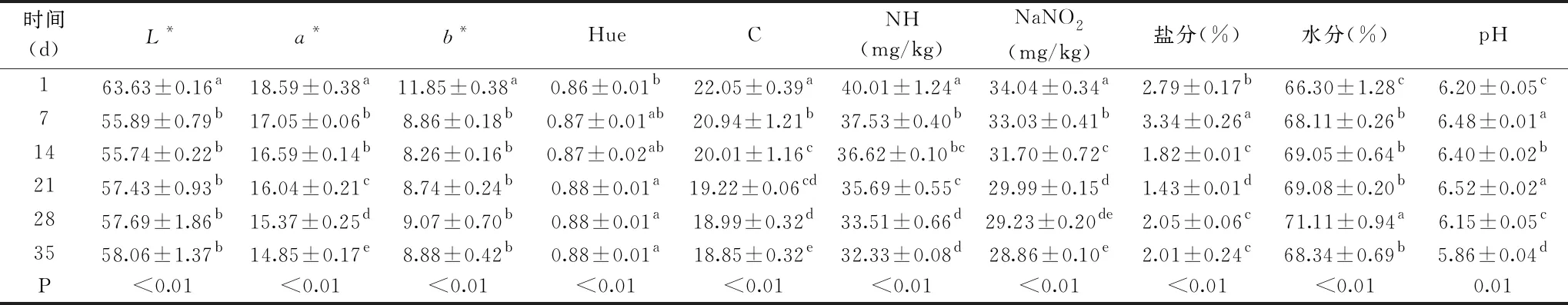
表1 猪肉切片冷藏期间色泽参数及其他品质指标的变化Table 1 Changes of color parameters and other quality indicators of pork slices during cold storage
蛋白羰基含量(nmol/mg prot)=(A×L/22000×L×C)×D
式(3)
式中:A为吸光值;C为蛋白质浓度,mg/L;L为光程,1 cm;D为稀释倍数;22000为蛋白质吸收系数,L/(mol·cm)。
1.2.4.3 游离巯基(SH)的测定 参考Agnès 等[20]的方法。准确称取碎肉样品10 g,加入含8 mol/L尿素的100 nmol/L PBS(pH为8)20 mL,冰浴匀浆4×10 s,静置30 min,然后离心(10000×g,10 min,4 ℃)取上清液,加入1 mL蛋白质溶液到10 μL的10 mmol/L DTNP(2,2′-二硫代双吡啶(2,2′-dithiobis)),在室温下反应1 h后在386 nm处测其吸光度,空白样用不含DTNP的同样浓度的蛋白质,减去稀释的DTNP的吸光度。
式(4)
式中:C为蛋白质浓度,mg/L;A为处吸光值;D为稀释倍数;ε为摩尔消光系数,13600 L(mol·cm);L为光程,1 cm。
1.2.4.4 脂肪氧化形成的羰基值(FCARB)和双烯值(DV)的测定 脂质的提取参考Folch等[22]的方法。取样品8 g剪碎,然后加入甲烷-甲醇混合物(2∶1,V/V)溶液,在冰浴的条件下匀浆(4000 r/min,60 s),静置后过滤,按照1∶0.22加入NaCl(0.73%)和CaCl2(0.04%)混合溶液(W/V),离心(3000 r/min,5 min,4 ℃),除去上层及膜状杂质后将下层液体放入烧瓶中,在旋转蒸发仪上抽真空(40 r/min),同时45 ℃水浴,得到纯品油脂。用环己烷溶解得到的油脂,稀释到200 μg/mL,并在215、232、275 nm处测定其吸光度。环己烷作为空白对照组。
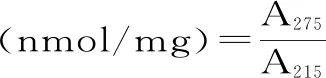
式(5)
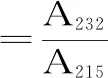
式(6)
1.2.4.5 抑制羟自由基能力(IC·OH)的测定 采用IC·OH试剂盒(南京建成生物工程研究所提供)测定。
1.3 数据处理
结果表示为均值±标准偏差;利用SPSS 19.0软件对样品西式蒸煮火腿切片测得的理化指标,生物胺指标和游离氨基酸指标进行主成分分析(PCA)。
2 结果与讨论
2.1 猪肉切片冷藏期间色泽参数变化
从表1可知,猪肉切片在冷藏期间在第1~7 d除了Hue外,其他品质指标均发生显著性变化(P<0.05),其中L*、b*和Hue在第7~35 d期间无显著性变化。a*、C和NH随着贮藏时间增加而显著性降低,b*和Hue的变化无稳定规律,通常情况下肉类在贮藏过程中Hue会因b*的无规律变化而无法得到稳定变化趋势[23];在冷藏期间水分在第7~21 d贮藏期间无显著性变化,在第28~35 d显著性降低,可能是样品水样在储藏期间有一个重新平衡的过程,初期肉样吸收周围的水分,含量升高,中后期肉样发生部分脱水,水分降低[24]。NaNO2和NH在冷藏期间显著性降低,亚硝酸钠与肉中的乳酸反应生成亚硝酸,亚硝酸不稳定分解成亚硝基,亚硝基进一步生成亚硝基肌红蛋白和亚硝基血红蛋白[25-26]。pH在贮藏期间变化显著变化,但是变化趋势不稳定,后期快速降低可能与样品中微生物菌相有关[13]。
2.2 猪肉切片冷藏期间生物胺和游离氨基酸的变化
食品中微生物的活动产生的脱羧酶催化氨基酸脱羧产生生物胺,不同的食品和微生物的存在状态也会造成不同胺的产生量的不同[27],因此,有些学者将生物胺作为判断食品腐败的指标[28]。从表2中可以看出,8种生物胺和游离氨基酸在冷藏期间,色胺(TRY)、苯乙胺(PHE)、尸胺(CAD)和游离氨基酸总和(∑FAA)整体上无显著性变化(P<0.05),本实验中1~28 d未检测出组胺,在35 d检测出组胺,可能是前期组胺含量较低,未检测出。第1 d时,在生物胺中,精胺(SPM)的含量最高,其次是苯乙胺(PHE)、色胺(TRY)、组胺(HIS)和腐胺(PUT),此外还含有少量的尸胺(CAD)、酪胺(TYR)和亚精胺(SPD)。有研究报道称在鲜肉中精胺和色胺本身的含量比较高[29-30]。但是本实验中苯乙胺在1~7 d含量比色胺还高,可能是真空包装肉制品中的优势菌为乳酸菌[31],因为多数弯曲乳杆菌会产生β-苯乙胺[32]。食品中生物胺的含量受多种因素影响,如体系中可利用游离氨基酸浓度、微生物脱羧酶的活性、pH、离子强度以及加工贮藏条件[33],这可能是本实验与其他研究报道存在差异的主要原因。
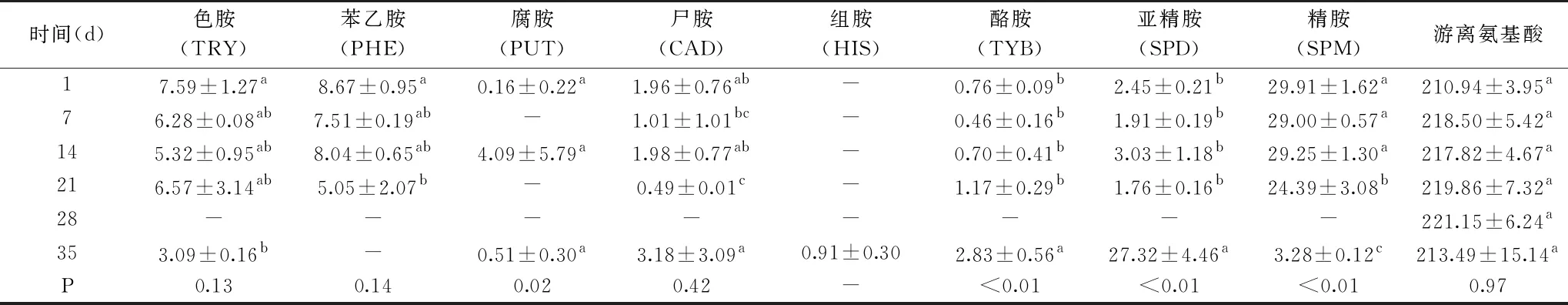
表2 猪肉切片冷藏期间生物胺和游离氨基酸的变化(mg/kg)Table 2 Changes of biogenic amines and free amino acids during cold storage of pork slices(mg/kg)
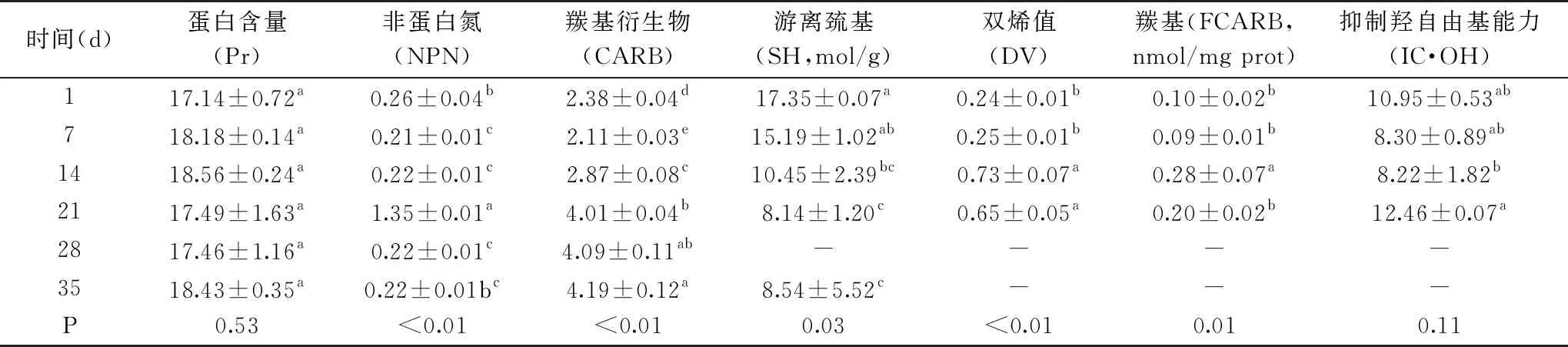
表3 猪肉切片冷藏期间蛋白质和脂肪氧化的变化Table 3 Changes of protein and fat oxidation during pork storage
2.3 猪肉切片冷藏期间蛋白质和脂肪氧化的变化
从表3中可以看出,在蛋白质和脂肪氧化中,除了Pr和IC·OH无显著性变化外,其他的都有显著性变化(P<0.05)。CARB和DV在储藏期间增加,肌细胞蛋白很容易受到氧化,主要由脂质的过氧化产生的活性氧和自由基攻击或由金属或酶催化反应引发,从而导致蛋白功能性质和肉品品质的变化。SH在冷藏期间减少,SH具有较强的还原力,在冷藏期间脂质和蛋白的氧化,体系的氧化力增加,SH含量降低[34]。其中DV和FCARB在冷藏期间的变化趋势都是第1~14 d增加,在14~21 d减少。
2.4 猪肉切片冷藏期间色泽与氮的存在形式和氧化状态的因子分析
利用SPSS 19.0软件对自制的猪肉切片冷藏期间的色泽和一些理化指标、生物胺的含量和16种游离氨基酸之和进行主成分分析(PCA)。将这些指标进行主成分分析后,得到3个公共因子如表4,因子1和因子2对样本的方差累计贡献率达到87.343%,可以反映所有因素包含的信息,因此下面对因子1和因子2进行分析。
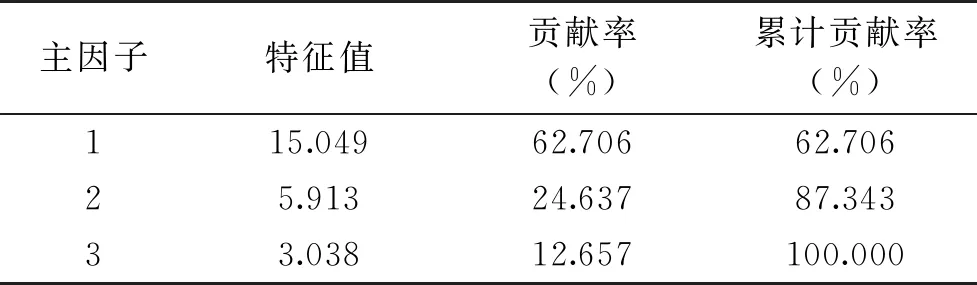
表4 因子分析提取主成分解释的总方差Table 4 Factor analysis extracts the total variance of principal component interpretation
从表5可以看出,因子1(F1)中,与色泽相关的因子红度a*、色调Hue、色饱和度C、亚硝基血色原NH、亚硝酸钠、水分、巯基SH和游离氨基酸总和∑FAA的系数绝对值都在0.90以上,其次是黄度b*、pH和共轭二烯值DV的系数绝对值也比较高,分别为0.886、-0.872和-0.825。鲜肉及肉制品色泽受许多因素影响,如肉的pH、色素含量、氧化还原潜力、腌制剂的扩散、温度、水分等[35]。亚硝酸盐反应生成的NO与肌肉中的肌红蛋白反应有关,这一反应也与肌肉色泽有关[27]。由此可以发现因子1(F1)与色泽内环境和氮的存在形式有密切关系。因子2(F2)主要由蛋白含量(Pr)、抑制羟基自由基能力(IC·OH)和酪胺(TYR)这3个指标所决定的,这3个指标的旋转成分矩阵值都在0.8以上,其中蛋白含量(Pr)和抑制羟基自由基能力(IC·OH)同猪肉切片的氧化状态有关。F2与猪肉切片的氧化状态有关。
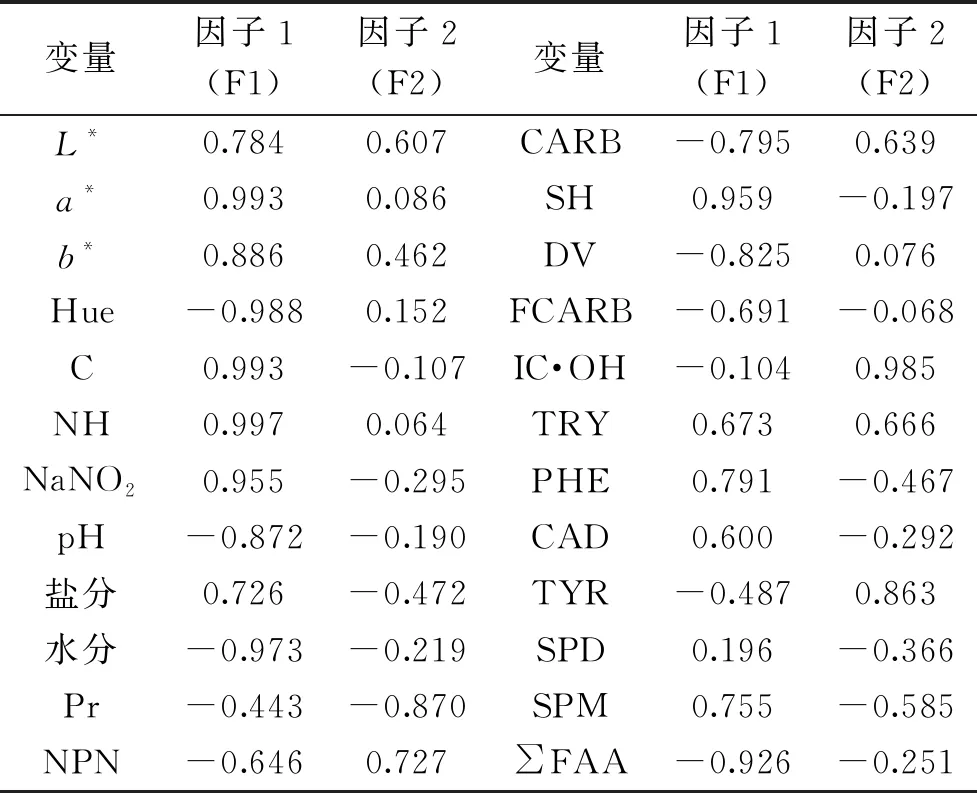
表5 旋转成份矩阵Table 5 Rotation component matrix
从图1中可以看出,生物胺和游离氨基酸之和在因子1(F1)和因子(F2)平面散点图上面的分布比较分散,说明猪肉切片各类含氮化合物之间可能有关联,但不是直接相关。NH、红度a*、黄度b*、亮度L、色饱和度C和亚硝酸钠NaNO2在因子1(F1)的右边,游离氨基酸总和ΣFAA、pH、水分和色调Hue在因子1(F1)的左边,并且红度a*和这些都与因子1(F1)有密切的关联,说明因子1(F1)代表了猪肉切片的色泽内环境,并且红度a*和游离氨基酸总和ΣFAA在F1上面的位置相对,说明游离氨基酸总和ΣFAA 直接影响到了猪肉切片储藏期间的红度,可能是游离氨基酸总和ΣFAA或者个别游离氨基酸通过影响环境体系的酸碱度,或者通过影响亮度L*和黄度b*,间接影响表观红[13],而且红度a*和NH两个因素之间的相对距离最近,说明NH的变化直接影响到产品表观红度,因为亚硝基血色原体是非常稳定的鲜红色[6],这与表1表达的信息是一致的。在因子2(F2)中非蛋白氮(NPN)、抑制羟自由基能力(IC·OH)、蛋白含量(Pr)、和色胺(TYR)上系数绝对值比较大,并且抑制羟自由基能力(IC·OH)和蛋白含量(Pr)呈极显著负相关,可能是在自由基氧化的攻击下,蛋白质的三级结构会发生变化,导致疏水集团暴露,表面疏水性增加,从而蛋白质-水分子的作用力减少,此外,蛋白质交联形成的聚合物也会削弱蛋白与溶剂相互作用综合可以看出F(2)反映出蛋白质的氧化情况,羟自由基普遍存在肉制品储藏过程中,并且会进一步影响蛋白的氧化。
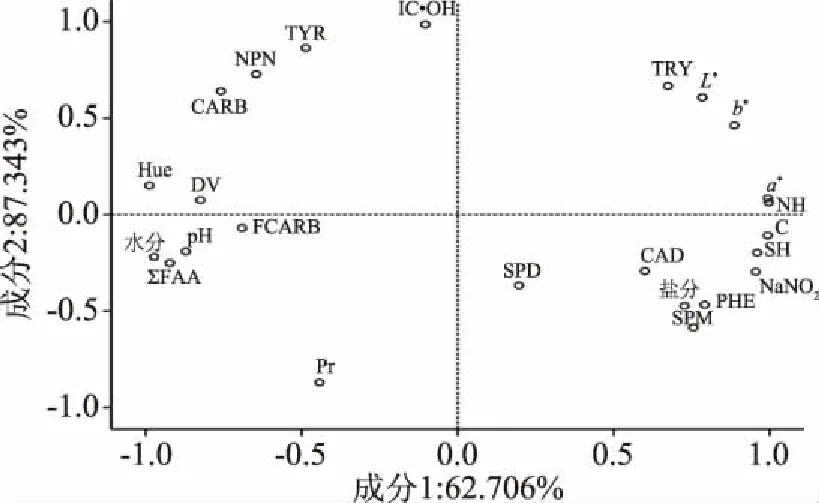
图1 旋转空间中的成分图Fig.1 Composition diagram in the rotating space
3 结论
腌制蒸煮猪肉切片在冷藏期间褪色显著,亮度L*、红度a*、黄度b*、色调Hue、色饱和度C和亚硝基血色原NH均发生了显著性变化,生物胺中酪胺(TYR)、亚精胺(SPD)和精胺(SPM)发生显著性变化,游离氨基酸之和在冷藏期间无显著性变化;非蛋白氮(NPN)、羰基(CARB)和共轭二烯值(DV)发生显著性变化,冷藏期间腌制蒸煮猪肉切片的蛋白质和脂肪受到较大影响。通过因子分析,可以发现,色泽内环境和氮的存在形式有相关性。其中游离氨基酸之和只跟色调Hue正相关,与其他色泽指标呈显著负相关;生物胺中,除了色胺(TRY)与亮度L*呈显著负相关外,其他生物胺与色泽无显著相关。
