新型冠状病毒肺炎影像学辅助诊断指南
2020-04-02中国研究型医院学会感染与炎症放射学专业委员会中国性病艾滋病防治协会感染传染病影像工作委员会中华医学会放射学分会传染病学组中国医师协会放射医师分会感染影像专业委员会中国医院协会传染病分会传染病影像学组中国装备协会普通放射装备专业委员会传染病学组北京影像诊疗技术创新联盟
中国研究型医院学会感染与炎症放射学专业委员会,中国性病艾滋病防治协会感染(传染病)影像工作委员会,中华医学会放射学分会传染病学组,中国医师协会放射医师分会感染影像专业委员会,中国医院协会传染病分会传染病影像学组,中国装备协会普通放射装备专业委员会传染病学组,北京影像诊疗技术创新联盟
自2019年12月以来,湖北省武汉市陆续发现多例不明原因的肺炎病例[1]。呼吸道标本测序显示感染源是一种新型冠状病毒[2],国际病毒分类委员会(International Committee for Taxonomy of Virus, ICTV)将其命名为严重急性呼吸综合征冠状病毒-2(SARS-CoV-2),可引起与急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus, SARS-CoV)和中东呼吸综合征冠状病毒(middle east respiratory syndrome coronavirus, MERS-CoV)类似的严重呼吸系统疾病,并将后者命名为新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)。胸部高分辨率CT(high resolution CT, HRCT)为目前筛查与诊断COVID-19的主要手段之一,所见具有一定特异性和规律性,可为诊疗过程提供重要循证依据。本指南是在《新型冠状病毒肺炎影像学诊断指南》中文及英文版第一版基础上,结合实际病例详细分析实践及研究成果,基于临床分期提出的影像学检查及诊断COVID-19的指南,对于进一步提高临床诊断COVID-19能力具有重要意义。
1 临床诊断COVID-19
1.1 适用范围 本指南适用于全国不同级别医疗机构,为影像学检查及诊断COVID-19提供参考。
1.2 术语 2020年1月12日WHO将造成本次武汉疫情的新型冠状病毒命名为2019新型冠状病毒(2019-novel coronavirus, 2019-nCoV)。2020年2月8日,国务院应对新型冠状病毒肺炎疫情联防联控机制决定将新型冠状病毒感染所致肺炎暂命名为“新型冠状病毒肺炎”(简称“新冠肺炎”),英文名称“novel coronavirus pneumonia(NCP)”。2020年2月11日,WHO宣布将新型冠状病毒感染所致疾病命名为COVID-19,同时,国际病毒分类委员会宣布将新型冠状病毒命名为SARS-CoV-2。2020年2月22日,国家卫生健康委员会宣布,新型冠状病毒肺炎英文名称采用WHO名称“COVID-19”。
1.3 定义 COVID-19是由2019-nCoV引起的以肺部炎症性病变为主的急性传染病,也可引起消化系统[3]、神经系统等损害,并出现相应症状[4]。
冠状病毒为RNA病毒,根据血清型和基因组特点分为α、β、γ和δ四个属, 2019-nCoV为β属[5]。病毒溯源可能为中华菊头蝠,传播途径和宿主目前尚未最后确定,但最新研究显示存在动物传人及人传人。飞沫和接触传播是其主要传染途径;在相对封闭环境中长时间暴露于高浓度气溶胶时,存在经气溶胶传播的可能。
2019-nCoV与SARS病毒相似,通过2019-nCoV外壳刺状突起(S-蛋白)与肺泡Ⅱ型上皮细胞的血管紧张素转换酶2(angiotensin converting enzyme 2, ACE2)结合侵犯细支气管黏膜,引起细支气管炎及肺泡周围炎而损伤肺组织[6]。其病理表现亦与SARS[7]非常相似,均为局限性或弥漫性急性肺泡炎和间质炎,早期肺泡壁血管扩张、充血,间质内可见淋巴细胞浸润;肺泡腔内可见液体渗出,肺泡上皮细胞增生、肿胀或变性、坏死甚至脱落,单核细胞或多核巨细胞、淋巴细胞及浆细胞渗出,或有纤维素渗出,严重者发展为肺实变,有时可见肺泡腔内透明膜形成。肺泡上皮细胞胞浆或核内未见病毒包涵体形成,多抗体染色胞浆阳性(+++),呈细颗粒状。
1.4 诊断依据[1]
1.4.1 流行病学史 ①发病前14天内有武汉市及周边地区,或其他有病例报告社区旅行史或居住史;②发病前14天内有与2019-nCoV感染者(核酸检测阳性者)接触史;③发病前14天内曾接触来自武汉市及周边地区,或来自有病例报告社区的发热或有呼吸道症状的患者;④聚集性发病。
1.4.2 临床表现 基于目前流行病学调查,本病潜伏期为1~14天(或更长),多数为3~7天。发病后以发热、乏力、干咳为主要表现,少数患者伴有鼻塞、流涕、咽痛、肌肉疼痛和腹泻等症状;重症患者多在发病1周后出现呼吸困难和/或低氧血症,危重患者快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒、出凝血功能障碍及多器官功能衰竭等。需要注意的是,临床重症、危重症患者可为中、低热,甚至无明显发热;轻型患者仅表现为低热、轻微乏力等,可无肺炎临床及影像学表现。目前老年和有慢性基础疾病患者预后较差,儿童病例症状相对较轻。
国卫办医函〔2020〕145号通知《新型冠状病毒感染的肺炎诊疗方案(试行第六版)》分型如下:
轻型:临床症状轻微,影像学未见肺炎表现。
普通型:具有发热、呼吸道等症状,影像学可见肺炎表现。
重型:符合下列任何一项:①呼吸频率(respiratory rate, RR)≥30次/分;②静息状态下指氧饱和度≤93%;③动脉血氧分压(PaO2)/吸氧浓度(FiO2)≤300 mmHg。
高海拔(海拔超过1 000 m)地区应根据以下公式对PaO2/FiO2进行校正:PaO2/FiO2×[大气压(mmHg)/760]。
肺部影像学检查显示24~48 h病灶明显进展>50%时,按重型管理。
危重型:符合以下情况之一者:①呼吸衰竭,且需要机械通气;②休克;③合并其他器官功能衰竭,需ICU监护治疗。
1.4.3 影像学表现 数字X线摄影术(digital radiography, DR)分辨率低,不易发现早期病变,且鉴别诊断价值有限,首次检查疑似病例时不推荐使用。推荐DR用于危重症患者及确诊病例的随访和复查。
胸部HRCT为当前筛查COVID-19的首选影像学手段。根据肺部影像学表现,COVID-19可分为4期[8]:①早期胸部表现往往不典型,病变呈淡薄斑片状磨玻璃密度影(ground glass opacity, GGO),多局限性、散在分布于两中下肺野,主要见于胸膜下。②进展期病灶多发,表现为GGO渗出、融合或伴有实变,以双肺野中外带分布多见,可伴少量胸腔积液。③重症期(危重症)相当于疾病晚期,双肺密度弥漫性、广泛性进一步增高,称为“白肺”。此期病灶发展迅速,48 h可增加50%以上,治疗困难,患者死亡率较高。④转归期,病灶缩小或吸收,部分病例可见肺间质纤维化改变。
各期COVID-19共同特点包括双侧、多发病变,以GGO多见,可伴有实变、支气管充气征和小叶间隔增厚;也可呈“铺路石征”,常见支气管充气征及血管穿行。急性期病变密度相对均匀,吸收期多见不均匀致密影,罕有胸腔积液及淋巴结肿大[9]。
早期轻症病例可有絮状阴影或微小GGO(图1)。进展期病灶数量增多,范围扩大,实变区可见“充气支气管征”(图2)。重症期(危重症期)病灶和范围进一步增大,双肺多发实变,呈“白肺”改变(图3)。部分转归期病例可见肺间质纤维化条索影(图4)。
1.4.4 实验室检查 ①发病早期白细胞总数正常或减少,淋巴细胞计数减少,部分患者肝酶、乳酸脱氢酶(lactate dehydrogenase, LDH)、肌酶和肌红蛋白增高;部分危重者可见肌钙蛋白增高。多数患者C反应蛋白和血细胞沉降率升高,降钙素原正常;严重者D-二聚体升高,外周血淋巴细胞进行性减少等。重型、危重型患者常有炎症因子升高。②2019-nCoV核酸检测阳性。

图1 COVID-19早期肺部CT表现 右肺下叶外基底段GGO病灶 图2 COVID-19进展期肺CT表现 双肺上叶见多发大片GGO病灶,部分伴有实变 图3 COVID-19重症期/危重症期肺部CT表现 A.双肺弥漫分布实变病灶; B.双肺多发实变病灶,呈“白肺” 图4 COVID-19转归期肺部CT表现 A.两肺病变较前吸收; B.残存少量纤维条索状,以右肺稍著
③病毒基因测序与已知新型冠状病毒高度同源。
1.4.5 诊断标准
1.4.5.1 疑似病例 有流行病学史中的任何一项,且符合下述临床表现中任意2项;或无明确流行病学史,符合下列临床表现中的3项:①发热和/或呼吸道症状;②具有上述COVID-19影像学特征;③发病早期白细胞总数正常或降低,淋巴细胞计数减少。
1.4.5.2 确诊病例 疑似病例+实验室检查病毒核酸阳性或病毒基因测序阳性。
2 推荐影像学检查方法
规范胸部CT及X线检查是筛查、早期诊断COVID-19和疗效评价的有效保障,能为临床提供高质量影像学资料,有利于指导诊疗,避免因反复检查导致的院内交叉感染。
《新型冠状病毒肺炎影像学诊断指南(2020第一版)》建议有条件的医疗机构首选胸部多层螺旋CT平扫(证据级别:Ⅱ;推荐强度:强)对COVID-19患者进行检查。胸部HRCT扫描和薄层重建更有利于显示早期病变,对COVID-19核酸检测阴性或缺失患者更有价值,影像学表现可作为重要临床评价指标。
2.1 胸部X线检查 对重症期患者可采用床旁X线摄影(移动DR)进行检查、随访,方便快捷,但检出病变的敏感度及特异度均较低,易漏诊。普通 X线检查仅适用于基层医院(无CT设备)及危重型患者复查(推荐强度:弱),不推荐以之作为首诊影像学检查。
2.2 胸部CT检查 胸部CT是呼吸系统疾病最常用也最重要的影像学检查手段。对疑似COVID-19患者或病毒核酸阴性者首选胸部CT平扫。对普通患者推荐使用,对重症期患者在条件允许情况下也推荐使用(证据级别:Ⅱ;推荐强度:强)。胸部HRCT及薄层重建技术显示早期GGO尤佳,推荐重建层厚≤1.0 mm,采用多平面重建。低剂量CT可用于已确诊COVID-19患者随访复查。推荐以低剂量CT作为聚集性发病疑似患者的筛查手段。
3 影像学表现
不同分期COVID-19影像学表现有所重叠。重症期(危重症)影像学表现相对特异[2,10-17]。
3.1 早期影像学表现[13-17]多见于COVID-19发病1周内。双肺单发或多发病灶,多位于肺外周或胸膜下,以中下肺背段或外侧段多见。多为胸膜下小叶性、尖端指向肺门方向的楔形或扇形病灶(图5),也可表现为斑片状或类圆形。早期多为浅淡GGO,亦可见网格状影,随病变进展,GGO密度逐渐增高,其内可见支气管血管束增粗或伴局部小叶间隔网格状增厚。如果早期CT仅表现为局部胸膜下GGO,胸片往往难以显示,易漏诊。
3.2 进展期影像学表现[14-17]随病变进展,GGO范围逐渐扩大,密度逐渐增高(图6),或融合成小叶性,或广泛融合呈带状或大片状密度增高影,其内支气管壁增厚,支气管血管束增粗,可见局部树芽征,亦可见网格状影。病变呈双侧非对称性胸膜下楔形或扇形分布,肺底及背侧胸膜下区多见,部分沿支气管血管束分布。肺泡内渗出液增多时GGO密度增高,实变时可表现为软组织密度影或致密条索影,呈节段性或小叶性分布。无基础性疾病患者多无胸腔积液、纵隔及肺门淋巴结增大。
3.3 重症期影像学表现[2,6,18-20]合并基础性疾病及肥胖者相对高发,病情往往在数日内迅速进展,出现呼吸窘迫、低氧血症变为重症,或出现呼吸衰竭、休克或合并其他器官衰竭变为危重症,甚至死亡。胸部影像学表现多为双肺弥漫性病变,少数呈“白肺”表现;病变多以实变为主,合并GGO,可见充气支气管征(图7)及多发条索影。48 h内病灶范围可增加50%,可伴双侧胸腔少量积液。
3.4 转归期影像学表现[13-17]转归期患者体温下降,咳嗽次数减少,肺功能明显改善。影像学表现为病变范围缩小,密度减低,渗出物吸收,肺实变病灶逐渐吸收消散,可完全消失,或残存肺纤维条索影(图8)。肺部影像学改变往往滞后于临床症状。此期部分患者可出现病情反复,病灶增多、增大甚至出现新发病灶。

图5 患者男,61岁,发热2天,COVID-19早期CT表现,左下肺扇形淡薄GGO 图6 患者男,57岁,发热2天,COVID-19进展期 CT表现 A.CT示左肺下叶胸膜下及右叶间裂附近多发团、片状GGO; B.4天后复查CT,左肺下叶病变范围略增大,内部密度增高,提示病变进展

图7 患者女,57岁,发病第8天, COVID-19 重症期CT表现 双肺大片GGO,部分实变,其内可见充气支气管征 A.轴位; B.冠状位; C.矢状位
3.5 特殊人群的影像学表现 婴幼儿、儿童和青少年、孕妇、老人及合并基础疾病者影像学表现有其自身特点[18-22]。
3.5.1 婴幼儿患者
3.5.1.1 临床特征 目前婴幼儿COVID-19发病较少,且以轻型及普通型为主,重症及危重症少见[1]。
3.5.1.2 影像学表现 胸部X线表现:①早期胸部平片可为阴性(图9A),或表现为支气管炎或细支气管炎,漏诊率高;②进展期可表现为肺野局限性片状或团块状影,以外带为主,无特异性;③重症期(危重症)表现为双肺多发弥漫性实变阴影,甚至出现“白肺”,伴或不伴单侧胸腔积液[1,23];④转归期病变范围较前缩小吸收,残留纤维条索。
胸部CT表现:建议根据机型减低剂量或行低剂量CT扫描,并尽可能减少复查次数。①早期:肺单发或多发胸膜下以小叶为中心斑片影或GGO(图9B),中央肺小血管增粗、增多;纹理可呈网格状(“铺路石征”);沿支气管束或背侧、肺底胸膜下分布为主,可见充气支气管征象;②进展期:新旧GGO范围增大,并出现实变,多沿支气管束走向,合并或不合并肺小叶间隔增厚,胸腔积液少见[21-22];③重症期(危重症):双肺多发GGO,弥漫性多发大片实变,合并肺小叶间隔及叶间隔胸膜增厚,伴或不伴一侧胸腔积液;④转归期:

图8 患者男,37岁,COVID-19转归期CT表现 A、B.发热第6天,CT示左肺上叶纵隔胸膜旁片状淡薄GGO(A),左肺下叶跨肺亚段、胸膜下跨肺亚段扇形高密度影,尖端指向肺门(B);C、D.入院治疗后2天复查,左上肺病变密度变淡、体积缩小(C),左下肺病变大部分吸收,残余少量纤维条索影(D) 图9 患儿男,1岁1个月,轻型COVID-19 10 h前无明显诱因出现发热,体温39℃,伴流涕,有明确COVID-19患者接触史,2019-nCoV核酸阳性 A.胸片未见明显异常; B.CT示右肺下叶微小GGO
病变范围缩小、吸收,或仅残留纤维条索影。
3.5.2 儿童和青少年患者
3.5.2.1 临床特征 COVID-19具有普遍易感性,儿童及青少年如有流行病学史,出现发热、咳嗽、少痰、肌肉酸痛等症状时需考虑本病。青少年多为轻型及普通型患者,重型和危重型少见。
3.5.2.2 影像学表现 胸部X线表现:①早期可无明显异常或双肺纹理增粗、模糊,肺野透亮度降低[23-24];②进展期肺内出现斑片影,多位于肺外带,内见网格状影,常累及双肺,亦可单侧;③重症期(危重症)双肺多发斑片状实变阴影,内可见充气支气管征,甚至呈“白肺”,心影显示不清;少见胸腔积液;④转归期病变范围缩小,边界变清晰,密度趋于浅淡,可见条索状纤维影。
胸部CT表现:①早期HRCT显示较佳,支气管血管束增粗、模糊;肺内片状GGO(图10)边界欠清晰,其内可见细网格影;病灶常多发,亦可单发,多位于肺野外带(如胸膜下);少见纵隔和肺门淋巴结肿大及胸腔积液;②进展期肺内GGO伴实变,边界模糊不清,甚至多个病灶融合呈大片状,内可见充气支气管征,病灶体积增大、数量增多,少见纵隔和肺门淋巴结肿大及胸腔积液;③重症期(危重症)双肺多发斑片状实变,周边可见GGO,实变中可见充气支气管征,可累及双肺,胸腔积液少见[23];④转归期肺部实变吸收消散,密度趋于浅淡,边缘收缩内凹,边界清晰,部分残留纤维条索状影。
轻型COVID-19患儿影像学表现可为阴性。青少年与成人患者影像学表现基本一致。
3.5.3 妊娠期患者
3.5.3.1 临床特征 妊娠期、尤其是妊娠中晚期妇女对病毒性呼吸系统感染的炎症应激反应性明显增高,病情进展快,易演变为重症[23-25]。
3.5.3.2 胸部CT表现 ①早期:肺外带或胸膜下出现结节状及小斑片状GGO,边界尚清晰,可见肺血管增粗及细网格影(图11A);②进展期:病灶较早期明显增多,密度增高,呈实变,其内网格影较前更加明显,病灶边界欠清晰,部分病灶可融合呈大片状实变,内可见充气支气管征(图11B);③重症期(危重症):病变范围进一步扩大,可累及双肺,呈大片状多发实变,边界尚清晰,内可见充气支气管征,少见胸腔积液和纵隔淋巴结肿大;④转归期:病变趋于好转时,GGO及实变逐渐吸收,密度变淡,边缘收缩凹陷,常不同程度残留纤维条索影。
3.5.4 老年患者
3.5.4.1 临床特征 老年患者感染后病情进展快,病情重,死亡率高,截止目前死亡病例超过80%为60岁以上老年人,轻型少见。
3.5.4.2 影像学表现 胸部X线表现:①早期双肺多无明显异常改变,或仅表现为双肺纹理增多、模糊,或肺野外带局限性斑片影;②进展期可于短期(1~3天)内表现为双肺纹理增多、增粗紊乱,肺野单发或多发斑片状密度增高影,以双下肺野中外带常见;③重症期(危重症)双肺病灶明显增多,多发斑片状及大片实变阴影,或双肺透亮度减低,弥漫性多发实变阴影;④转归期病变范围缩小,残留纤维条索影。
胸部CT表现:①早期双肺或单侧肺斑片状GGO(图12A)或小结节影,或较淡GGO背景下见局部细小网格,病灶多位于肺外周胸膜下[17];②进展期病灶进展及变化迅速(1~3天),双肺病变范围增大,累及多个肺叶,由双肺周围向中央进展,GGO密度增高(图12B),部分内见充气支气管征及增粗的血管影,小叶间隔增厚明显,肺内实变明显增多,可伴纤维条索影,结节周围可出现“晕征”,新发病变以双肺中、下叶胸膜下分布为主,通常无胸腔积液;③重症期(危重症)48 h内病灶范围增加超过50%,双肺广泛或弥漫实变为主,内见充气支气管征,少数可呈“白肺”表现,少数伴单侧或双侧少量胸腔积液;④转归期双肺病变逐渐吸收,病灶范围缩小,可见残留纤维条索影,少数可见细支气管扩张[2]。

图10 患儿男,4岁,COVID-19 发热、咳嗽5天,有明确COVID-19患者接触史。白细胞5.30×109/L,2019-nCoV核酸阳性。CT示右肺下叶多发GGO,左肺下叶条片影 图11 患者女,26岁,孕29周,COVID-19,发热,最高体温38.5℃,2019-nCoV核酸阳性 A.早期CT见胸膜下出现结节状及小斑片状GGO,边界尚清晰,双下肺肺血管增粗,并见细网格影; B.进展期病灶明显增多,密度增高呈实变,其内网格影较前更加明显,病灶边界欠清晰,实变中可见充气支气管征
图12患者男,62岁,COVID-19,CT表现 A.1天前无明显诱因出现发热,体温39.1℃,伴乏力及干咳,右肺上叶斑片状GGO,内见增粗血管影; B.5天后病灶明显增多,GGO密度增高,病灶主要分布肺外周胸膜下区,由双肺周围向中央进展图13患者男,73岁,COVID-19,糖尿病病史,白细胞正常 A.CT示双肺GGO,小叶间隔增厚,双肺下叶实变,左肺下叶纤维条索影; B.进展期病变范围进一步增大
3.5.5 合并基础疾病者
3.5.5.1 临床特征 伴有基础疾病的老年患者预后较差。伴有基础疾病的老年男性免疫力较低,感染后病情进展快,易引起严重或危重呼吸系统症状,如急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS),预后差,死亡率高[1,26-27]。70岁以上老年患者感染后平均生存时间缩短[27],临床以普通型、重型及危重型为多[1]。
3.5.5.2 影像学表现 原有基础疾病的影像学表现,如慢性阻塞性肺疾病、结核、恶性肿瘤等[2,26]。
胸部X线表现:①早期可为阴性或仅见基础疾病所致胸部影像学改变[12];②进展期病变可于短期(1~3天)内迅速进展,表现为双肺纹理增多、增粗紊乱,交织成网格状或蜂窝状,以双肺下叶为著[1,16];③重症期双肺弥漫间质性病变夹杂斑片状及片状密度增高影[1,5];④转归期病变范围缩小,残留纤维条索影。
胸部CT表现:①早期伴基础疾病者、特别是老年患者以间质病变为主,表现为网格影,部分为片状GGO,双肺下叶为著[23];②进展期双肺病变范围增大,由双肺周围向中央推进,可伴少量胸腔积液[12](图13A);③重症期(危重症)双肺弥漫性网格状小叶间隔增厚,常有散在斑片状及片状实变,实变内可见充气支气管征,伴单侧或双侧胸腔积液(图13B);④转归期双肺病变逐渐吸收[16],可见纤维条索影残留,部分细支气管受牵拉扩张[12]。
3.6 鉴别诊断
3.6.1 与其他病毒性肺炎鉴别 病毒性肺炎表现多以肺间质改变为主,伴肺泡壁水肿,CT表现为GGO、实变、小叶间隔增厚、网格状影、小叶中央结节、树芽征、空气潴留和纤维条索影等。各种病毒性肺炎的影像学表现类似,最终诊断需结合临床资料、流行病学及实验室结果,确诊依赖于病原学检测。
3.6.1.1 甲型流感病毒肺炎(H1N1) 单侧或双侧局灶或多发GGO,伴或不伴实变,沿支气管血管束分布或胸膜下分布[8,27]。COVID-19早期可表现为小GGO或小片状GGO内见增粗血管影,可能有助于鉴别,最终需借助病原学检测。
3.6.1.2 禽流感病毒肺炎(H7N9) 双肺GGO或伴实变,充气支气管征,早期可见病变同时发生于中心区及周围区,胸腔积液较常见,借此可在一定程度上与COVID-19相鉴别[32]。
3.6.1.3 重症急性呼吸综合征(SARS) 单侧或双侧GGO,局限性单侧或双侧实变,或二者兼有;或GGO伴小叶间隔增厚及“铺路石征”;少见空洞、钙化、网格或结节、淋巴结肿大和胸腔积液[8,27]。SARS与COVID-19致病病毒同属冠状病毒,两者致病机制和影像学表现高度相似,单纯影像学难以鉴别。
3.6.1.4 人副流感病毒肺炎 季节性呼吸道感染中常见。影像学表现多样,可为多发支气管周围小结节、GGO及含充气支气管实变[8,27],病变可呈中心性分布,与COVID-19特征性胸膜下分布有所不同。
3.6.1.5 腺病毒肺炎 常见于儿童,表现为双肺多灶性GGO伴斑片状实变,可出现肺叶多段性分布趋势,可致患儿肺不张。有时与细菌性肺炎难以鉴别[8,27]。
3.6.1.6 呼吸道合胞病毒肺炎 常发生于婴幼儿、先天缺陷者、免疫抑制者及慢性肺疾病者,以小叶中央结节为最具特征性表现,出现概率高达50%,据此可与COVID-19鉴别;另外肺中央区或周围区可见含气实变(35%)、GGO(30%)或支气管壁增厚(30%),呈双侧不对称分布[8,27]。
3.6.2 与病毒以外感染性肺炎鉴别
3.6.2.1 支原体肺炎 儿童和青少年常见,表现为小叶中心结节、GGO及实变等,可见支气管壁增厚、细支气管“树芽征”与肺门及纵隔淋巴结肿大[28]。实验室检查支原体抗体阳性。
3.6.2.2 细菌性肺炎 多无上呼吸道感染前驱症状,咳脓性痰、血性痰或铁锈色痰,实验室检查白细胞数增高;影像学多表现为性质单一的叶段或亚节段实变影,抗生素治疗效果好。
3.6.3 与肺部非感染性病变鉴别
3.6.3.1 隐源性机化性肺炎 典型表现为双侧胸膜下斑片状GGO或实变,内见支气管充气征,部分病变中可见中央GGO、边缘环形或新月形实变呈“反晕征”表现,可见游走性表现,少数有肺门、纵隔淋巴结肿大与胸腔积液等表现[29]。
3.6.3.2 急性嗜酸性粒细胞性肺炎 弥漫性GGO和微结节浸润(轻度病例病变呈散在、局限性分布),胸腔积液少见。外周血液或支气管肺泡冲洗液中,嗜酸性粒细胞显著增高[30]。
3.6.3.3 过敏性肺炎 双肺片状或弥漫GGO、边缘模糊的小叶中央结节、马赛克灌注及呼气相空气潴留,慢性期肺野显示细网格状影及支气管扩张。多为饲鸟者或有职业暴露史[31]。
3.6.3.4 血管炎 多发结节伴空洞、结节与肺血管相连(滋养血管征)、晕征或反晕征、多发实变、纤维条索影与GGO弥漫分布,胸膜下区少见,多在双肺中内带,为弥漫性肺泡出血,临床可表现为咯血,胸腔积液常见[32]。实验室检查胞浆型抗中性粒细胞胞浆抗体(cytoplasm anti-neutrophil cytoplasmic antibodies, cANCA)抗体阳性有助于诊断。
4 影像学检查在COVID-19诊治中的价值
《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》提出将胸部影像学检查发现肺炎特征作为湖北地区临床诊断COVID-19的标准。随后发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》取消了湖北省和湖北省以外其他省份的区别,统一分为“疑似病例”和“确诊病例”两类。
胸部影像学检查以CT为主、X线胸片为辅。文献[33]报道胸片漏诊率高达50%以上。CT、尤其是HRCT能早期发现肺部异常,特征性CT表现对临床诊断起到决定性作用,并可敏感评估治疗后病情变化,具有及时、便捷和高效的优点。
4.1 影像学疑似病例 临床疑似病例且影像学检查发现以下各项之一:①单发或多发胸膜下斑片状GGO[2],其内见增粗血管及增厚壁支气管影穿行,伴或不伴局部小叶间隔网格状增厚表现;②青壮年患者突发高热寒战、有双肺多发或弥漫GGO病灶,伴小叶间隔增厚或少许胸膜下实变,实变中可见充气支气管征[3];③突发高热患者双肺单发或多发大片或节段性实变,其中显示支气管充气征象;④体温>38℃且持续3天以上,双肺病灶呈现两种以上影像学特征改变,且肺内病灶新旧不一,如上叶胸膜下GGO、中下肺叶亚实性或实性病变、和/或中下叶网格状或索条状影,伴或不伴单侧或双侧胸腔积液;⑤老年患者患有多种基础性疾病,且机体状态较差,双肺弥漫性网格状间质改变,病灶分布多以双肺下叶明显。
4.2 影像学诊断病例 影像学疑似病例3~5天后复查CT发现以下各项之一:①原有单发或多发胸膜下斑片状GGO范围增大,并向肺野中央推进[4];②原有实变范围增大、伴或不伴周围GGO,和/或其他肺有新增GGO或实变;③原有GGO出现实变,和/或新出现实变、伴单侧或双侧胸腔积液;④原有实变范围增大、伴或不伴周围出现GGO;⑤原有局部网格状小叶间隔增厚明显,和/或其内出现厚壁支气管影[5];⑥原有肺部多态性病变任何一种范围扩大或数量增多,如双肺上叶GGO、中下肺叶或亚段实变、下叶纤维条索影,或出现单/双侧少量胸腔积液。
5 COVID-19诊断流程图(图14)
6 COVID-19影像学检查指南实施推广及更新计划
6.1 实施推广 评估指南实施推广中的有利因素和不利因素。
6.1.1 有利因素 ①随着循证医学思想在中国医疗界的普及深入,对高质量循证标准的客观需求日益凸显;②肺炎是患者就诊的最常见原因,严重影响其生活质量,甚至危及生命,并增加社会压力及经济负担,为扼制COVID-19蔓延,临床对具有可操作性的指南具有普遍需求。
6.1.2 不利因素 ①COVID-19属于新发传染病,对其认识有限,目前来自不同医疗机构的临床医师对第一版《新型冠状病毒肺炎影像学诊断指南》的重要性及推荐意见的理解存在差异,全面推广、宣传和实施本指南尚需时日;②一些单位尚未开展HRCT检查、呼吸道标本或血液标本实时荧光RT-PCR检测以及病毒基因测序等检查,可能对本指南的应用和推广造成一定影响。
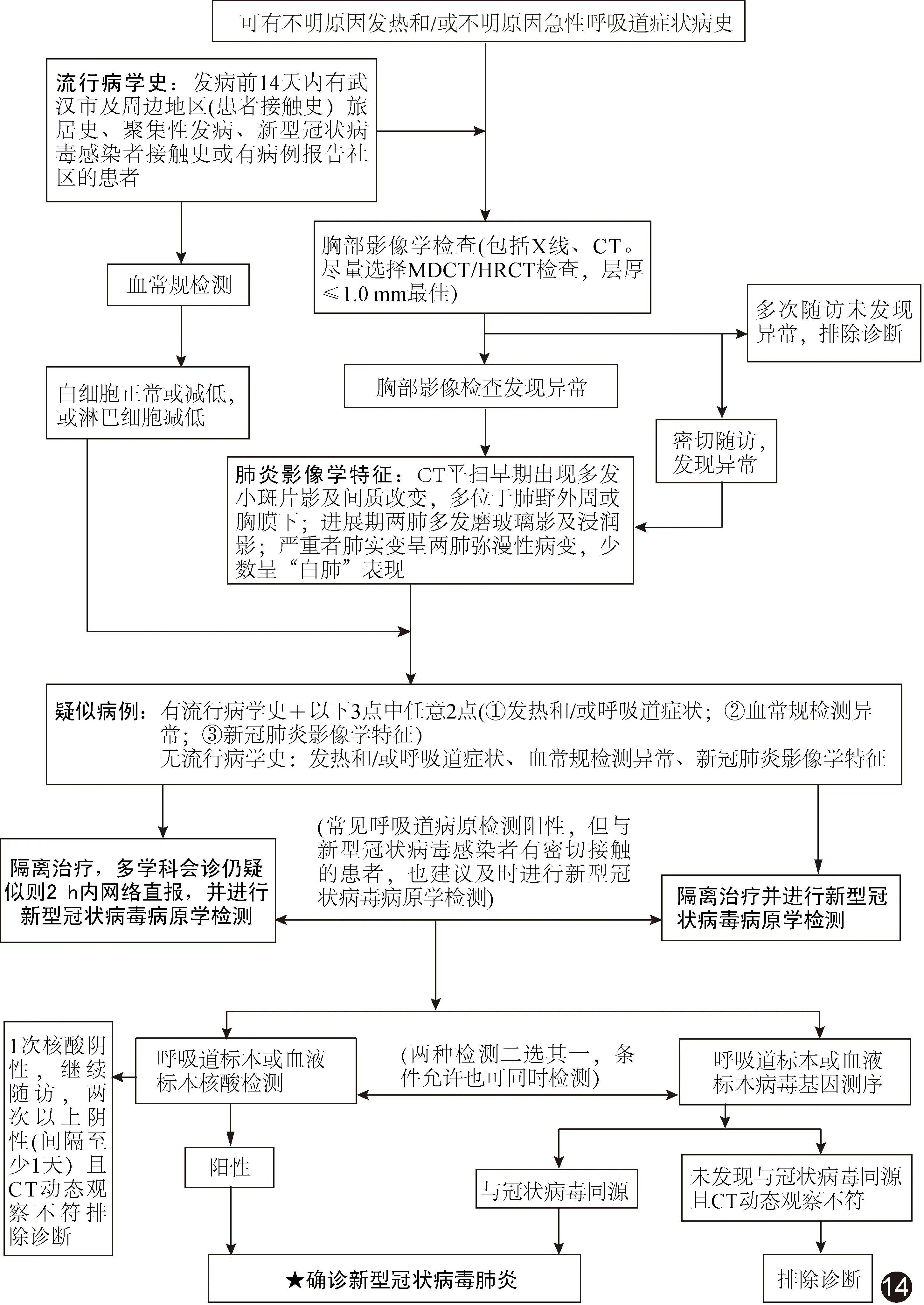
图14 COVID-19诊断流程图
6.2 更新计划 计划根据临床实践情况对本指南进行更新。
附录:诊断儿童和婴幼儿COVID-19指南补充
1 流行病学
参照《新型冠状病毒感染的肺炎诊疗方案(试行第六版)》[1],诊断儿童和婴幼儿COVID-19时,应重点关注是否有与患病家庭成员密切接触史,后者主要包括父亲、母亲和兄弟姐妹等,也有家庭成员并未确定为感染者的报道[2]。
2 临床表现
儿童和婴幼儿COVID-19临床表现多较轻微,包括发热、乏力、干咳、恶心、呕吐、咳嗽和打喷嚏等呼吸道感染症状[3]。有报道[4]患儿未发现呼吸道感染症状。
3 诊断标准
3.1 参照国家卫生健康委员会《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》相关标准。
3.2 疑似病例诊断标准中的流行病学建议强调患病儿童或婴幼儿与家庭内患病成员(父母及兄弟姐妹)有密切接触史,也有家庭聚集性感染的报道[4]。诊断疑似病例时,需要满足3项临床表现中的任意2项,而影像学是重要检查方法之一。出于射线防护考虑,推荐以X线胸片为首选检查手段。发现肺部有儿童特有的间质性肺炎改变时,应考虑此项诊断指标为阳性。X线胸片对诊断COVID-19敏感度不高。为明确诊断,必要时可采用低剂量CT检查[5]。
3.3 儿童和婴幼儿 COVID-19临床分型多为普通型,目前尚未见严重型和危重型的相关报道。
4 影像学表现及其临床意义
儿童COVID-19胸部X线平片可表现为肺纹理增多、增粗,肺纹理结构紊乱,部分扭曲,中外带为著。肺门周围支气管壁增厚,可见“袖口征”,肺门影无增大。肺野透亮度不均匀,膈面可不规则压低。以上X线表现可能与儿童其他常见病毒感染(例如呼吸道合胞病毒感染和支原体感染)类似。
《新型冠状病毒感染的肺炎诊疗方案(试行第四版)》中删除了之前版本所涉及的依赖影像学表现诊断进展临床重症型的内容,在解除隔离或出院标准中删除了肺部影像学检查提示病变明显吸收的内容。对于儿童和婴幼儿患者,目前尚无足够证据表明影像学表现对于判断可否解除隔离或出院的价值。
根据《新型冠状病毒感染的肺炎诊疗方案(试行第六版)》,发现与COVID-19患者存在流行病学关联时,即便常见呼吸道病原检测阳性,也建议及时进行2019-nCoV病原学检测。儿童社区性肺炎的常见病原体包括呼吸道合胞病毒、腺病毒、支原体及肺炎链球菌等[5]。儿童常见病毒感染可出现小叶性肺炎或间质性肺炎;支原体肺炎也可表现为间质性肺炎或其他类型肺炎。儿童社区性肺炎可由混合病原体感染所致,年龄越小,越易发生混合感染。如有明确流行病学病史,即使临床和影像学表现存疑,或实验室检查已确定存在其他病原菌感染,也不能完全排除COVID-19混合感染的可能。
