阿那白滞素在治疗大鼠前节内眼模拟手术诱发的血-视网膜屏障破坏中的作用△
2020-03-25郑永征谢茂松刘光辉潘铭东
郑永征 谢茂松 刘光辉 潘铭东
囊样黄斑水肿(cystoid macular edema,CME)可发生于各种内眼手术后,如白内障手术[1-3]、小梁切除术[4]和角膜移植手术[5]。术后CME是由血-视网膜屏障(blood-retinal barrier,BRB)破坏引起的[6]。目前,术后CME的发病机制尚未完全清楚,多数研究者认为炎症是其发病的主要原因[7-9]。炎症假说推测炎症因子可在房水中积聚并破坏血-房水屏障(BAB)。炎症因子可直接扩散到玻璃体内并破坏BRB,导致视网膜水肿[3,7-8]。
由于缺乏理想的动物模型,术后CME的发病机制研究十分困难[7]。我们前期建立了一种实用的前节内眼模拟手术诱发BRB破坏的大鼠模型[10],发现前列腺素在BRB破坏的发病机制中起重要作用,前列腺素拮抗剂可以减轻大鼠模型中的BRB破坏作用。非甾体消炎药预防性治疗可以达到更好的疗效[11]。然而,前列腺素拮抗剂只能减轻BRB破坏,但不能完全阻止BRB的破坏作用,这表明除了前列腺素外,还可能存在其他炎症因子。
白细胞介素-1β(interleukin-1β,IL-1β)是一种重要的促炎细胞因子。IL-1β在创伤或感染的炎症和免疫反应中起重要作用[12-13]。在多种眼部手术后或疾病中IL-1β表达增加,如白内障手术[14-15]、葡萄膜炎和视网膜血管炎[16]、年龄相关性黄斑变性、息肉状脉络膜血管病变[17]、增生型糖尿病视网膜病变[18]等。阿那白滞素是白细胞介素-1(interleukin-1,IL-1)受体的重组竞争性拮抗剂,具有抗炎作用[19-20]。本研究旨在探讨阿那白滞素在眼前节内眼模拟手术诱发的BRB破坏中的作用。
1 材料与方法
1.1 材料采用健康雄性SD大鼠(中国上海斯莱克实验动物有限公司),体质量(300±20)g,8周龄。本研究严格按照国家卫生研究院实验动物护理和使用指南中的建议进行。盐酸氯胺酮/盐酸二甲苯嗪溶液(K4138,Sigma Aldrich,美国)1 mL·kg-1体质量全身麻醉,局部麻醉使用奥布卡因滴眼液(Benoxil®,Santen,日本)。
1.2 前节内眼模拟手术诱发BRB破坏大鼠模型制作前节内眼模拟手术诱发BRB破坏大鼠模型制作已在前期研究中报道过[10]。在手术显微镜下,将弯曲的尖头27G针头从角膜缘穿刺进入前房后退出,避免触及虹膜、晶状体和角膜内皮。另一根弯曲的钝头27G针头经穿刺口插入前房,针头末端通过输液管连接到平衡盐溶液。控制平衡盐溶液的压力为 0~12 mmHg(1 kPa=7.5 mmHg,大鼠生理性眼压范围),振荡30次,退出针头,前房成形。将眼球垂直暴露在显微镜光源下照射60 min(8000 Lux)。光照期间,角膜用平衡盐溶液持续湿润,每分钟20滴,对侧眼用胶带封住眼睑。造模后使用氧氟沙星滴眼液(Tarivid®,Santen,日本)滴眼,每天3次。
1.3 各组大鼠房水和玻璃体内的IL-1β浓度检测将144只SD大鼠随机分为对照组、模型组、局部治疗组和全身治疗组,每组各36只。对照组、模型组使用Hamilton显微注射器将5 μL生理盐水注入前房。局部治疗组建模后使用Hamilton显微注射器将5 μL阿那白滞素(150 g·L-1,Amgen Inc,Thousand Oaks,加拿大)注入前房[21]。对照组、模型组、局部治疗组每天皮下注射40 μL生理盐水,连续3 d。全身治疗组建模后使用Hamilton显微注射器将5 μL生理盐水注入前房,每天皮下注射20 mg·kg-1阿那白滞素40 μL[22],连续3 d。分别于造模后4 h、1 d、2 d、3 d、5 d和7 d,摘除大鼠眼球,-20 ℃冷冻2 h。然后沿角巩膜缘切开眼球。将冷冻的房水和玻璃体分离并储存在EP管中。采用酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)检测房水和玻璃体内IL-1β的浓度[大鼠IL-1β ELISA试剂盒(Cat.No.:RLB00,R&D Inc.)]。
1.4 阿那白滞素对大鼠模型BRB破坏的影响分别于造模后4 h、1 d、2 d、3 d、5 d和7 d,使用Evans蓝色作为示踪剂定量测量BRB的完整性。
使用Evans蓝作为示踪剂定量测量BRB的完整性已有报道[10,23]。鼠尾静脉注射Evans蓝(45 mg·kg-1,206334,Sigma-Aldrich,美国)。2 h后经股动脉抽血,离心取上清检测血浆中Evans蓝浓度,经左心室灌注10 g·L-1多聚甲醛柠檬酸盐缓冲液(37 ℃,pH 3.5),灌注压为120 mmHg(大鼠生理性血压),灌注2 min。灌注后摘除眼球速冻;沿赤道部切开眼球,在显微镜下分离视网膜,放入预先称质量的EP管内,真空干燥(5 h,60 ℃)后称质量;每管加入120 μL甲酰胺(F5786,Sigma-Aldrich,美国),萃取视网膜中的Evans蓝;萃取液离心(15 000 r·min-1,30 min)后取上清液100 μL,采用双波[Evans蓝吸收峰620 nm,吸收谷740 nm,吸光度(A)值=A620 nm-A740 nm]检测Evans蓝浓度(紫外-可见光分光光度计,Model Du-640,Beckman,Fulletton,加拿大),通过标准曲线计算上清液中Evans蓝浓度,Evans蓝渗漏量计算公式参照文献[23]。
1.5 统计学分析采用统计学软件21.0分析数据,数据均以均值±标准差表示。使用配对t检验或ANOVA分析数据,LSD-t检验进行多重比较,检验水准为:α=0.05。
2 结果
2.1 各组大鼠房水和玻璃体内IL-1β浓度造模后1 d、2 d、3 d、5 d,四组间房水和玻璃体内IL-1β浓度差异均具有统计学意义(房水:F1 d=382.05,F2 d=1651.89,F3 d=266.66,F5 d=120.62;均为P<0.001。玻璃体:F1 d=514.61,F2 d=1055.34,F3 d=560.76,F5 d=49.63;均为P<0.001)。其他时间点四组间房水和玻璃体内IL-1β浓度差异均无统计学意义(均为P>0.05)。与对照组相比,模型组、局部治疗组和全身治疗组房水和玻璃体内IL-1β浓度在造模后4 h均略有增加(均为P>0.05),造模后1 d均显著增加(均为P<0.05),造模后2 d时均达到峰值(均为P<0.05),造模后3 d、5 d均下降(均为P<0.05),造模后7 d接近对照组水平(均为P>0.05)。局部治疗组和全身治疗组房水和玻璃体内IL-1β浓度在造模后1 d、2 d、3 d、5 d均低于模型组(均为P<0.05),造模后4 h、7 d与对照组、模型组接近(均为P>0.05)。局部治疗组房水和玻璃体内IL-1β浓度在造模后1 d、2 d均低于全身治疗组,但造模后3 d时高于全身治疗组(均为P<0.001)。造模后4 h、5 d、7 d与全身治疗组接近(均为P>0.05)。见图1。
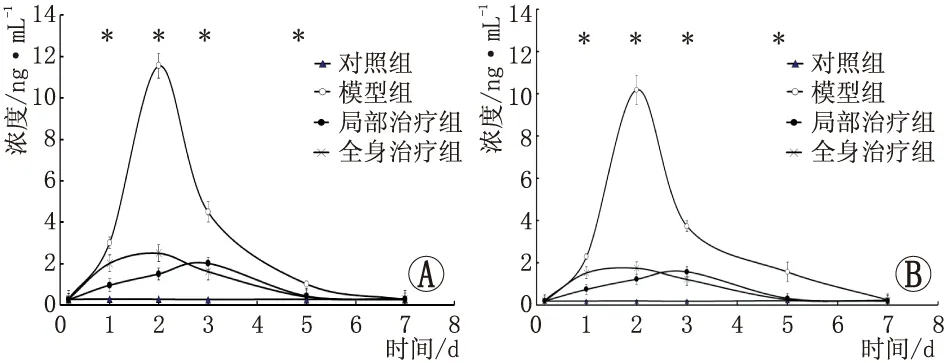
图1 大鼠模型房水和玻璃体内IL-1β浓度(n=6)。A:房水;B:玻璃体。与对照组相比,*P<0.05
2.2 阿那白滞素对大鼠模型BRB破坏的影响造模后1 d、2 d、3 d、5 d,四组间视网膜Evans蓝渗漏量差异均具有统计学意义(F1 d=76.23,F2 d=364.03,F3 d=399.02,F5 d=28.67;均为P<0.001),见图2。其他时间点四组间视网膜Evans蓝渗漏量差异均无统计学意义(均为P>0.05)。视网膜Evans蓝渗漏量在造模后1 d局部治疗组低于全身治疗组,但造模后2 d、3 d局部治疗组均高于全身治疗组(均为P<0.05)。局部治疗组和全身治疗组视网膜Evans蓝渗漏量在造模后1 d、2 d、3 d、5 d均低于模型组,但均高于对照组(均为P<0.05)。造模后4 h、7 d与对照组、模型组接近(均为P>0.05)。
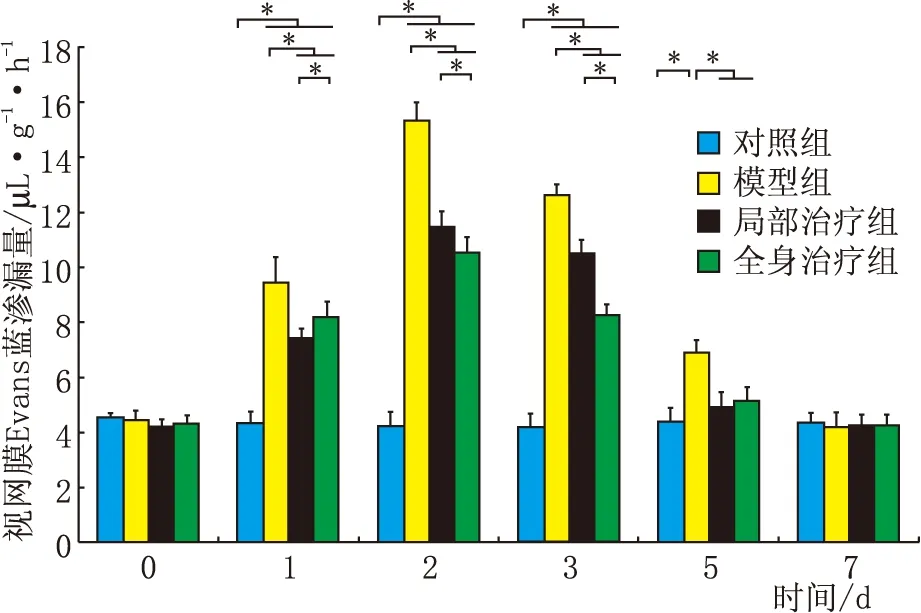
图2 大鼠模型中视网膜Evans蓝渗漏量(n=6)。*P<0.05
3 讨论
本研究发现,前节内眼模拟手术模型大鼠房水中的IL-1β浓度在造模后4 h较对照组仅略微增加,并在造模后2 d时达到峰值。IL-1β是一种重要的炎症前细胞因子,在免疫炎症的发生和发展中起重要作用。IL-1β主要由活化的单核细胞、巨噬细胞、树突细胞等分泌[12-13]。白内障常规超声乳化手术后,患者房水中IL-1β和单核细胞趋化蛋白-1(MCP-1)的表达均增加[14-15]。MCP-1可以募集单核细胞、中性粒细胞、淋巴细胞、巨噬细胞、树突细胞等,说明手术可以刺激IL-1β的表达。而IL-1β可以破坏BAB并扩散到玻璃体内。IL-1β具有强烈的促炎作用。IL-1β可以与IL-1受体结合,激活信号转导通路,导致许多转录因子的活化,如JNK、JAK/STAT、NF-κB、RhoA和MAPK。IL-1β和受体结合具有广泛的生物学效应,如促进免疫应答、免疫调节、参与炎症反应等。IL-1β在炎症早期显著增加,它参与T淋巴细胞和B淋巴细胞的活化,并诱导T淋巴细胞和巨噬细胞聚集到炎症部位,刺激其他细胞因子的产生,这些细胞因子参与炎症反应[24-27]。IL-1β可作用于视网膜血管和视网膜色素上皮细胞,引起视网膜内屏障和视网膜外屏障的渗透性增加,导致视网膜Evans蓝渗漏增加。
本研究发现局部治疗组和全身治疗组的房水和玻璃体内IL-1β浓度、视网膜Evans蓝渗漏量均低于模型组,但高于对照组。这表明局部或全身阿那白滞素给药可以降低房水和玻璃体内IL-1β浓度,减轻炎症反应,减轻BRB破坏的效果。阻断IL-1(尤其是IL-1β)的活性是自身免疫性疾病的标准治疗。阿那白滞素(IL-1Ra)是FDA批准的治疗类风湿性关节炎的药物[19-20]。阿那白滞素还用于治疗其他炎症性疾病,如葡萄膜炎[28]、心包炎和心包填塞[29]、脉络膜新生血管膜[21]。阿那白滞素是IL-1受体的天然竞争性拮抗剂,通过竞争性结合,起到IL-1α和IL-1β抑制剂的作用,可以与IL-1受体结合,但不会激活下游信号转导[19-20]。因此,阿那白滞素可以预防由IL-1β诱导的炎症,减轻BAB和BRB屏障的破坏。
本研究发现局部治疗组的视网膜Evans蓝渗漏量在造模后1 d低于全身治疗组,但在造模后2 d和3 d高于全身治疗组,其原因可能是阿那白滞素的半衰期很短。全身治疗组每天皮下注射阿那白滞素,而局部治疗组仅接受一次阿那白滞素注射。如果阿那白滞素可以制成滴眼液并且每天滴用,疗效可能更好。
本研究中,我们证明了大鼠模型的房水和玻璃体内IL-1β的浓度增加。阿那白滞素可以减少大鼠模型中视网膜Evans蓝的渗漏。这表明IL-1β在前节内眼模拟手术诱导的BRB破坏中起重要作用,阿那白滞素可以减轻BRB的破坏。
