超表达SlSAMS1对番茄镉胁迫的缓解效应及抗氧化系统的影响
2020-03-17杨婉莹孙莎莎李晓彤史庆华
杨婉莹 孙莎莎 巩 彪 李晓彤 刘 越 史庆华
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室/农业农村部黄淮海设施
农业工程科学观测实验站,山东泰安 271018)
镉(Cd)是土壤污染的主要重金属之一,极易被植物吸收,并积累在可食用部位,通过食物链危害人体健康[1]。虽然镉不具有氧化还原活性,不能直接产生活性氧(reactive oxygen species,ROS),但镉毒害能够引起植物体内活性氧的爆发,过量的活性氧会引起细胞膜解体、离子渗漏、脂质过氧化和核酸降解,最终导致细胞死亡[2]。此外,镉还可以与富含巯基的多肽结合,形成镉-配体复合物,消耗具有还原活性的多肽[3]。为了应对胁迫,植物本身进化出一套酶促和非酶促的抗氧化系统来清除和平衡体内的活性氧,包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、愈创木酚过氧化物酶(guaiacol peroxidase,POD)、抗坏血酸氧化酶(ascorbate peroxidase,APX)、脱氢抗坏血酸还原酶(dehydroascorbate reductase,DHAR)、谷胱甘肽还原酶(glutathione reductase,GR)等抗氧化酶类,以及抗坏血酸(ascorbic acid,AsA)和还原型谷胱甘肽(reduced glutathione,GSH)等抗氧化物质。抗氧化能力的增强是植物适应重金属胁迫的重要生理途径。
硫代腺苷甲硫氨酸合成酶(S-adenosyl-Lmethionine synthetase,SAMS)催化硫代腺苷甲硫氨酸(S-adenosyl-L-methionine,SAM)的合成。SAM是重要的甲基供体,又是多胺和乙烯等多种物质合成的前体[4]。最早发现番茄中的SAMS基因参与盐胁迫响应,且在玉米中SAMS2和SAMS4 也明显受盐胁迫诱导[5-6]。研究表明,过量表达SAMS可以提高植物抵抗非生物胁迫的能力,Ezaki 等[7]在拟南芥中超表达AvSAMS1,发现转基因植株能够抵抗铝胁迫,推测其机理可能是过表达该基因导致了野生型和转基因植株间不同的DNA和组蛋白H3 甲基化状态的变化。Gong等[8]和Guo 等[9]分别在番茄和苜蓿中超表达SAMS1基因,发现SAMS1可以通过上调多胺合成及氧化,进而激发H2O2诱导的抗氧化保护系统,提高转基因植株对盐碱和低温的抗性。Singh 等[10]通过给镉中毒的大鼠服用SAM,提高了大鼠体内SOD活性和GSH含量,进而缓解了镉诱发的肝损伤。由此可见,SAMS1基因可能在调控生物的广谱抗性中发挥重要的作用,但关于SAMS1 缓解番茄镉胁迫的研究鲜见报道。因此,本研究拟利用超表达SlSAMS1 番茄植株[8],比较转基因和野生型番茄植株耐镉性差异,并进一步研究抗氧化系统的变化,以期为丰富SAMS1的生理功能和提高植物的耐镉能力奠定一定的理论基础。
1 材料与方法
1.1 材料培及试验设计
试验材料为895 自交系的野生型番茄(Solanum lycopersicumL.)和超表达SlSAMS1 植株的3个独立株系:SAMS1-3、SAMS1-7、SAMS1-11[8]。
试验于2018年3-5月在山东农业大学现代化玻璃温室内进行。番茄种子在28℃超纯水中浸种7 h后,于28℃恒温箱中催芽,待种子露白后播于装有育苗基质(草炭∶蛭石=3∶1)的穴盘中。适时浇灌1/2 Hogland 营养液。待番茄长至两叶一心时,挑选整齐一致的幼苗,采用Hogland 营养液(1倍)水培法,将其培养于5 L的黑色塑料盒内,用白色泡沫板使幼苗地上部浮于液面上,每盆4 棵,待幼苗四叶一心时,以CdCl2·H2O为镉来源添加到营养液中,镉浓度为50 μmol·L-1,分别取镉处理0、3、6、12、24、48 h的野生型番茄根和叶片进行SlSAMS1的定量分析;处理12 d后,取番茄叶片和根系进行各项指标的测定。
1.2 测定项目与方法
1.2.1 叶片叶绿素含量测定 参照赵世杰等[11]的方法。取0.2 g 鲜样,加入20 mL 80%丙酮,置于暗处24~36 h,然后分别于663.3、646.8、470 nm 波长下进行比色。
1.2.2 镉含量测定 参考冯世静等[12]方法。镉处理12 d后,分别取野生型和转基因番茄幼苗,用去离子水冲洗干净,然后将根浸入10 mmol·L-1EDTA-Na2溶液中交换30 min,用吸水纸吸干表面水分,将植株分为根、茎、叶,并于105℃杀青30 min,再于75℃烘干至恒重。植株各器官中的镉含量采用NexION 300X 电感耦合等离子体质谱仪(ICP-MS)(PerkinElmer,美国)测定。将烘干的植株样品用粉碎机粉碎过100目筛后,称取0.3 g 于聚四氟乙烯灌中,然后加入5 mL 浓硝酸,放置过夜,再加入2 mL 30%过氧化氢,随后置于微波消解炉中消解,消解完成后定容至50 mL。采用0.22 μm 水系滤膜过滤后,上机测定。
H2O2含量测定参照Dhindsa 等[14]方法。镉处理12 d后,取0.5 g 番茄叶片,加入4 mL 预冷丙酮研磨成匀浆,4℃条件下10 000×g离心20 min,保留上清液。取1 mL 上清液,加入2 mL 萃取剂[CCl4∶CH3Cl3=3∶1]混匀,再加入3 mL 蒸馏水,4℃条件下6 000×g离心2 min,保留上层水相。取1 mL 上层水相为待测液,分别加入0.1 mL 20% TiCl4-浓HCl 溶液和0.2 mL 浓氨水,待沉淀形成后,于4℃条件下6 000×g离心12 min,弃上清液,向沉淀中加入5 mL 2 mol·L-1H2SO4完全溶解后,于410 nm 波长下进行比色。
1.2.4 丙二醛(malonaldehyde,MDA)含量测定 参考Dhindsa 等[14]的方法。取0.3 g 番茄叶片,加入3 mL 50 mmol·L-1磷酸缓冲液(pH值7.8,含0.2 mmol·L-1EDTA)研磨成匀浆,12 000 r·min-1离心20 min,保留上清液。取1 mL 上清液,加入3 mL 三氯乙酸(trichloroacetil acid,TCA)反应液,混匀后于95℃水浴30 min,然后立即冷却,1 500 r·min-1离心10 min,上清液分别于532、600、450 nm 波长下进行比色。
1.2.5 过氧化物酶活性测定 SOD、CAT、POD、APX活性测定参照Shalata 等[15]的方法。酶的提取:取0.3 g 番茄叶片,加入3 mL 50 mmol·L-1磷酸缓冲液(pH值7.8,含0.2 mmol·L-1EDTA;测定APX时,加入AsA溶液)研磨成匀浆,4℃条件下12 000 r·min-1离心20 min,上清液即为酶的粗提液。酶活的测定:SOD 反应液为NBT 反应液,测定时取50 μL 提取液与3 mL 反应液混合,25℃下光照15 min后于560 nm 波长下进行比色;CAT、POD、APX的反应混合液为25 mmol·L-1磷酸缓冲液(pH值7.0)和H2O2,在POD和APX的反应液中分别加入1%愈创木酚和5 mmol·L-1AsA,最后加入100 μL 提取液,分别于240、470、290 nm 波长下进行动力学测定。
GR活性测定参照Chaoui 等[16]的方法。酶的提取:取0.5 g 番茄叶片,加入4 mL 50 mmol·L-1Tris-HCl缓冲液(pH值7.0,含AsA、EDTA、GSH 各1 mmol·L-1以及5 mmol·L-1MgCl2) 研磨成匀浆,4℃条件下20 000 r·min-1离心30 min,上清液即为酶的粗提液。酶活的测定:取100 μL 提取液加入3 mL 反应液[50 mmol·L-1Tris-HCl(pH值7.5)、5 mmol·L-1MgCl2、0.5 mmol·L-1氧化型谷胱甘肽(oxidized glutathione,GSSG)和0.2 mmol·L-1NADPH]后立即于340 nm 波长下进行动力学测定。
脱氢抗坏血酸还原酶(dehydroascorbate reductase,DHAR)活性测定参照Pinto 等[17]的方法。酶的提取:取0.5 g 番茄叶片,加入4 mL 50 mmol·L-1磷酸钾缓冲液(pH值7.8,含2 mmol·L-1AsA和0.2 mmol·L-1EDTA)研磨成匀浆,4℃条件下12 000×g离心20 min,上清液即为酶的粗提液。酶活的测定:取100 μL 提取液,加入3 mL 反应液[25 mmol·L-1磷酸钾缓冲液(pH值7.0)、0.2 mmol·L-1EDTA、70 mmol·L-1GSH和0.1 mmol·L-1脱氢抗坏血酸(dehydroascorbic acid,DHA)]后混匀立即于265 nm 波长下进行动力学测定。
1.2.6 抗坏血酸和谷胱甘肽含量的测定 参照李忠光等[18]的方法。取0.5 g 番茄叶片鲜样,加入2.5 mL 预冷的5%磺基水杨酸,充分研磨后4℃下20 000×g离心20 min,上清液即为提取液。在酸性条件下,AsA可将Fe3+还原为Fe2+,Fe2+与双吡啶形成红色络合物,此络合物在525 nm 波长处有最大吸收峰,以此测定样品中的AsA、DHA含量。1 mol GSH可与1 mol 2-硝基苯甲酸[5,5’-Dithiobic-(2-nitrobenzoic acid) DTNB]反应形成1 mol 硝基苯甲酸,此物质在412 nm 波长处有最高吸收峰,以此测定GSH、GSSG含量。
1.2.7 荧光定量分析 参照Kenneth 等[19]的方法。采用Trizol提取番茄叶片和根系的总RNA,反转录使用HiScript ⅡQ RT SuperMix for qPCR(+g DNA wiper)(VazymmeTM)试剂盒合成cDNA。以cDNA为模板,采 用 Power SYBR Green PCR Master Mix(TransGen Biotech)进行实时荧光定量。内参基因和SlSAMS1基因的荧光定量PCR 引物分别为actin-F:GA AGCACCTCTCAACCCTAAG;actin-R:GCATACAAGGA AAGCACAGC;SlSAMS1-F:CAGTTCTTGATGCCTGCCT T;SlSAMS1-R:CGTGGACACCTTGAGCAAT。
1.3 数据分析
采用Microsoft Office Excel 2010软件整理试验数据,应用Origin Pro 2017软件绘制图表,并用SPSS 17软件对试验数据进行差异显著性分析(P=0.05)。
2 结果与分析
2.1 镉胁迫诱导SlSAMS1的表达
为了确定SlSAMS1是否响应镉胁迫,对50 μmol·L-1镉处理48 h 内番茄幼苗的根和叶中SlSAMS1的表达进行了分析。由图1可知,镉诱导根中SlSAMS1表达量显著上调,胁迫24 h时,达到峰值,为对照(镉处理时间为0 h)的2.4倍;叶片中SlSAMS1虽然也受到镉的诱导,但响应缓慢,其表达量略有上调,总体呈上升趋势。50 μmol·L-1CdCl2显著诱导了番茄植株中SlSAMS1的表达,且根中响应更为迅速,而叶片响应较慢,且上调幅度较小,可能是因为根是直接接触镉的部位,根的截留作用使得运往地上部的镉含量远低于根中。
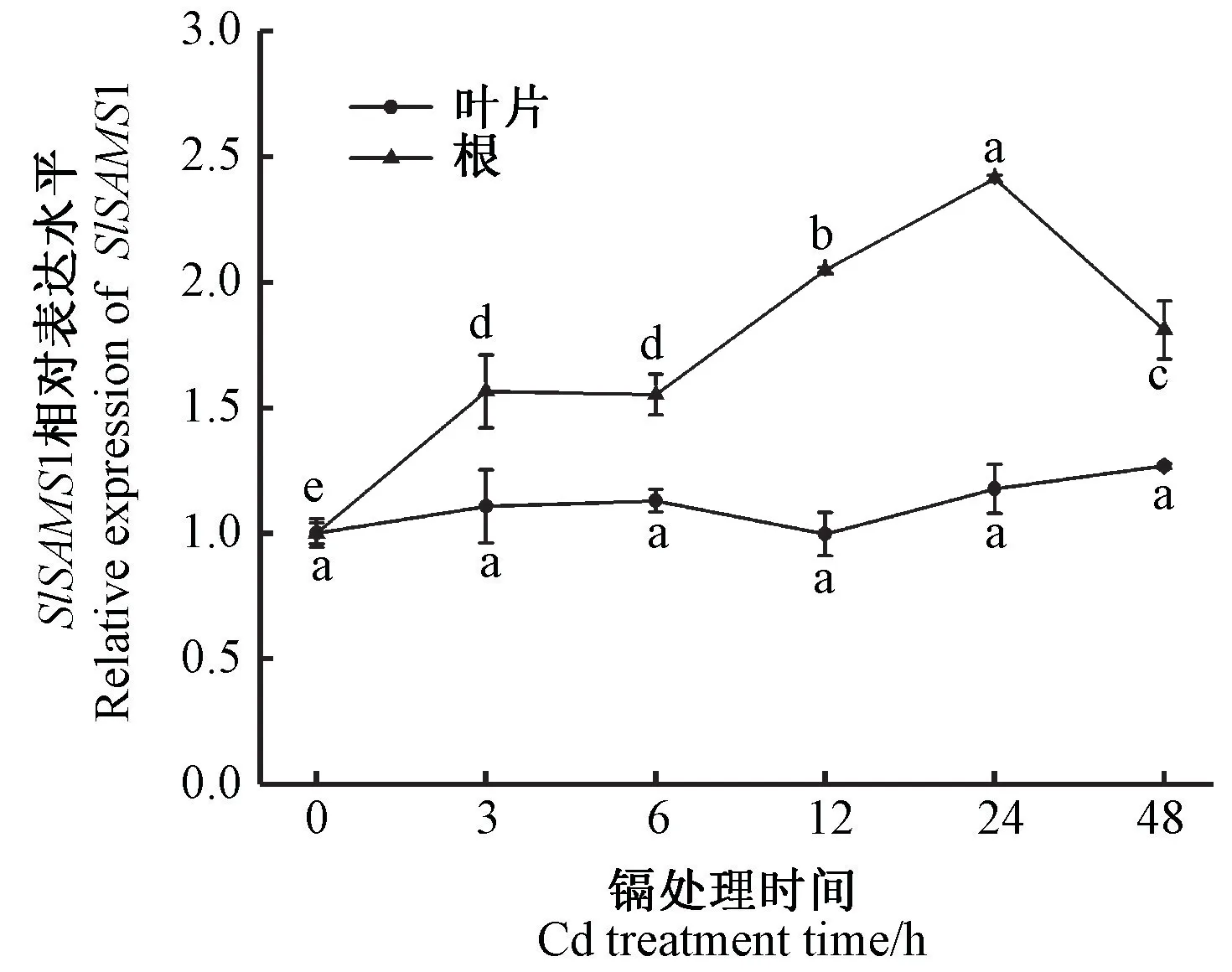
图1 SlSAMS1基因在50 μmol·L-1镉胁迫下的表达分析Fig.1 The expression analysis of SlSAMS1 gene under 50 μmol·L-1 cadmium stress
2.2 超表达SlSAMS1对镉胁迫下番茄幼苗生长及叶片叶绿素含量的影响
植株矮小,叶片黄化是植物镉中毒的常见症状。由表1可知,超表达SlSAMS1显著缓解镉胁迫对番茄植株生长的抑制,但不同株系间存在一定的差异。与未经镉处理的野生型番茄相比,镉处理下野生型番茄的株高、茎粗、地上部鲜重和根部鲜重分别下降了29.0%、30.8%、66.7%、37.2%。由表2可知,镉胁迫显著降低了野生型番茄和3个独立株系番茄叶片中的叶绿素含量,但在相同浓度镉处理下,超表达SlSAMS1番茄的叶绿素含量显著高于野生型。以上结果表明,超表达SlSAMS1 能显著缓解镉胁迫引起的植株生长受抑以及叶片黄化的状况。
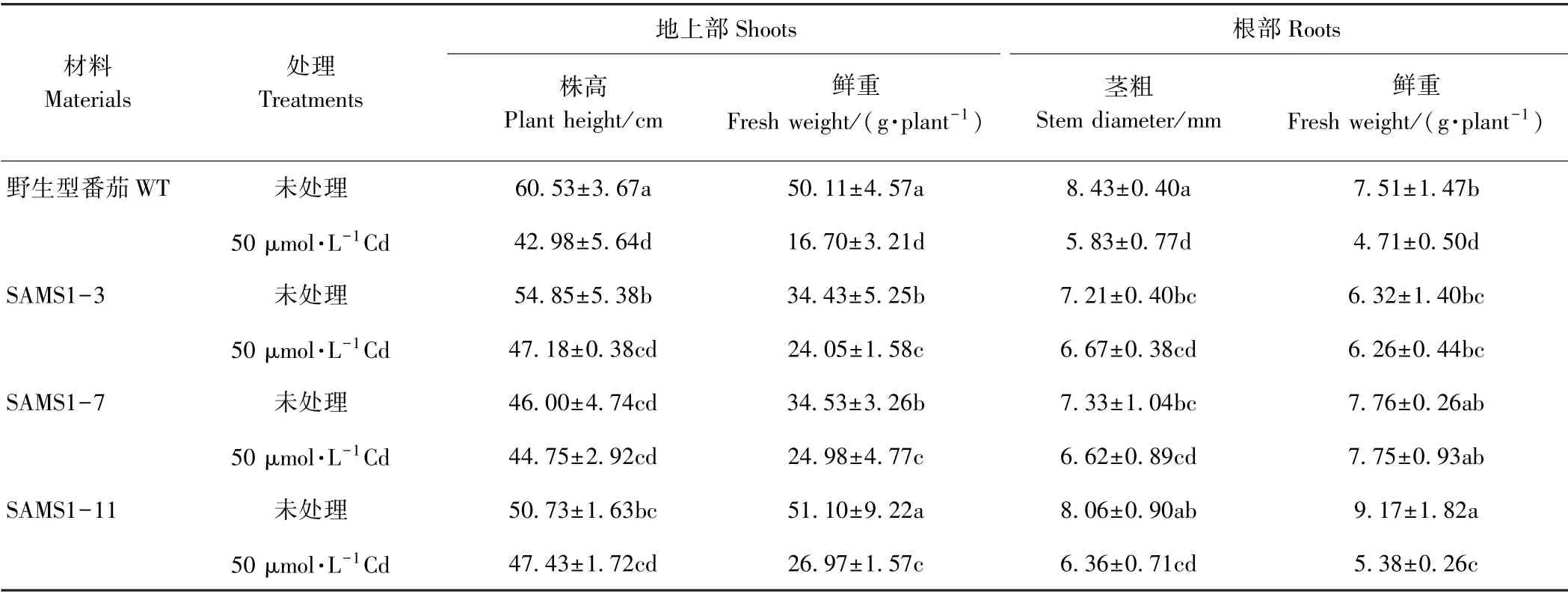
表1 超表达SlSAMS1对镉胁迫下番茄幼苗生长的影响Table1 Effect of overexpressing SlSAMS1 on the growth of tomato seedlings under cadmium stress
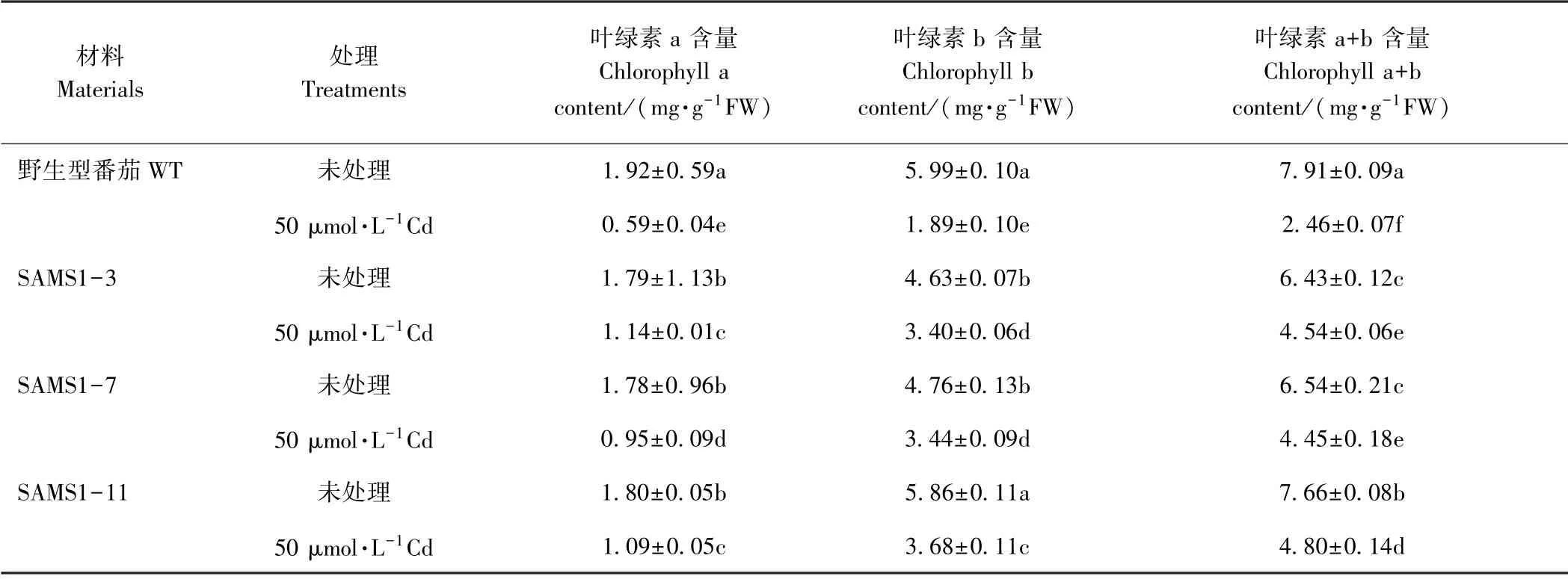
表2 超表达SlSAMS1对镉胁迫下番茄幼苗叶绿素含量的影响Table2 Effect of overexpressing SlSAMS1 on the chlorophyll content of tomato seedlings under cadmium stress
2.3 超表达SlSAMS1对镉胁迫下番茄叶片中的ROS 积累和MDA含量的影响
镉胁迫打破了植物ROS的产生和清除系统的平衡,导致ROS 过度积累,进而引发膜脂过氧化。MDA含量反映了膜脂过氧化程度。由图2可知,镉胁迫下,野生型番茄和3个独立株系番茄叶片的产生速率、H2O2含量和MDA含量都显著升高,且3个独立株系番茄的产生速率、H2O2和MDA含量均显著低于野生型番茄。综上表明,SlSAMS1基因可以降低镉胁迫下ROS的积累和膜脂过氧化水平。
2.4 超表达SlSAMS1对镉胁迫下番茄抗氧化酶活性的影响
由图3可知,未经镉处理时,野生型番茄的抗氧化酶活性与3个独立株系番茄间差异较小,而镉处理导致番茄叶片中SOD、POD活性显著升高,并且超表达SlSAMS1显著提高了镉胁迫下番茄叶片中POD活性而SOD活性受SlSAMS1 影响较小。野生型番茄的CAT、APX、DHAR、GR活性受镉胁迫影响保持不变甚至显著下降,而与野生型比较,超表达SlSAMS1显著提高了镉胁迫下番茄叶片中CAT、APX、GR活性。上述结果表明,SlSAMS1基因可以提高镉胁迫下抗氧化酶的活性,缓解镉引起的氧化伤害。
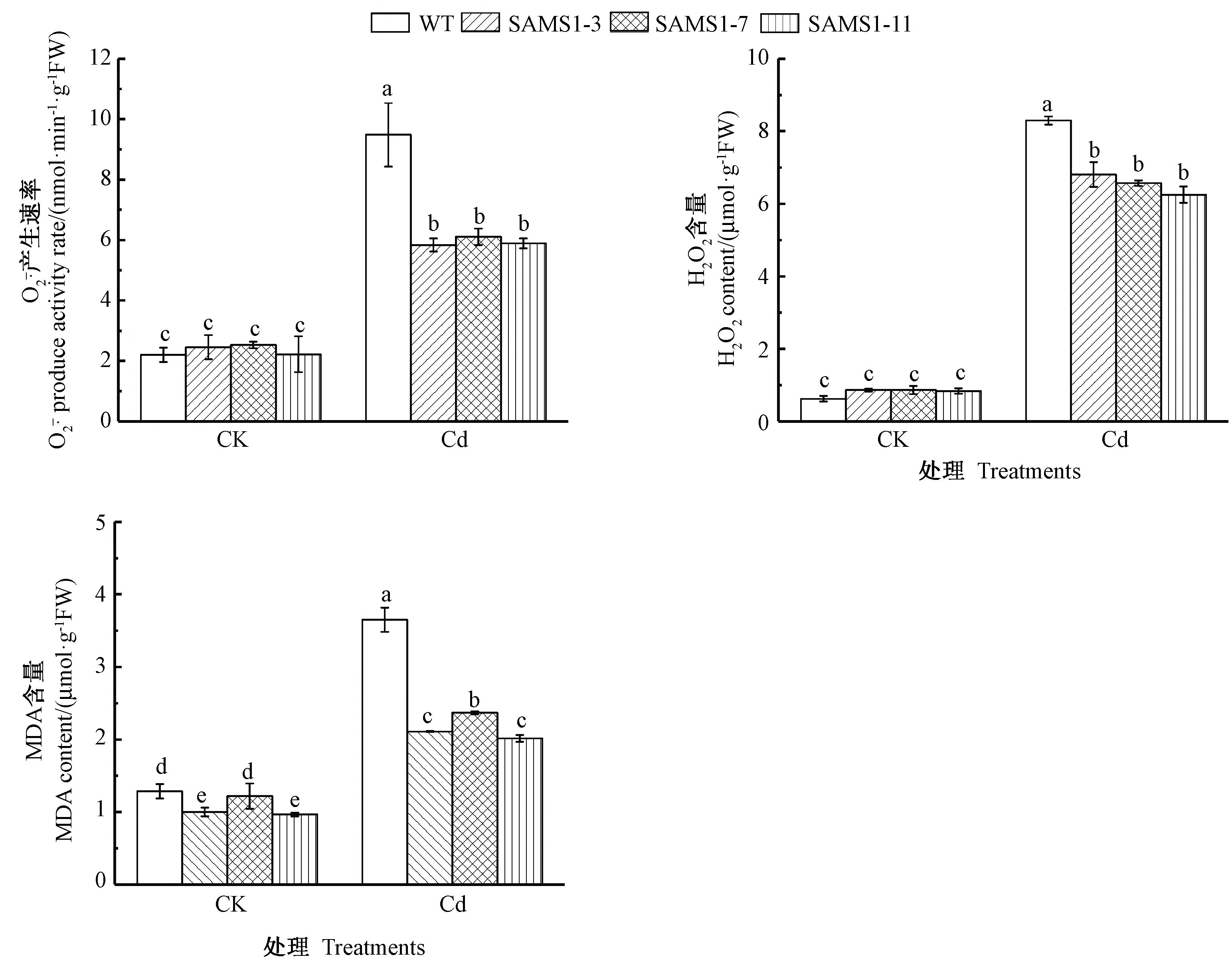
图2 超表达SlSAMS1对镉胁迫下番茄幼苗活性氧积累及MDA含量的影响Fig.2 Effect of overexpressing SlSAMS1 on ROS accumulation and MDA content in tomato seedlings under cadmium stress
2.5 超表达SlSAMS1对镉胁迫下番茄叶片AsA和GSH含量的影响
由图4可知,镉胁迫导致番茄叶片中AsA含量显著降低,而显著提高了GSH含量;超表达SlSAMS1 使镉胁迫下番茄叶片中AsA和GSH含量均显著高于野生型番茄。DHA和GSSG 作为AsA和GSH的氧化产物,在镉胁迫下各番茄中的DHA和GSSG含量均上升,尤其在野生型番茄中的积累量增加更加显著。AsA/DHA、GSH/GSSG 反映了植物内环境的氧化还原状态。镉胁迫下,野生型番茄的AsA/DHA和GSH/GSSG 比值均显著降低,超表达SlSAMS1 使AsA/DHA和GSH/GSSG 均较野生型番茄有不同程度的提高。AsA、GSH是植物体内重要的抗氧化物质,可以清除ROS,维持植物体内环境的氧化还原平衡,表明SlSAMS1基因可以提高镉胁迫下AsA、GSH含量以及AsA/DHA、GSH/GSSG 比值,提高番茄的抗氧化水平,缓解镉胁迫。
2.6 超表达SlSAMS1对番茄植株镉积累的影响
由图5可知,镉处理12 d后镉在番茄植株中积累量根中最高,其次为叶片和茎。超表达SlSAMS1 番茄茎和叶中镉含量与野生型番茄相比无显著差异,但根中镉的积累量显著低于野生型番茄。上述结果表明,SlSAMS1 降低了镉在根中的积累。
3 讨论
SAMS 蛋白在镉胁迫下显著上调,可能与SAM可作为GSH的合成前体有关[20-22]。本研究为了证明SlSAMS1 参与调控番茄对镉胁迫的适应性,以前期获得的超表达SlSAMS1 番茄为试验材料,发现超表达SlSAMS1可以显著缓解镉胁迫诱导的叶片失绿和生长受抑状况。SAMS1 编码植物中的S-腺苷甲硫氨酸合成酶,该酶的产物SAM是多胺的合成前体。研究表明,在番茄和苜蓿中超表达SAMS1基因可以提高植株中多胺的含量[8-9]。多胺作为植物体中生物活性较强的低分子脂肪族含氮碱广泛参与植物对逆境胁迫抗性的调节[23-25];在缓解重金属胁迫方面,多胺可以充当抗氧化物质及增强抗氧化系统的诱导剂,在一定程度上缓解植物组织因受重金属胁迫引起的氧化损伤[26-27]。因此,超表达SlSAMS1 植株可能通过多胺途径清除活性氧。本研究结果表明,与野生型番茄相比,3个独立株系番茄在镉胁迫下ROS和MDA水平显著降低,这可能是SlSAMS1 提高番茄耐镉的重要机理之一。

图3 超表达SlSAMS1对镉胁迫下番茄幼苗抗氧化酶活性的影响Fig.3 Effect of overexpressing SlSAMS1 on the activity of antioxidant enzymes in tomato seedlings under cadmium stress
当镉进入植物细胞后,因其对硫醇基团的高亲和性,迅速结合了大量的GSH,从而消耗了GSH。GSH不仅是螯合肽的前体,同时也是一种非常重要的抗氧化剂,可以直接清除ROS 或者通过AsA-GSH 循环清除H2O2,维持内环境的氧化还原稳态[28-29]。本试验结果表明,镉胁迫下3个独立株系番茄中的GSH含量显著高于野生型番茄,这可能是因为超表达SlSAMS1基因促进了SAM的合成,而SAM 作为GSH的合成前体,促进了GSH的积累。同时,镉胁迫下3个独立株系番茄的GR活性也显著高于野生型番茄,促进了GSSG 向GSH的转化,维持了细胞内的较高的GSH水平。AsA-GSH 循环的另一个重要抗氧化剂AsA 在抵御非生物胁迫方面也发挥着重要的作用。研究发现,AsA含量少的植物对盐胁迫更加敏感[30],且不同于胁迫下GSH的变化,长时间的镉胁迫会导致AsA水平的显著降低[31-32]。本研究中,镉胁迫12 d后,番茄中AsA含量显著下降,但相对于野生型番茄,3个独立株系番茄依然维持了较高的AsA水平,这可能是因为DHAR活性维持在较高的水平,其中SAMS1-3活性同野生型一致,可能是酶活测定试验误差造成的。在AsA-GSH 循环中,GSH/GSSG、AsA/DHA 比值代表清除H2O2的能力[33]。通常,随着镉胁迫时间的延长,GSH/GSSG、AsA/DHA 呈现下降趋势[34]。而本试验中,3个独立株系番茄在镉胁迫下的GSH/GSSG 都有所提高,这可能是由于SlSAMS1基因诱导镉胁迫下GR活性的上升,使得在GSH 库(GSH pool)快速消耗的同时,GR 利用NADPH 提供的氢(H)将其还原成GSH,进而参与了下一次循环。AsA 在APX的催化下将H2O2还原成H2O,生成的DHA 以GSH为电子供体在DHAR 催化下还原成AsA。在该过程中仅DHAR的活性受镉毒害后下降,使得DHA 还原受阻。此外,SlSAMS1基因诱导胁迫下番茄POD和CAT活性的升高,增强了独立株系番茄中对镉胁迫引起的H2O2的清除能力。
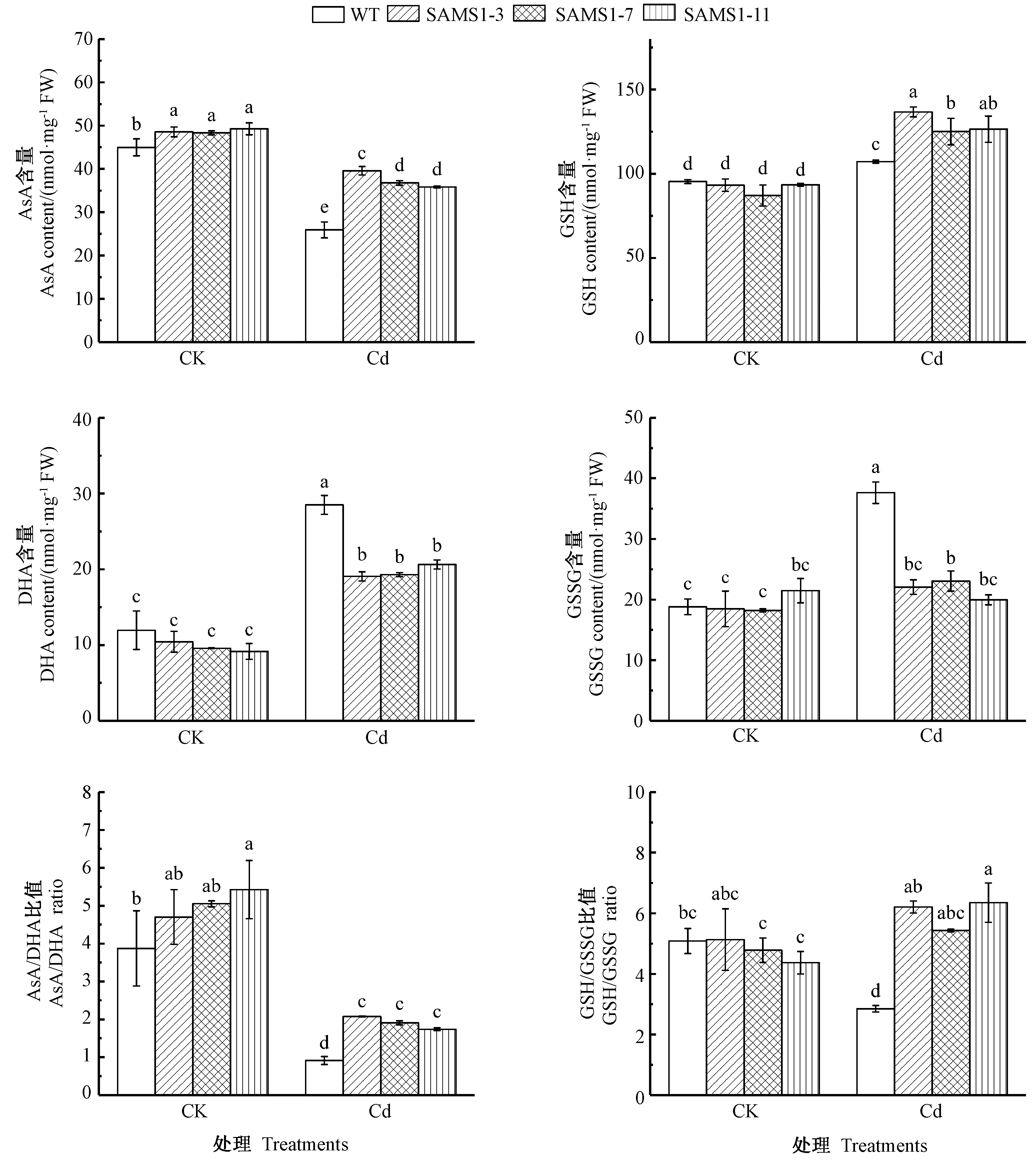
图4 超表达SlSAMS1对镉胁迫下番茄幼苗AsA和GSH含量的影响Fig.4 Effect of overexpressing SlSAMS1 on AsA and GSH content in tomato seedlings under cadmium stress
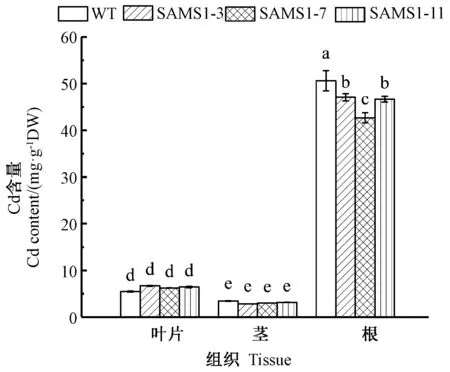
图5 超表达SlSAMS1对番茄幼苗镉积累的影响Fig.5 Effect of overexpressing SlSAMS1 on cadmium accumulation in tomato seedlings
当植物暴露在含镉环境中时,植物细胞有一系列机制抵御镉毒害。首先,细胞壁阻止镉进入和伤害原生质体,果胶的甲脂化及次生壁的木质化都起到了截留镉的作用,以至于大部分的镉都留在根中[35-36]。本试验也得出类似的结论,根中的镉含量显著高于地上部含量。此外,本研究还发现,独立株系番茄镉含量的降低仅发生在根中,这可能是由于SAMS1基因加速了镉胁迫下根的木质化,阻碍了根对镉的吸收,该观点也得到了许多研究的支持,Li 等[37]和Sánchez-Aguayo等[38]分别在石蒜和番茄中发现,盐胁迫促进SAMS表达上调,且加速了细胞壁的木质化,提高了植物的抗盐能力。此外,在拟南芥mto3 突变体中,SAM含量及其合成酶活性下降,导致木质素含量显著降低了22%[39]。
4 结论
本研究结果表明,在镉胁迫下,超表达SlSAMS1 番茄的株高、茎粗及鲜重都显著高于野生型番茄,叶绿素含量也较野生型番茄显著提高。超表达SlSAMS1 提高了番茄AsA-GSH 循环效率,增强了抗氧化能力,降低了ROS和MDA水平,从而缓解了镉对番茄植株的胁迫。此外,超表达SlSAMS1 番茄根中的镉积累量也显著降低,降低了镉对根造成的胁迫。由于SAM的功能广泛,关于SlSAMS1 缓解番茄镉胁迫的生理机制还有待进一步研究。
