酪蛋白处理法脱除虾仁中亚硫酸盐
2020-03-11杨振寰孙培龙
杨 开 周 城 杨振寰 虞 岚 孙培龙
(1浙江工业大学海洋学院,浙江 杭州 310014;2舟山市越洋食品有限公司,浙江 舟山 316000)
海捕虾滋味鲜美、营养丰富,是广大居民日常食用的重要水产品。但是虾类采捕季节集中,虾中含水量高,极易腐败变质[1],渔民往往采用焦亚硫酸钠进行保鲜处理,而保鲜操作的不当以及焦亚硫酸钠过量使用,使得处理后的海捕虾中二氧化硫残留量严重超标[2-3]。自20 世纪80 年代起,亚硫酸盐的安全问题引起越来越多的关注[4-5]。国内外多项研究表明,过量摄入二氧化硫会刺激呼吸道[6],引起敏感人群的哮喘和过敏反应[7-8]。此外,长期接触亚硫酸盐会导致神经毒性[9],甚至对生殖系统造成损害[10-11]。由于人体内含有少量的亚硫酸盐氧化酶[12],能够氧化亚硫酸盐,经正常解毒后,通过尿液排出,因此摄入少量亚硫酸盐是安全无害的[13]。为了规范亚硫酸盐类添加剂合理使用,国际食品法典委员会(codex alimentarius commission,CAC)规定生虾仁和熟虾仁的亚硫酸盐限量分别为100 mg·kg-1和30 mg·kg-1。我国《GB 2760-2014 食品添加剂使用卫生标准》[14]也明确规定虾仁中亚硫酸盐残留量不得超过100 mg·kg-1(残留量以SO2计),生食用鲜鱼、贝类等则禁止使用。
目前,国内外有关食品中二氧化硫的脱除技术报道比较少,主要集中在果酒发酵方面,如在葡萄酒生产过程利用离子交换柱吸附,而有关水产品的脱二氧化硫技术鲜有报道。虾仁脱硫工业化生产应用最广泛的方法为多次水循环处理和热风处理,但该方法效率不高,且耗水、耗能大。有研究表明能与蛋白质氨基酸残基结合[16],此外亚硫酸盐可还原蛋白质中的二硫键[17]。而酪蛋白因其良好的物质特性和经济性能,被广泛应用于食品工业,常作为水产肉糜制品的营养强化剂、乳化稳定剂、载体等。本研究优化了酪蛋白溶液对虾仁中亚硫酸盐的脱除工艺,并初步探讨其脱除机理,旨在为降低虾仁的亚硫酸盐残留和品质控制提供保障,也为其他水产品中亚硫酸盐的脱除提供有效途径。
1 材料与方法
1.1 材料与试剂
海捕中华管鞭虾仁(Solenocera melantho),由舟山市越洋食品有限公司提供,-18℃冷冻储存。酪蛋白[生物试剂(biochemical reagent,BR)],购自上海麦克林试剂有限公司;食品级碳酸氢钠,购自湖南海联三一小苏打有限公司;亚硫酸钠、乙酸铅、碘、碘化钾、溴化钾、淀粉等均为分析纯,购自上海凌峰试剂有限公司。
1.2 主要仪器与设备
TA.XT Express 型物性测试仪,北京微讯超技仪器技术有限公司;UV-245 型紫外-可见分光光度计,日本岛津公司;Bechman Allegra 型冷冻离心机,日本日立公司;BTP-3XL 型冷冻干燥机,美国SP Scientific 公司;Nicolet 6700 型傅里叶红外光谱仪,美国Thermo 公司;全玻璃蒸馏装置,江苏康达玻璃仪器有限公司。
1.3 试验方法
1.3.1 虾仁脱硫预处理 冷冻虾仁→4℃静水解冻→置于三层吸水纸,拭去表面水分→称取50 g 体形相似的虾仁,用于酪蛋白溶液浸泡脱硫试验,其中酪蛋白溶液用1 g·L-1食品级NaHCO3溶液配制[14],并以1 g·L-1NaHCO3溶液处理为对照→经脱硫处理的虾仁用4℃清水冲洗1 min→置于三层吸水纸,拭去表面水分→处理完的虾仁用于各项指标检测。
1.3.2 二氧化硫的测定 亚硫酸盐以二氧化硫计,参考GB 5009.34-2016 食品中二氧化硫的测定[18]中的碘滴定法。称取虾仁样品5.0 g,置于蒸馏烧瓶中,加入250 mL 水,10 mL 盐酸溶液(1∶1),加热蒸馏45 min,蒸馏气体用25 mL 20 g·L-1的乙酸铅溶液吸收,吸收液用碘标准溶液滴定至溶液颜色变蓝且30 s 内不褪色,记录消耗的碘标准液体积,每组样品平行测定3 次,且做空白试验。按照公式计算二氧化硫含量:
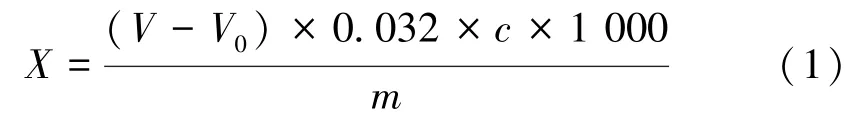
式中,X为虾仁中二氧化硫总含量(以SO2计),g·kg-1;V为滴定样品所用碘标准液体积,mL;V0为空白试验碘标准液体积,mL;c为碘标准液浓度,mol·L-1;m为虾仁试样质量,g。
式中,X0为虾仁解冻后的亚硫酸盐含量(以SO2计),g·kg-1;X1为虾仁浸泡处理后亚硫酸盐的含量(以SO2计),g·kg-1。
1.3.3 虾仁TPA(texture profile analysis)质构分析 选取大小相似的虾仁,从腹背取第2 腹节虾肉进行质构分析[19]。采用物性测试仪对样品的硬度、弹性、粘聚性和咀嚼性进行测试。具体测试参数设置:P/36R柱形探头,测试前速度3.0 mm·s-1,测试速度1.0 mm·min-1,测试后速度3.0 mm·min-1,测试形变量50%,触发力5 g。测试至少5 个平行样。
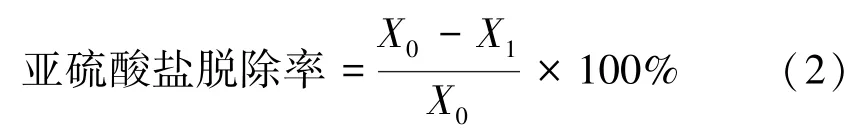
1.3.4 单因素试验设计 设定基础条件:浸泡温度4℃,料液比1∶8 g·mL-1,浸泡时间2 h,酪蛋白浓度0.5 g·L-1。固定其他条件,分别考察酪蛋白浓度(0、0.25、0.50、1.00、1.50、2.00 g·L-1)、料液比(1∶2、1∶4、1∶6、1∶8、1∶10 g·mL-1)、浸泡时间(0.5、1、2、3、4 h)对亚硫酸盐脱除率的影响。
1.3.5 响应面试验设计 综合单因素试验结果,利用响应面软件,进行Box-Behnken 设计和数据处理,确定最佳工艺,且比较最佳工艺处理前后的品质变化。以亚硫酸盐残留量为响应值,进行三因素三水平的试验设计,因素水平及编码如表1 所示。
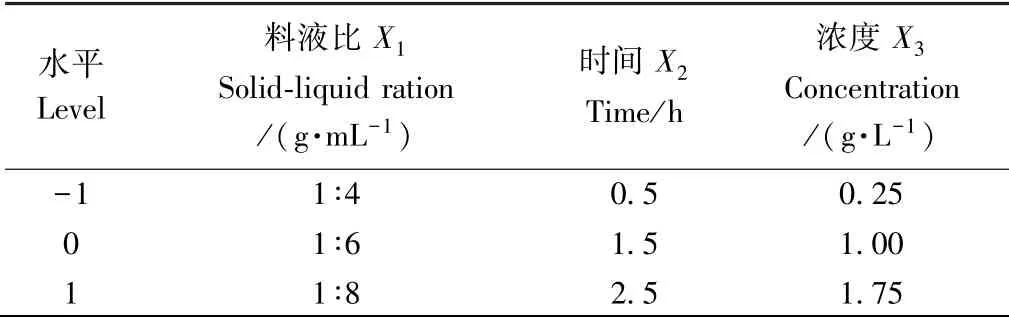
表1 响应面分析因素及水平表Table 1 The factors and levels of response surface analysis
1.3.6 Na2SO3与酪蛋白溶液体系的UV 分析 取0.5 mL 酪蛋白溶液(0.2 g·L-1)于试管中,分别添加0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL Na2SO3溶液(0.05 mol·L-1),并添加去离子水至5 mL,混匀,静置10 min。然后以酪蛋白溶液为空白对照,在190 ~400 nm 波长处测定其UV 吸收光谱[20]。
1.3.7 Na2SO3与酪蛋白反应产物的FT-IR 分析 预处理过程:分别取100 mL 酪蛋白溶液(0.2 g·L-1)于烧杯中,分别添加0、0.05 g 无水Na2SO3,搅拌2 h 后,8 000×g离心10 min,收集沉淀产物,-70℃冻干。取冻干样品1~2 mg,与100 mg 无水溴化钾混合研磨,压片后用傅立叶红外光谱仪记录酪蛋白、Na2SO3以及反应产物在400~4 000 cm-1范围内的红外吸收特征[21]。
1.4 数据分析
Box-Behnken Design 试验设计由Design-expert 8完成并作统计分析,其余数据处理及作图采用Origin 8.5、SPSS 22 统计分析软件,试验数据均进行3 ~5 次重复,以平均值±标准偏差表示,并采用Duncan’s 法进行差异显著性分析,以P<0.05 为显著性差异。
2 结果与分析
2.1 虾仁原料中亚硫酸盐含量测定
经测定,虾仁原料的亚硫酸盐含量为87.13 mg·kg-1(以SO2计)。
2.2 单因素对亚硫酸盐脱除率的影响
2.2.1 酪蛋白溶液浓度对亚硫酸盐脱除效果的影响
由图1 可知,较低浓度的酪蛋白溶液对亚硫酸盐的脱除效果已有明显的提高。随着酪蛋白浓度逐渐增加,脱除率随之提高。当酪蛋白浓度达到1.0 g·L-1时,脱除率达到81.38%。当浓度继续升高,脱除率几乎无变化,这可能存在两种原因,一是酪蛋白的溶解度有限,试验过程中发现当酪蛋白的添加量大于1.5 g·L-1时,有少量酪蛋白不能完全溶解;二是剩余的亚硫酸盐与虾仁中某些成分结合比较牢固,不能被酪蛋白结合脱除。
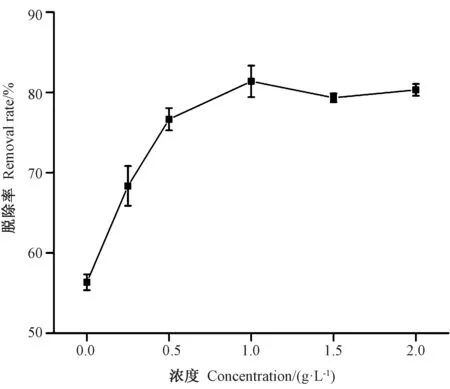
图1 酪蛋白溶液浓度对亚硫酸盐脱除效果的影响Fig.1 Effect of casein concentration on the removal of rate sulfites
2.2.2 液料比对亚硫酸盐脱除效果的影响 由图2可知,酪蛋白溶液用量增加,浸泡体系中酪蛋白含量也相应升高,亚硫酸盐的可结合物增多,亚硫酸盐脱除率升高。对照组随着料液比增大,脱除率同样有所提高,但变化没有试验组明显。因此适当增大酪蛋白溶液的体积有利于脱除亚硫酸盐。当料液比1∶8 g·mL-1时,脱除率最高(78.33%),相较对照组的脱除率(63.97%)有很大提高。
2.2.3 浸泡时间对亚硫酸盐脱除效果的影响 由图3 可知,在浸泡2 h 内是亚硫酸盐溶出的主要过程,之后溶出速率下降,直至趋于平衡,浸泡3 h 时,脱除率达到最大(79.03%)。对照组中由于最初浓度差大,虾仁中的亚硫酸盐迅速扩散到浸泡液中,随着浓度差逐渐平衡,扩散速度趋于平缓。而对于酪蛋白溶液的浸泡体系,除与浓度差相关,还可能与氢键作用力、离子作用力、化学反应等有关,使得Na2SO3的溶出速率大大提高,其具体原因有待进一步研究。
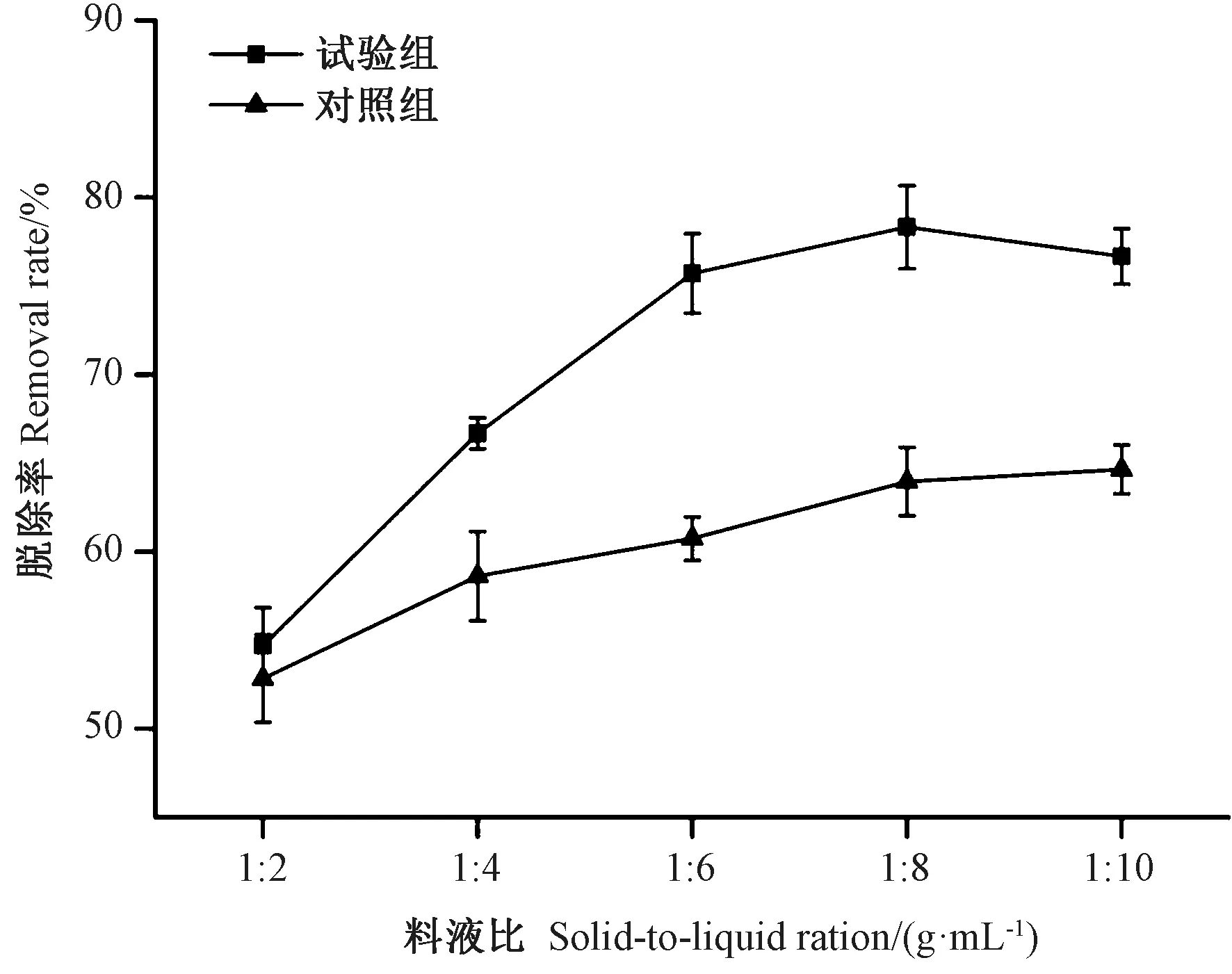
图2 液料比对亚硫酸盐脱除效果的影响Fig.2 Effect of liquid to material ratio on removal rate of sulfites
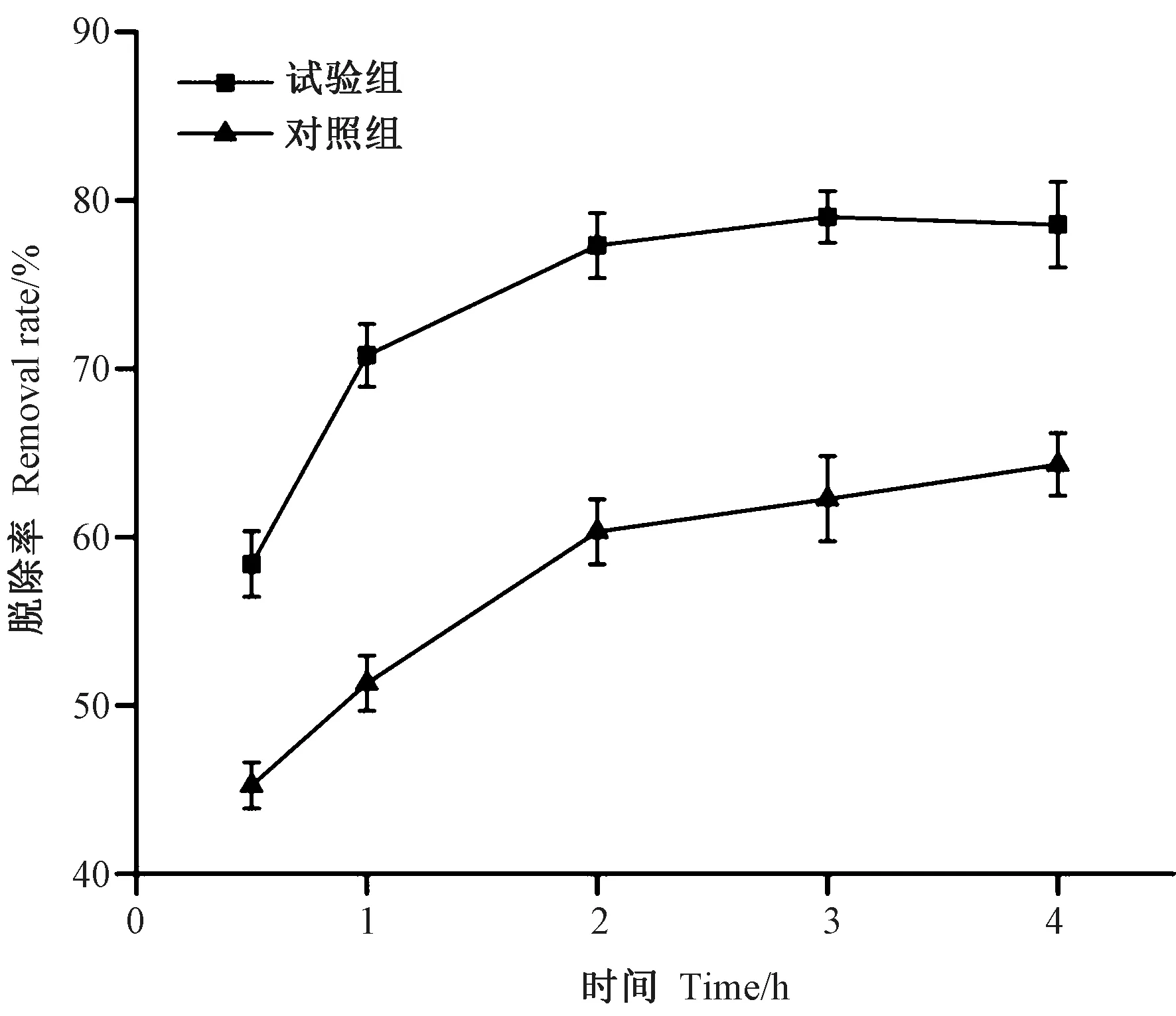
图3 浸泡时间对亚硫酸盐脱除效果的影响Fig.3 Effect of time on the removal rate of sulfites
2.3 响应面优化试验结果
2.3.1 响应面试验设计与结果 根据单因素试验结果,采用响应面分析三因素三水平对亚硫酸盐的脱除条件进行优化,试验设计与结果见表2。以亚硫酸盐脱除率(%)为响应值,经回归拟合,得到各因素的拟合方程:
脱除率(%)= 79.90+4.93X1+7.31X2+1.85X3-0.6X1X2-2.20X1X3-0.12X2X3-4.41X12 -4.04X22 -1.09X32。
2.3.2 响应面回归模型方差分析 由表3 可知,响应面方差分析中料液比(X1)和时间(X2)的一次项和二次项均极显著,酪蛋白溶液浓度(X3)的一次项和二次项均未达到显著水平,三因素的交互项也均不显著。拟合亚硫酸盐脱除率模型差异显著(P=0.000 4),且失拟项(P>0.05),二次回归模型决定系数R2为0.959 8,说明试验结果可靠,回归模型拟合度好,可以很好地描述各因素与响应值的真实关系。对所建立的回归方程模型进行最优化分析,得到虾仁中亚硫酸盐脱除的最佳条件:酪蛋白溶液浓度1.30 g·L-1,浸泡时间2.37 h,料液比1∶6.8 g·mL-1,在此条件下亚硫酸盐的理论脱除率为84.44%。以此条件做验证试验,测得亚硫酸盐实际脱除率为84.13%,与预测值相比无显著差异。
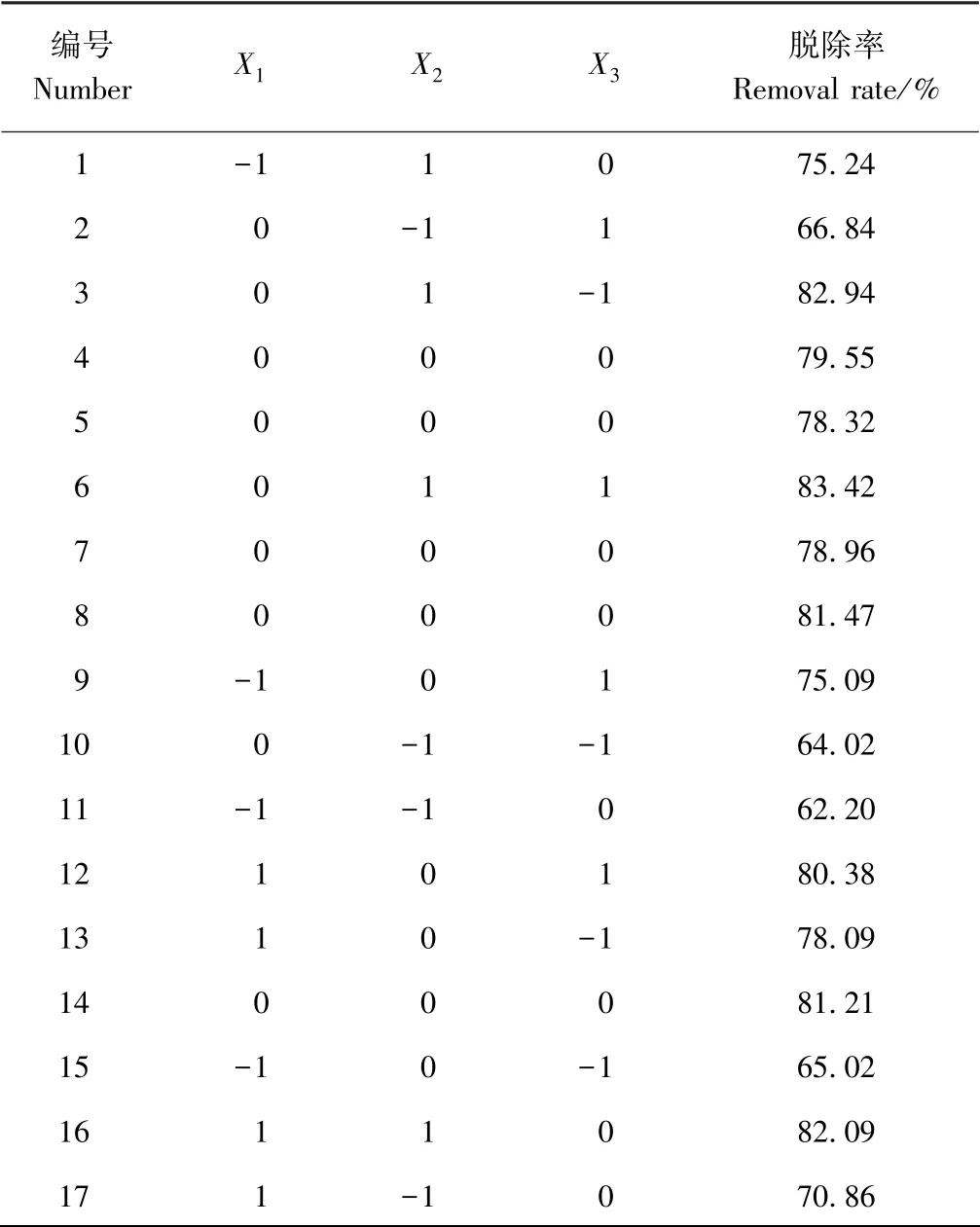
表2 响应面设计试验结果Table 2 Response surface design arrangement and test results
2.3.3 虾仁质构分析结果 经最优条件处理后的虾仁样品,通过TPA 测试仪测定其品质变化,结果如表4所示。经酪蛋白溶液浸泡处理后硬度和咀嚼性提高,这可能是由于酪蛋白溶液中含有少量的碳酸氢钠[22],弹性和粘聚性的变化则不明显。综合比较发现,酪蛋白溶液浸泡后虾仁依然保持较好的质构品质。
2.4 Na2SO3 与酪蛋白溶液体系的UV 分析
“酪蛋白+Na2SO3”体系随着Na2SO3浓度变化的UV 光谱图(以酪蛋白纯溶液为参比)如图4 所示。有两个电子跃迁带,即200 ~230 nm 处的π→π*跃迁和280~310 nm 处的n→π*跃迁[20]。由图4 可知,随着酪蛋白溶液中Na2SO3的浓度增加,230 nm处的最大吸收峰强度增加并且伴随着红移,其最大吸收峰从230 nm 红移至238 nm。这说明酪蛋白溶液使得的紫外最大吸收峰发生蓝移,π→π*跃迁变得困难,酪蛋白表面的电子偏向SO32-的硫原子,使之形成更大的共轭体系,导致SO32-中π→π*所需要的能量增加。
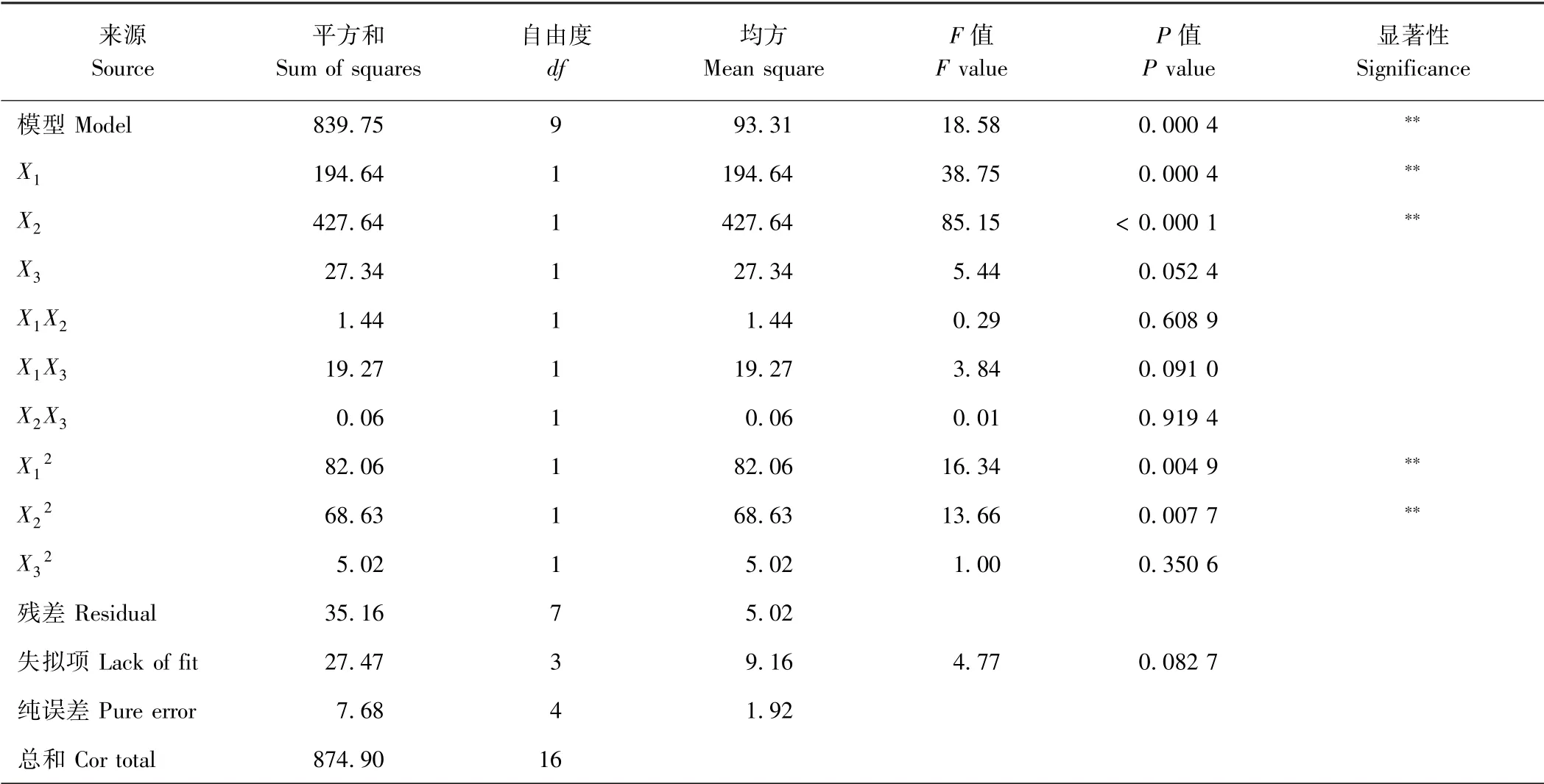
表3 响应面回归模型方差分析Table 3 ANOVA for the response surface regression model

表4 处理前后虾仁TPA 质构分析(n=5)Table 4 Determination of TPA before and after treatment(n=5)
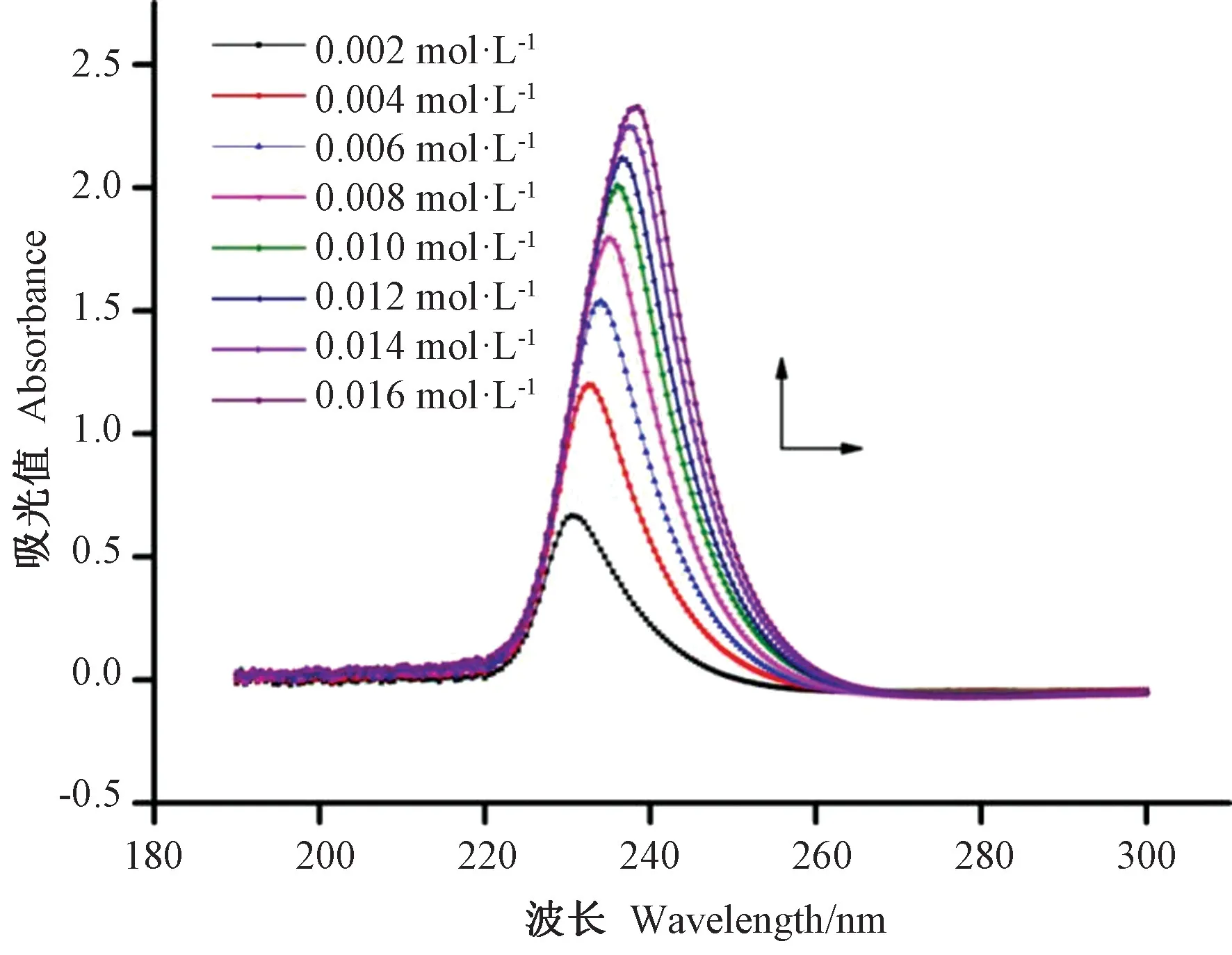
图4 不同浓度Na2SO3 与酪蛋白溶液体系的UV 光谱图Fig.4 Absorption spectra changes at various concentrations of casein + Na2SO3
2.5 Na2SO3、酪蛋白以及反应产物的FT-IR 分析
由图5 可知,酪蛋白在与Na2SO3反应后,FT-IR光谱发生了明显的变化,各处的吸收峰强度明显增强,且图谱中出现3 个新的吸收峰,即1 117.18、970.20和626.06 cm-1,这3 个峰分别归属于S-O 键的对称伸缩振动、不对称伸缩振动和弯曲振动,并且与磺酸基团最为接近[23]。因此,推测SO32-破坏了酪蛋白中的二硫键,生成RS-SO3H。此外,吸收Na2SO3后的酪蛋白在3 295.21、1 401.03 cm-1处吸收峰强度明显增强,研究表明,该处是氨基酸羧酸盐的特征吸收峰之一[21],表明酪蛋白部分羧基形成了羧酸盐。处理后的酪蛋白在酰胺Ⅰ带(1 700 ~1 600 cm-1)和酰胺Ⅱ带(1 600 ~1 500 cm-1)的吸收峰都明显增强,说明酪蛋白的二级结构发生了变化[24-25]。
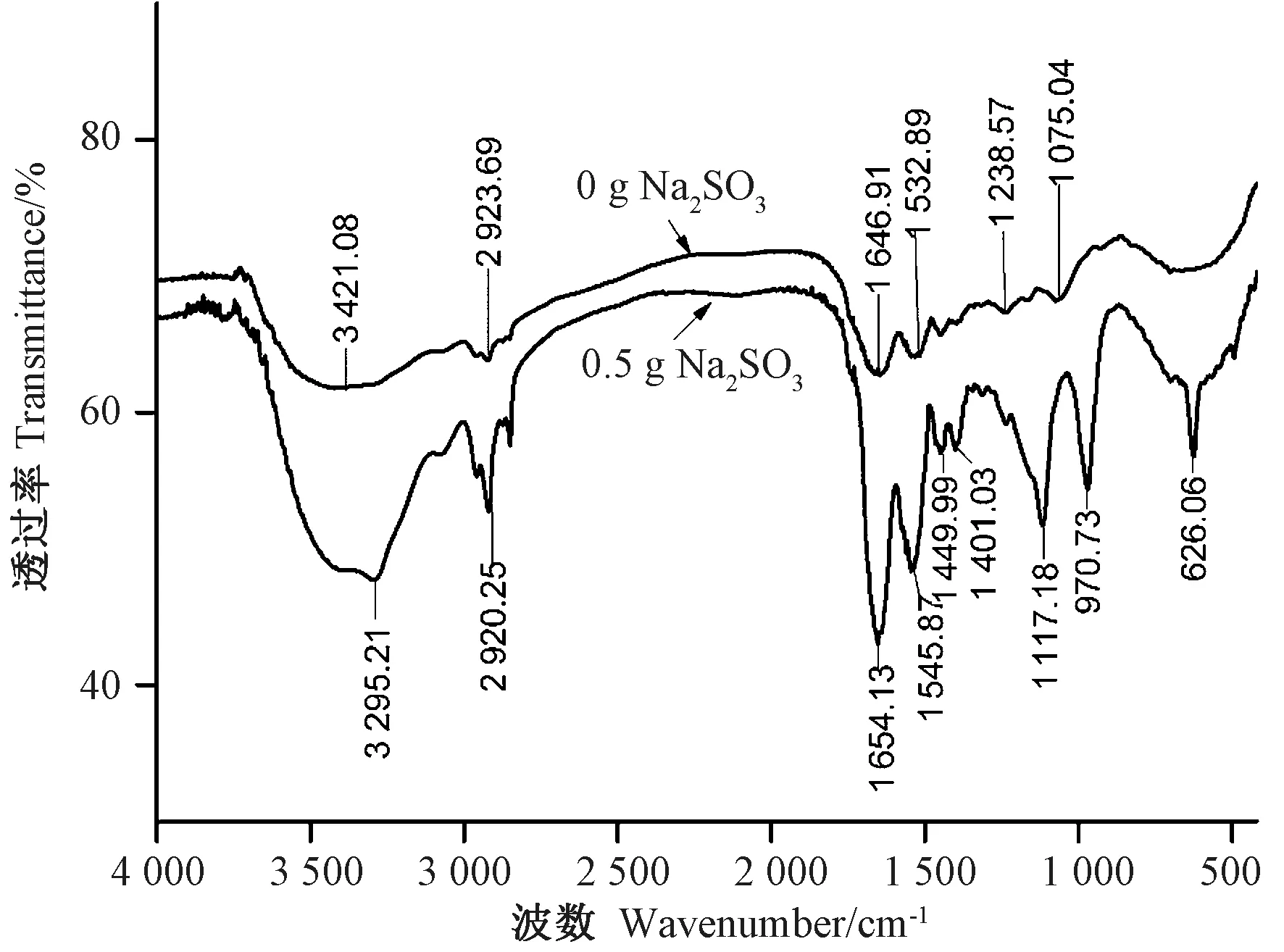
图5 酪蛋白结合Na2SO3 的FT-IR 光谱Fig.5 FT-IR spectra of Casein + Na2SO3
3 讨论
食品中脱除亚硫酸盐的方法大体可分为化学结合法、物理脱除法、氧化还原法和生物酶法等[26-27],每种方法各有优势。研究表明与蛋白质的氨基酸残基存在分子间相互作用[16],本研究利用酪蛋白与结合,脱除虾仁中的亚硫酸盐,脱除率达到84.13%,优于徐慧等[28]用清水冲洗、热水蒸煮等物理预处理方法的效果,但是略低于廖妙飞等[29]采用辐照法的结果。Lin 等[15]采用冰草叶绿体粗制剂脱除葡萄酒中的亚硫酸盐,其脱除率为93.00%;黄国平等[30]提取的水稻幼苗粗叶绿体对亚硫酸盐的脱除效率达到94.58%。本研究结果表明,与对照组相比,酪蛋白溶液处理能有效提高虾仁中亚硫酸盐的脱除率,虽然不及辐照方法和生物酶法的脱除效率,但是酪蛋白的安全性更高,成本更低。
本研究中,酪蛋白和Na2SO3溶液体系的紫外吸收光谱和红外光谱研究表明,两者之间除存在化学反应之外,可能还存在相互作用,如范德华力、氢键、静电作用力等,但本试验未深入研究。高飞[20]研究表明中的共轭体系受影响时,会使其紫外最大吸收峰发生蓝移。本研究显示,酪蛋白溶液中的吸收峰发生明显蓝移,说明其共轭体系可能被破坏,两者之间存在相互作用。此外,徐敏[16]利用荧光法研究发现,二氧化硫及其衍生物能通过疏水作用力和静电作用力与人血清蛋白的氨基酸残基(色氨酸、酪氨酸和苯丙氨酸)结合,从而淬灭蛋白质的内源荧光。本研究中酪蛋白的红外光谱测定结果与Sun 等[31]和Holt 等[32]的结果相似,但本研究还表明,经Na2SO3处理的酪蛋白,其结果发生变化,二硫键被破坏,并形成RS-SO3H。
4 结论
本研究探讨了酪蛋白溶液脱除虾仁中亚硫酸盐残留的可能性,结果表明,在4℃条件下,浸泡时间2.37 h,料液比1∶6.8 g·mL-1,酪蛋白浓度1.30 g·L-1,虾仁中亚硫酸盐脱除效果最佳,实际脱除率达到84.13%,处理后的虾仁能保持较好的质构品质。在传统的研究食品中亚硫酸盐脱除方法之外,探索了一个新的方向,酪蛋白溶液作为食品添加剂,处理安全性高,并能有效脱除虾仁中的亚硫酸盐残留,可为其他含硫食品中亚硫酸盐的脱除提供借鉴,在工业领域有潜在的商业应用。对脱除机理的初步研究发现,SO32-和酪蛋白分子之间可能存在相互作用,导致的电荷环境改变,使其紫外最大吸收峰发生蓝移。此外,FI-TR 光谱表明,能将酪蛋白中的二硫键还原,生成磺酸盐。本研究尚未对SO32-和酪蛋白分子的相互作用类型进行深入研究,未能阐明其结合类型,结合位点以及结合动力学等微观机理,后续在这方面的深入研究有助于开发更高效的亚硫酸盐脱除剂。
