HBV C编码链抗HBV潜在药物靶标的设计、筛选及鉴定
2020-02-28许桂丹肖树荣韦武均彭彬农顺强邓益斌
许桂丹 肖树荣 韦武均 彭彬 农顺强 邓益斌


【摘要】 目的 针对HBV C编码链设计合成反基因锁核酸(locked nucleic acid,LNA)片段,以HepG2.2.15细胞为研究对象,筛选并鉴定出能特异性阻断HBV复制和表达的有效治疗靶点药物。
方法 利用RNAstructure 5.0软件针对HBV C区编码链1914~1928 nt、1969~1983 nt、2002~2016 nt、2053~2067 nt、2069~2073 nt、2162~2176 nt和2404~2418 nt位点设计合成7条反基因LNA片段(分别以SQ1~SQ7表示),以阳离子脂质体lipofectamine 3000(lipo3000)介导转染HepG2.2.15细胞,隔3天对应给药,连续给药3次,分别于给药后第3、6、9 天收集培养上清液,采用酶联免疫吸附试验(ELISA)检测HBeAg水平;实时荧光定量聚合酶链反应技术(FQPCR)测定HBVDNA浓度。
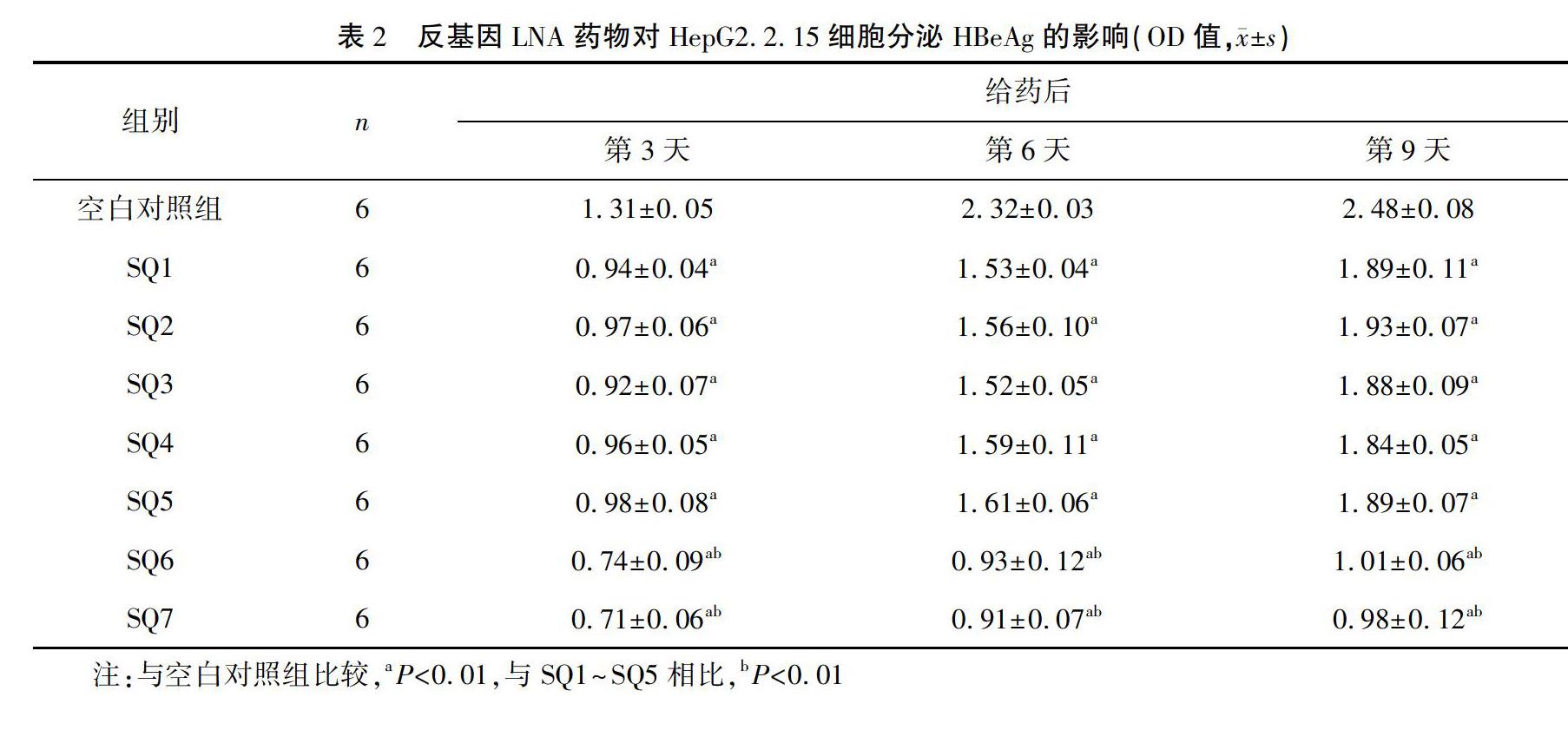
结果 针对HBV C区编码链2162~2176 nt(SQ6)和2404~2418 nt(SQ7)位点的反基因LNA片段对HBVDNA复制和HBeAg表达的抑制效果最明显,用药后第3、6、9天,SQ6对HBeAg的平均抑制率分别为43.91%、59.95%和59.07%,HBVDNA则分别为42.91%、50.09%和51.14%;SQ7对HBeAg的平均抑制率分别为44.18%、60.81%和60.02%,HBVDNA则分别为47.28%、54.16%和52.22%。
结论 针对HBV C区编码链2162~2176 nt和2404~2418 nt位点的反基因LNA片段体外能有效抑制HBV的复制和表达,为抗HBV治疗提供一定的理论依据和实验依据。
【關键词】 乙型肝炎;乙型肝炎病毒;锁核酸;基因治疗
中图分类号:R512.6+2 文献标志码:A DOI:10.3969/j.issn.10031383.2020.01.003
【Abstract】 Objective Antigene locked nucleic acid(LNA) fragment were designed and synthesized for the HBV C coding chain.HepG2.2.15 cells were used as the research object to screen and identify effective therapeutic target drugs that could specifically block HBV replication and expression.
Methods Using RNAstructure 5.0 software to design and synthesize 7 HBV C region coding strands 1914~1928 nt,1969~1983 nt,2002~2016 nt,2053~2067 nt,2069~2073 nt,2162~2176 nt and 2404~2418 nt loci.Antigenic LNA fragments(represented by SQ1 to SQ7,respectively) were transfected into HepG2.2.15 cells with cationic liposome lipofectamine 3000(lipo3000),and the corresponding administration was performed every 3 days,the administration was continued 3 times respectively.Culture supernatants were collected on days 3,6,and 9 after administration.HBeAg levels were measured with an enzymelinked immunosorbent assay(ELISA);HBVDNA concentration was measured by FQPCR.
Results Antigene LNA fragments targeting the 2162 to 2176 nt(SQ6) and 2404 to 2418 nt(SQ7) loci of the HBV C region coding chain have the most significant inhibitory effects on HBVDNA replication and HBeAg expression.The average inhibition rates of SQ6 on HBeAg were 43.91%,59.95%,and 59.07%;the average inhibiton rates on HBVDNA were 42.91%,50.09%,and 51.14%;the average inhibition rates of SQ7 on HBeAg were 44.18%,6081%,and 60.02%;the average inhibition rates on HBVDNA was 47.28%,54.16% and 52.22%,respectively.
Conclusion Antigenic LNA fragments targeting the 2162~2176 nt and 2404~2418 nt sites of the HBV C region coding chain can effectively inhibit HBV replication and expression in vitro,and provide theoretical and experimental support for antiHBV therapy.
【Key words】 Hepatitis B;hepatitis B virus;locked nucleic acid;gene therapy
HBV感染是全球性的健康问题,探索出彻底治愈乙肝的抗HBV特效药一直是乙肝相关研究的热点[1~2]。近年来,乙肝基因治疗引起人们的重视[3~4],但是目前国内外还没有探索出彻底清除HBV复制模板cccDNA的药物。针对HBV各靶点设计的基因药物抗HBV效果不断被报道[5~6],然而,针对HBV C保守区的反基因锁核酸(locked nucleic acid,LNA)片段对HBV复制和转录效果国内外至今尚未见报道。本研究利用生物信息学软件针对HBV C编码链设计反基因药物7条并进行LNA修饰,用lipofectamine 3000(lipo3000)介导转染HepG2.2.15细胞,采用酶联免疫吸附试验(ELISA)和实时荧光定量聚合酶链反应技术(FQPCR)技术对其潜在的抗HBV活性进行验证和筛选,旨在探索出新的抗HBV作用靶标,为新型抗病毒靶向药物的筛选提供理论和实验依据。
1 资料与方法
1.1 材料
HepG2.2.15细胞购自上海通派生物细胞库,于37℃、5%CO2条件下培养于10%胎牛血清的DMEM培养基中,2~3天换液1次,5~7天传代1次。双向通风超净工作台(Esco biotech);CO2培养箱(日本三洋 MCO18AIC);胎牛血清、DMEM培养基、OptiMEM培养基(Gibco);Lipofectamine 3000(Invitrogen);乙型肝炎病毒核酸定量测定试剂盒(湖南圣湘生物科技有限公司);HBeAg诊断试剂盒(珠海丽珠试剂股份有限公司);7500实时荧光定量PCR仪(ABI);正、倒置显微镜(Leica)。
1.2 方法
1.2.1 HBV C编码链的反基因LNA药物的设计与合成
HepG2.2.15细胞的HBV基因型为ayw型,利用RNAstructure 5.0软件,设计出互补于HBV C编码链的寡核苷酸片段7条(下文分别以SQ1~SQ7表示),Blast分析序列特征和同源性后,交由上海生物工程技术有限公司合成、纯化并进行LNA修饰。见表1。
1.2.2 反基因LNA的给药处理
1.2.2.1 转染前准备
将状态优良的对数生长期的HepG2.2.15细胞接种至6孔板中,每个孔加入1×105 cells/mL细胞浓度的细胞悬液2 mL,5% CO2、37℃条件下培养,细胞融合至50%~60%时可开始转染。6孔板先用PBS漂洗2次,以除尽完全培养基,再用OptiMEM培养基润洗1次。将6孔板的HepG2.2.15细胞随机分成8组,即SQ1~SQ7药物组和空白对照组,每组设6个复孔。
1.2.2.2 lipo3000包裹基因药物的配制
按照5 μg DNA∶7.5 μL lipo3000比例进行基因药物的配制。A液(10 cm2 6孔板一个孔的量):基因药物5 μg放入一个无菌离心管中,作好标记,用OptiMEM补足至125 μL。B液(10 cm2 6孔板一个孔的量):lipo3000转染试剂7.5 μL放入一个无菌离心管中,作好标记,用OptiMEM补足至125 μL。以上A液中各加5 μL的P3000,轻轻混匀。在另一个新的无菌离心管轻轻混合A液B液,作好标记,室温静置5 min,备用。
1.2.2.3 转染及处理
将配制好的药物对应加入上述备好的6孔板中,并用OptiMEM补足至2 mL,作好标记,5% CO2、37℃条件下培养6 h后,换正常完全细胞培养液。隔3天收集培养上清液后再次给药,连续给药3次,连续收集培养上清液3次。
1.2.3 培养上清液HBeAg的测定
采用ELISA方法检测,严格按试剂盒说明书操作,用酶标仪于450 nm波长处读取OD值。
1.2.4 培养上清液HBVDNA的测定
(1)试剂盒中各组分室温平衡后,混匀备用。(2)根据待测培养上清液、阳性对照、阴性对照以及定量参考品A~D总数量,按[(反应液38 μL+酶混合液2 μL+内标0.2 μL)/每人份]的比例取相应量的反应液、酶混合液及内标,充分混匀成PCR混合液,瞬时离心后备用。(3)PCR反应管中加入5 μL核酸释放剂,加入5 μL待测培养上清液,用枪头吹打5下,静置10 min(阴性对照、阳性对照以及定量参考品A~D同步处理)。(4)每管加入40 μL PCR混合液,盖上管盖(可用手指弹击,去除气泡),2000 rpm离心30 s。(5)PCR扩增:将扩增管放入ABI7500PCR仪中,循环条件如下:50℃ 2 min,94℃ 5 min;[94℃ 15 s→57℃ 31 s] 45cycles;25℃10 s。判斷实验结果有效后由计算机软件根据定量参考品和样本的荧光信号自动计算出HBVDNA含量。并按以下公式计算HBVDNA抑制率:抑制率=[(n空白组-n实验组)/n空白组]×100%。
1.3 统计学方法
应用SPSS 21.0统计学软件分析,计量资料符合正态分布,以均数±标准差(±s)表示,多个样本均数比较采用单因素方差分析,并根据方差齐性检验结果采用SNKq检验进行组间对比,组内不同给药时间的比较采用重复测量的方差分析,检验水准:α=0.05,双侧检验。
2 结果
2.1 反基因LNA给药后对HepG2.2.15细胞分泌HBeAg的影响
加入LNA药物后,SQ6和SQ7对HBeAg抑制效果最显著,给药后第3、6、9天,SQ6对HBeAg的平均抑制率分别为43.91%、59.95%和59.07%,SQ7对HBeAg的平均抑制率分别为44.18%、60.81%和60.02%(见表2及图1)。
2.2 反基因LNA给药后对HepG2.2.15细胞分泌HBVDNA的影响
给药后,SQ6和SQ7对HBVDNA抑制效果最显著,给药后第3、6、9天,SQ6对HBVDNA的平均抑制率分别为42.91%、50.09%和51.14%,SQ7则分别为47.28%、54.16%和52.22%(见表3及图2)。
3 讨论
抗HBV基因治疗,包括反义治疗、衣壳蛋白靶向灭活、显性负性突变体、反基因治疗、新型基因编辑等技术[7]。其中,新型基因编辑等技术是近几年的研究热点,二十几年的反义治疗是比较成熟的技术[8],它能显著抑制HBV复制,但是反义治疗技术主要针对mRNA,在翻译水平上阻断HBV,容易出现停药“反跳”问题。反基因治疗是由外源特定脱氧寡聚核苷酸与病毒双链DNA专一性结合形成三链DNA,从转录水平上阻断靶基因的复制与转录,与反义治疗策略相比,具有从源头阻断病毒基因复制与转录的优势。 LNA是核酸研究领域的新热点,它具有热稳定性和脂溶性好,分子杂交能力和抗核酸酶降解能力强以及细胞毒性低等优势[9]。
尽管血清型和基因型不同[10],HBV都是由约3.2 kb组成的具有包膜的部分双链松弛环状DNA嗜肝病毒,有P、X、S和C四个开放读码区,其中,S和C区序列在各型HBV间是十分保守的,因而是基因治疗的理想靶位。S 区包括前S1基因、前S2基因和S基因,课题组曾做过前S1基因的反基因LNA抗HBV效果研究[11],也做过S基因一些靶位的体内研究[5,12],结果证实前S1基因和S基因抗病毒效果均比较明显。同样作为保守区,C区包括C基因和前C基因,两者共同编码HBeAg和HBcAg,与HBV装配、成熟和分泌密切相关[13],以C区为靶点设计的反义LNA能有效抑制HBV的复制与表达[14],研究也证实,反基因治疗策略比反义治疗效果更显著[5,12]。因此,本研究根据反基因寡核苷酸的作用原理,设计出互补于HBV C编码链的寡核苷酸片段7条,并进行LNA修饰,旨在找出新的抗HBV作用靶标。由于该细胞株培养上清液HBV活性鉴定HBeAg和HBVDNA表达较高,而HBsAg表达偏低,其具体原因有待进一步研究,因此药效实验我们选用HBeAg、HBVDNA指标来评价。
lipo3000与lipo2000、XtremeGENE HP和FuGENE HD另外几种转染试剂相比,具有毒性低、转染高效、经济效益高的优势[15]。因此本研究选择lipo3000进行实验,按照7.5 μL lipo3000∶5 μg DNA的比例进行C编码链7个基因药物的转染,结果SQ6和SQ7对HBeAg和HBVDNA的抑制效果最显著,SQ6用药后第3、6、9天对HBeAg的平均抑制率分别为43.91%,59.95%和59.07%,SQ7则分别达44.18%、60.81%和60.02%;SQ6用药后第3、6、9天对HBVDNA的平均抑制率分别为42.91%、50.09%和51.14%,SQ7则分别为47.28%、54.16%和52.22%。
综上,针对HBV C区编码链2162~2176 nt和2404~2418 nt位点的反基因LNA片段在体外能有效抑制HBV的复制和转录,为抗HBV治疗提供一定的理论依据和实验依据。
参 考 文 献
[1]Leoni MC,Ustianowski A,Farooq H,et al.HIV,HCV and HBV:A Review of Parallels and Differences[J].Infect Dis Ther,2018,7(4):407419.
[2] Cruz LAB,Moraes MOA,QueirogaBarros MR,et al.Chronic hepatitis B virus infection drives changes in systemic immune activation profile in patients coinfected with Plasmodium vivax malaria[J].PLoS Negl Trop Dis,2019,13(6):e0007535.
[3]Dawood A,Abdul Basit S,Jayaraj M,et al.Drugs in Development for Hepatitis B[J].Drugs,2017,77(12):12631280.
[4]Soriano V.Hot News:Hepatitis B Gene Therapy Coming to Age[J].AIDS Rev,2018,20(2):125127.
[5]Xiao SR,Xu GD,Wei WJ,et al.Antiviral effects of hepatitis B virus S genespecific antigene locked nucleic acid in transgenic mice[J].World J Clin Cases,2018,6(8):183191.
[6]Godoy C,Tabernero D,Sopena S,et al.Characterization of hepatitis B virus X gene quasispecies complexity in monoinfection and hepatitis delta virus superinfection[J].World J Gastroenterol,2019,25(13):15661579.
[7]許桂丹,肖树荣,邓益斌.抗乙肝病毒基因治疗研究新进展[J].右江医学,2018,46(3):351354.
[8]Billioud G,Kruse RL,Carrillo M,et al.In vivo reduction of hepatitis B virus antigenemia and viremia by antisense oligonucleotides[J].J Hepatol,2016,64(4):781789.
[9]肖树荣,邓益斌.锁核酸在抗病毒基因诊断与治疗中的应用新进展[J].右江医学,2016,44(6):701706.
[10] 许桂丹,肖树荣,王春芳,等.桂西地区869例慢性乙型肝炎病毒基因分型与耐药突变分析[J].医学研究生学报,2018,31(11):11631166.
[11] 邓益斌,温旺荣.反基因锁核酸体外抑制乙肝病毒前S_1基因表达[J].基础医学与临床,2013,33(6):722725.
[12] 肖树荣,许桂丹,韦武均,等.针对乙型肝炎病毒S编码链的反基因锁核酸在转基因小鼠体内的抗病毒效果[J].中华肝脏病杂志,2018,26(1):1722.
[13] Wu W,Liu Y,Lin Y,et al.PreC and C Regions of Woodchuck Hepatitis Virus Facilitate Persistent Expression of Surface Antigen of Chimeric WHVHBV Virus in the Hydrodynamic Injection BALB/c Mouse Model[J].Viruses,2017,9(2):3546.
[14] 邓益斌,温旺荣.反义锁核酸在转基因小鼠体内阻断乙肝病毒C基因表达[J].基础医学与临床,2013,33(7):854858.
[15] 陈明明,李燕,张晓娟,等.3种转染试剂对牛原代骨骼肌卫星细胞转染条件的优化[J].中国畜牧兽医,2019,46(1):6271.
(收稿日期:2019-09-06 修回日期:2019-10-11)
(编辑:王琳葵 梁明佩)
