白茅苷抑制AKT的活化对宫颈癌细胞增殖、凋亡和线粒体膜电位的影响①
2020-02-20马志君曹振东邵雪斋申兴斌王晓芬
吉 洁 马志君 曹振东 邵雪斋 申兴斌 王晓芬
(承德医学院附属医院,承德 067000)
宫颈癌是发展中国家最常见的癌症类型之一,是世界第四位最常发生的妇科癌症[1]。宫颈癌的治疗是手术、化疗和放疗[2]。但由于癌症具有增殖,侵袭和迁移的强大能力,晚期宫颈癌患者的预后仍然较差,其5年生存率约为16.5%[3]。因此,靶向抑制增殖、侵袭和迁移的有效抗癌剂对宫颈癌患者具有高度科学和临床价值。白茅苷也称欧前胡素,是提取自中药白芷、独活和当归中的有效成分,具有散风除湿、通窍止痛、消肿排脓、解热镇痛、抗炎、抗肿瘤的功效[4]。已有研究表明欧前胡素通过靶向于Mcl-1增强多柔比星对宫颈癌细胞的杀伤活性[5],但白茅苷对宫颈癌治疗的具体机制仍尚不清楚。本文旨在研究白茅苷对宫颈癌细胞增殖,凋亡和线粒体膜电位的影响。
1 材料与方法
1.1材料 白茅苷(I6659)购自美国Sigma-Aldrich,化学式:C16H14O4,分子量:270.28,纯度≥98;Dulbecco′s modified Eagle′s medium培养基(12100-046)、胎牛血清(10082-147)、胰蛋白酶(25200-056)、青-链霉素(15140-122)购自美国Gibco公司;CCK-8试剂盒(C0037)、BCA蛋白浓度测定试剂盒(P0012S)、Annexin V-FITC细胞凋亡检测试剂盒(C1062S)购自上海碧云天生物技术研究所;Anti Ki67(ab15580)、PCNA(ab18197)、Bax(ab53154)、Bcl-2(ab196495)、AKT(ab18787)购自美国Abcam公司,宫颈癌SiHa细胞株来源于中国科学院典型培养物保藏委员会细胞库。
1.2方法
1.2.1细胞培养 细胞培养于10%胎牛血清和1%青-链霉素的高糖DMEM培养基中,并放置在37℃,5% CO2恒温培养箱中。培养基每2~3 d更换一次,当需要收集细胞时,用0.25%胰蛋白酶消化。试验用细胞为对数生长期细胞。
1.2.2CCK-8法检测细胞活力 将宫颈癌SiHa细胞接种于96孔板(100 μl/孔)孵育24 h后,用不同剂量(0、1、2.5、5、10、25、50、100、200、300、400、500 μmol/L)处理细胞,每孔加入10 μl CCK-8溶液孵育4 h,在450 nm处用酶标仪测定OD值。
1.2.3细胞分组 采用无显著毒性的25、50、100 μmol/L 进行后续实验,将细胞随机分为四组:对照组(0 μmol/L)、低剂量组(25 μmol/L)、中剂量组(500 μmol/L)、高剂量组(100 μmol/L)。
1.2.4克隆形成法检测细胞增殖 在培养皿中培养细胞至大约30%汇合度,继续培养4 d,吹散为单个细胞,用6孔板培养,约500个细胞每孔,培养14 d,弃掉培养基,用乙醇固定30 min,接着用0.5%结晶紫染色,用去离子水漂洗晾干,进行拍照观察。
1.2.5流式细胞仪检测细胞凋亡 收集悬浮细胞到10 ml的离心管中,每样本细胞数为3×106ml-1,500~1 000 r/min离心5 min,弃去培养液,用孵育缓冲液洗涤1次,500~1 000 r/min离心5 min,用100 μl的标记溶液重悬细胞,室温下避光孵育10~15 min,500~1 000 r/min离心5 min沉淀细胞孵育缓冲液洗1次,加入荧光(SA-FLOUS)溶液4℃下孵育20 min,避光,不时振动,流式细胞仪分析:流式细胞仪激发光波长用488 nm,用一波长为515 nm的通带滤器检测FITC荧光,另一波长大于560 nm的滤器检测PI。
1.2.6RT-PCR 用Trizol法从宫颈癌SiHa细胞中提取总RNA,用Nanodrop 分光广度计测定吸光度(A260/A280),按照试剂盒说明书进行cDNC的合成和PCR的扩增,反应条件为:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,扩增35个循环;72℃延长10 min;存储在4℃条件下。反应产物用2%琼脂糖凝胶电泳分离。
1.2.7线粒体膜电位 将各组细胞接种于6孔板后PBS清洗3次,孵育24 h,加入JC-1(5 μg/ml)室温避光反应30 min。用流式分选仪检测,记录红色和绿色荧光强度。
1.2.8Western blot 首先将各组待测细胞用PBS将清洗3次,再加入含蛋白酶抑制剂的细胞裂解液进行总蛋白提取,BCA试剂盒测定蛋白质含量;提取等量的蛋白质样品(20 mg),100℃变性5 min。然后进行SDS-PAGE凝胶电泳分离并转移至PVDF膜,5%的BSA室温封闭1~2 h后加入相应的一抗,4℃过夜孵育,次日,清洗后再加入辣根过氧化物酶标记的二抗,室温孵育1 h,清洗。最后加入发光液后,于凝胶成像仪进行曝光拍照,并用Image J软件统计灰度值计算相对表达量。GAPDH作为上样量参照,至少重复3个独立的实验。
1.2.9免疫荧光检测 将细胞接种于细胞爬片上,用PBS浸洗3次,每次3 min;用多聚甲醛固定15 min,用PBS浸洗3次,每次3 min。0.5%Triton X-100室温通透20 min,PBS浸洗3次,每次3 min,吸水纸吸干PBS,在玻片上滴加正常山羊血清,室温封闭30 min,吸掉封闭液,加入一抗,孵育过夜,PBS浸洗,避光加入荧光二抗,孵育1 h,PBS浸洗,滴加DAPI避光孵育5 min,用含荧光淬灭剂的封片液封片,于荧光显微镜下观察采集图像。
2 结果
2.1白茅苷抑制宫颈癌SiHa细胞活力 采用CCK-8检测宫颈癌SiHa细胞活力,结果如图1所示。与0 μmol/L剂量相比较,200、300、400和500 μmol/L 剂量细胞存活率显著降低(P<0.05)。
2.2白茅苷抑制宫颈癌SiHa细胞增殖 采用克隆形成法检测各组细胞增殖情况如图2所示。与Imperatorin 0 μmol/L组相比较,Imperatorin 50、100 μmol/L 组细胞增殖率显著降低(P<0.05)。
2.3白茅苷促进宫颈癌SiHa细胞凋亡 采用流式细胞仪检测各组细胞凋亡结果如图3所示。与Imperatorin 0 μmol/L组相比较,Imperatorin 50、100 μmol/L 组细胞凋亡率显著升高(P<0.05)。

图1 白茅苷对细胞活力的影响

图2 白茅苷对细胞增殖的影响
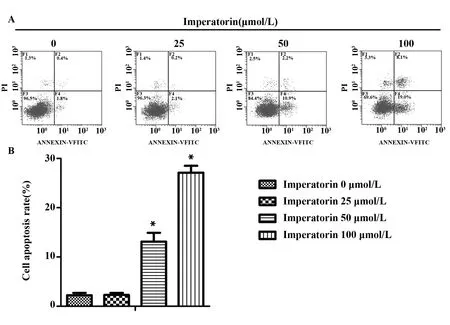
图3 白茅苷对细胞凋亡的影响

图4 白茅苷对线粒体膜电位的影响
表1 白茅苷对Ki67、PCNA、Bcl-2/Bax mRNA水平的影响
Tab.1 Effects of Imperatorin on mRNA levels of Ki67,PCNA and Bcl-2/Bax

GroupsKi67 mRNA(2-ΔΔCt)PCNA mRNA(2-ΔΔCt)Bcl-2/Bax Imperatorin 0 μmol/L113.36±0.54Imperatorin 25 μmol/L0.95±0.120.98±0.072.09±0.321)Imperatorin 50 μmol/L0.64±0.541)0.53±0.061)0.82±0.081)Imperatorin 100 μmol/L0.17±0.611)0.22±0.041)0.15±0.041)
Note:Compared with Imperatorin 0 μmol/L,1)P<0.05.
2.4白茅苷降低Ki67、PCNA、Bcl-2/Bax mRNA水平 采用RT-PCR检测各组细胞Ki67、PCNA、Bcl-2/Bax mRNA水平,结果如表1所示。与Imperatorin 0 μmol/L组相比较,Imperatorin 50、100 μmol/L组Ki67、PCNA、Bcl-2/Bax mRNA水平显著降低(P<0.05)。

图5 白茅苷对AKT磷酸化的影响
2.5白茅苷降低宫颈癌SiHa细胞线粒体膜电位 采用流式分选检测细胞线粒体膜电位的变化结果如图4所示。Imperatorin 50、100 μmol/L组较Imperat-orin 0 μmol/L组细胞线粒体膜电位明显降低。
2.6白茅苷抑制AKT磷酸化 采用Western blot检测p-AKT/AKT比值结果如图5A所示,与Imperatorin 0 μmol/L组相比较,Imperatorin 25、 50、100 μmol/L组p-AKT/AKT比值显著降低(P<0.05);采用免疫荧光检测AKT的细胞定位情况结果如图5B所示,与Imperatorin 0 μmol/L组相比较,Imperatorin 25、 50、100 μmol/L组荧光表达显著降低(P<0.05)。
3 讨论
宫颈癌是妇科肿瘤中发病率最高的恶性肿瘤之一,其发病率呈现上升趋势,严重威胁女性健康[6]。由于宫颈癌目前的一线化疗药物,如多柔比星、顺铂在经过重复用药啊,肿瘤细胞往往会产生耐药性[7]。因此,针对宫颈癌发病机制,需要探寻新型有效的抗宫颈癌药物。白茅苷是从白芷根中提取的香豆素类天然活性物质,据报道白茅苷对多种肿瘤具有抑制作用[8]。
宫颈癌难以治疗的原因之一是由于癌细胞的无限增殖。增殖细胞核抗原(PCNA)、Ki-67是与细胞增殖相关的核抗原,是近年来广泛应用的细胞增生标记物,PCNA是DNA聚合酶的一种辅蛋白,其与细胞增殖加快密切相关[9]。Ki-67为增殖细胞核相关抗原,是反映细胞增殖状态的理想标记物[10]。本文研究发现,白茅苷具有抑制宫颈癌SiHa细胞增殖,降低PCNA、Ki-67 mRNA水平的作用。说明白茅苷通过抑制细胞增殖对宫颈癌具有治疗作用。
凋亡即细胞的程序性死亡,是在组织发育和体内平衡中起关键作用的基本生理过程,细胞凋亡通过消除旧的、不必要的和患病的细胞在体内发育和维持中起关键作用[11]。细胞凋亡主要有外源性凋亡途径、内源性凋亡途径和内质网应激途径[12],内在凋亡途径中的关键事件是线粒体外膜的透化,其响应于各种刺激而发生,并且受若干细胞质蛋白调节,包括Bcl-2家族成员[13]。抗细胞凋亡成员Bcl-2,可防止细胞凋亡,而促凋亡成员Bax位于线粒体外膜或细胞质,并在应激下寡聚化,促进线粒体释放因子,从而引发细胞凋亡[14]。诱导细胞凋亡的药剂可能是宫颈癌治疗的理想药物,Sikander等[15]研究发现葫芦素D通过促进宫颈癌细胞凋亡对宫颈癌具有治疗作用。Tsai等[16]研究发现甘草查尔酮A通过促进宫颈癌SiHa细胞凋亡治疗宫颈癌。本文研究发现白茅苷具有促进宫颈癌SiHa细胞凋亡,降低Bcl-2/Bax比值的作用,提示白茅苷对宫颈癌具有治疗作用。
线粒体是一种存在于大多数细胞中有两层膜包被的细胞器,是细胞中制造能量的结构。线粒体通透性孔的转换对细胞的凋亡有着至关重要的作用,一旦线粒体通透性孔打开,小分子和离子就会流进线粒体,导致线粒体膜电位的改变[17]。线粒体膜内外的电势差降低,可引起线粒体一系列的生化反应,如诱导细胞色素C释放,活化caspase蛋白酶家族,线粒体膜通透性改变,凋亡诱导因子AIF释放等,引起细胞凋亡的级联反应,导致细胞凋亡。马依努尔等[18]研究发现异甘草素通过降低线粒体膜电位抑制宫颈癌SiHa细胞增殖。刘志刚等[19]研究发现丹参酮ⅡA通过降低线粒体膜电位抑制SiHa细胞增殖并诱导其凋亡。本文研究发现白茅苷具有降低宫颈癌SiHa线粒体膜电位的作用,提示白茅苷抑制细胞增殖,促进细胞凋亡可能是通过降低线粒体膜电位实现的。
Akt及其信号通路是基础研究和药物研发领域中最热门的激酶和激酶通路之一[20]。PI3K/AKT信号通路在细胞增殖与凋亡的异常调节途径中发挥重要作用,AKT在该通路中起核心作用,活化的AKT通过作用下游效应分子,使细胞存活、增殖、抑制凋亡,与肿瘤的发生、侵袭转移密切相关[21]。本文研究发现,白茅苷具有降低宫颈癌细胞SiHa细胞p-AKT/AKT比值、AKT荧光表达的作用,说明白茅苷通过抑制AKT的活化调节宫颈癌细胞SiHa的增殖、凋亡和线粒体膜电位。
综上所述,本文揭示了白茅苷对宫颈癌细胞SiHa的影响:抑制细胞增殖,促进细胞凋亡,降低Ki67、PCNA、Bcl-2/Bax mRNA水平,降低线粒体膜电位,降低p-AKT/AKT比值、AKT荧光表达。为白茅苷临床应用治疗宫颈癌提供了实验依据。
