鸭坦布苏病毒病灭活疫苗血清学试验与免疫攻毒保护试验的相关性
2020-01-14王小蕾林健杨志远刘立新段会娟程慧敏赵际成潘洁刘月焕
王小蕾,林健,杨志远,刘立新,段会娟,程慧敏,赵际成,潘洁,刘月焕
鸭坦布苏病毒病灭活疫苗血清学试验与免疫攻毒保护试验的相关性
王小蕾,林健,杨志远,刘立新,段会娟,程慧敏,赵际成,潘洁,刘月焕
(北京市农林科学院畜牧兽医研究所,北京 100097)
【】评价鸭坦布苏病毒病灭活疫苗2种效力评价方法平行关系,为采用血清学检验技术替代鸭坦布苏病毒病灭活疫苗本动物攻毒效力检验奠定基础。3批疫苗实验室制品分别以0.15、0.3、0.5、1.0 mL经肌肉注射途径免疫51日龄青年鸭和260日龄产蛋鸭,首次免疫后14 d,按相同的剂量和途径进行二次免疫。二免后28日采血,分离血清并测定血清的HI抗体效价,根据抗体效价对试验鸭分组,并分别经肌肉注射途径接种0.5 mL(100 DID50)的鸭坦布苏病毒。攻毒后2 d采血,分离病毒,产蛋鸭攻毒后8 d剖检,观察卵巢病变。比较和分析HI抗体效价和攻毒保护结果的相关性。免疫青年鸭HI抗体效价≤1﹕5、1﹕10、1﹕20、1﹕40、1﹕80、1﹕160、1﹕320、1﹕640组保护率分别为50%(20/40)、43.8%(7/16)、74.3%(26/35)、86.7%(26/30)、96.6%(57/59)、92.7%(51/55)、95%(38/40)和100%(11/11),HI抗体效价低于1﹕20时攻毒保护率为48.2%,效价1﹕20时攻毒保护率为74.3%,效价1﹕40及以上时攻毒保护率达93.8%。免疫产蛋鸭HI抗体效价≤1﹕5、1﹕20、1﹕40和1﹕80组保护率分别为66.7%(12/18)、83.3%(10/12)、95.2%(20/21)和100%(15/15);HI抗体效价1﹕10、1﹕160、1﹕320和1﹕640组保护比例分别为2/3、7/7、1/1和2/2;HI抗体效价为1﹕10及以下时攻毒保护率为66.7%,效价1﹕20时攻毒保护率为83.3%,效价1﹕40及以上时攻毒保护率达97.8%。青年鸭和产蛋鸭的HI抗体效价与攻毒保护率之间均有极显著的正相关性,Spearman相关系数分别为0.905(<0.01)和0.932(<0.01)。鸭坦布苏病毒病灭活疫苗(HB株)免疫后HI抗体与攻毒保护率存在正相关,可替代免疫攻毒法用于鸭坦布苏病毒病灭活疫苗的效力评价,初步将HI抗体效价1﹕20定为鸭坦布苏病毒病灭活疫苗免疫后产生抗体保护的标准。
鸭坦布苏病毒;HI试验;抗体效价;免疫攻毒;相关性
0 引言
【研究意义】鸭坦布苏病毒病是由鸭坦布苏病毒(duck Tembusu virus,DTMUV)引起的、近年来国内流行的、急性、高度接触性的一种新型鸭传染病[1-3]。该病2010年春夏首次在浙江暴发,随后迅速蔓延至福建、上海、江西、安徽、山东、河北、河南、北京等多个养鸭地区,多个品种的鸭发病[4-5],给养鸭业带来巨大损失。疫苗免疫接种是控制传染病最为经济和有效的措施之一。我国研究人员在疫苗的研究方面开展了大量的研究工作,先后研制成鸭坦布苏病毒病灭活疫苗和活疫苗[6-9]。现有的鸭坦布苏病毒病灭活疫苗(HB株)的效力评价方法为本动物免疫攻毒法(病毒分离法和产蛋鸭卵巢病理变化检查法),该方法存在过程繁杂、检验周期长、使用负压动物舍成本高等缺点。对禽流感、新城疫等多种疫苗的研究证实,动物免疫后的血清抗体效价与攻毒保护具有相关性[10-16],因而血清学检测方法是效力检验免疫攻毒法的替代方法之一。血凝抑制(Hemagglutination Inhibition test,HI)试验是常用的血清学检测方法之一,检测结果准确、操作简便快速、成本较低、便于推广应用,在禽流感、新城疫等病毒的抗体检测中有广泛应用[17-18]。中国兽药典收录的鸡新城疫、减蛋综合征、禽流感灭活疫苗组分的血清学效力检验也采用HI效价测定[19]。目前尚无用于评价鸭坦布苏病毒病灭活疫苗(HB株)效力的血清学方法。将HI方法应用于鸭坦布苏病毒病灭活疫苗(HB株)免疫抗体的测定,研究HI抗体效价与疫苗免疫保护效果的相关性,以期用HI抗体效价测定法替代疫苗现有的本动物免疫攻毒效力检验方法,具有重要的应用价值。【前人研究进展】鸭坦布苏病毒为黄病毒科黄病毒属成员[20]。在血清学抗体检测技术方面,已有鸭坦布苏病毒ELISA抗体检测方法的研究[21-23]和一种用于快速检测抗体的乳胶凝集诊断方法[24]。黄病毒属的成员多数具有血凝性[25],鸭坦布苏病毒经蔗糖-丙酮处理后具有血凝性,可用于血凝抑制试验。笔者前期建立了鸭坦布苏病毒HI抗体检测方法[26]。【本研究切入点】鸭坦布苏病毒病灭活疫苗(HB株)免疫鸭后,利用前期研制的HI抗原测定血清中的HI抗体,将不同抗体效价的鸭分组并进行攻毒,通过攻毒保护的结果分析HI抗体效价和攻毒保护的相关性。【拟解决的关键问题】HI抗体效价测定法能否替代免疫攻毒法用于鸭坦布苏病毒病灭活疫苗的效力评价。
1 材料与方法
本研究于2016年2月至2017年8月在北京市农林科学院畜牧兽医研究所完成。
1.1 材料
1.1.1 疫苗 鸭坦布苏病毒病灭活疫苗(HB株),批次见表1。
1.1.2 病毒 鸭坦布苏病毒HB株(DTMUV-HB)F4代,由北京市农林科学院畜牧兽医研究所分离、鉴定和保存,DID50为107.7/0.5mL。
1.1.3 鸭坦布苏病毒血凝抑制试验抗原 由北京市农林科学院畜牧兽医研究所研制,相关试剂由北京市农林科学院畜牧兽医研究所提供。
1.1.4 实验动物 6—8周龄北京鸭,购自北京南口北京鸭育种中心;产蛋樱桃谷鸭(约260日龄),购自河北安新某鸭场。免疫前DTMUV HI抗体均为阴性。
1.1.5 6日龄SPF鸡胚 购于北京勃林格殷格翰实验动物技术有限公司。
1.1.6 鹅红细胞 采自北京周边养殖场的健康鹅。
1.1.7 96孔U型微量板 购自Greiner公司。
1.1.8 负压动物舍 由瑞普(保定)生物药业有限公司提供,实验动物许可证SYXK(冀)2015-0045。
1.2 分组、免疫及攻毒
试验鸭用芯片标记,各批疫苗分别以0.15、0.3、0.5或1.0 mL/只的剂量经胸部肌肉接种,设相同日龄的非免疫对照组。疫苗首次免疫后14 d,按照相同剂量和方法进行二次免疫,二次免疫后28 d采血,同时攻毒,每只鸭注射DTMUV-HB病毒液0.5 mL(含100个DID50)。试验鸭免疫后饲养在北京市顺义区木林镇某鸭场,攻毒前运至瑞普(保定)生物药业有限公司。各批疫苗分次进行试验(表1)。

表1 免疫疫苗批次、剂量与免疫数量
1.3 病毒分离
攻毒后2日采血,分离血清,用于病毒分离。以每胚0.1 mL的剂量经卵黄囊途径接种6日龄SPF鸡胚,每只鸭血清接种5枚鸡胚,接种后24 h死亡的鸡胚弃去,将接种后24—72 h死亡的鸡胚且DTMUV核酸RT-PCR阳性胚判为DTMUV感染死亡鸡胚。只要有1枚鸡胚感染,即判这只鸭病毒分离阳性,为发病鸭。
1.4 鸭坦布苏病毒的RT-PCR检测
采用RNAiso Plus(宝生物工程(大连)有限公司)从死亡鸡胚中按说明书提取RNA,使用TakaRa RNA PCR Kit (AMV) Ver 3.0(宝生物工程(大连)有限公司)进行RT-PCR检测,理论扩增片段长度988 bp。引物序列如下:
DTMUV-F: 5′-TCA AGG AAC TCC ACA CAT GAG ATG TAC T -3′;
DTMUV-R: 5′-GTG TCC CAT CCT GCT GTG TCA TCA GCA TAC A-3′。
1.5 卵巢病理变化观察
产蛋鸭攻毒后8 d剖检,观察卵巢病理变化。卵泡具有变形或出血病变之一,判为病变卵泡。输卵管内无蛋且有3个及以上病变卵泡,判为病变卵巢。遇到卵泡数低于3个的鸭,如有病变卵泡,也判为病变卵巢。出现病变卵巢的鸭判为发病[27]。
1.6 HI抗体测定
血清前处理及HI操作方法见文献[26]。
1.7 数据分析
将每只鸭的HI抗体效价和攻毒保护情况(病毒分离结果或卵巢病理变化观察结果)进行一一对应,统计不同HI抗体效价对应的保护率,通过SPSS 20采用spearman相关系数分析HI抗体效价和攻毒保护率的相关性。
2 结果
2.1 青年鸭
免疫鸭的血清病毒分离结果阴性判为保护。剔除试验过程中意外死亡或未分离出血清进行病毒分离的实验鸭,共有286只免疫鸭的结果可用。各批次疫苗免疫青年鸭HI抗体效价与攻毒保护的结果见表2,抗体在≤1:5、1:10、1:20、1:40、1:80、1:160、1:320、1:640时保护率分别为50%(20/40)、43.8%(7/16)、74.3%(26/35)、86.7%(26/30)、96.6%(57/59)、92.7%(51/55)、95% (38/40)和100% (11/11)。对照组总发病率为100%(40/40)。对青年鸭HI抗体效价与攻毒保护率进行相关性分析,HI抗体与保护率的Spearman相关系数为0.905 (<0.01),说明两者呈极显著正相关。青年鸭免疫后HI抗体效价低于1:20时攻毒保护率仅为48.2%(27/56),效价1:20时攻毒保护率为74.3%(26/35),效价1:40及以上时攻毒保护率达93.8%(183/195)。
2.2 产蛋鸭
剔除试验过程中意外死亡及非产蛋期鸭(产蛋停止期),共有79只免疫鸭的结果可用。汇总各批次疫苗免疫产蛋鸭的HI抗体效价与攻毒保护结果(表2),HI抗体效价≤1:5、1:20、1:40和1:80组保护率分别为66.7%(12/18)、83.3%(10/12)、95.2%(20/21)和100%(15/15);HI抗体效价1:10、1:160、1:320和1:640组保护比例分别为2/3、7/7、1/1和2/2。对照组总发病率为90%(18/20)。对产蛋鸭HI抗体效价与攻毒保护率进行相关性分析,两者的Spearman相关系数为0.932(<0.01),表明两者有极显著正相关。产蛋鸭免疫后HI抗体效价为1:10及以下时攻毒保护率为66.7%(14/21),效价1:20时攻毒保护率为83.3%(10/12),效价1:40及以上时攻毒保护率达97.8%(45/46)。
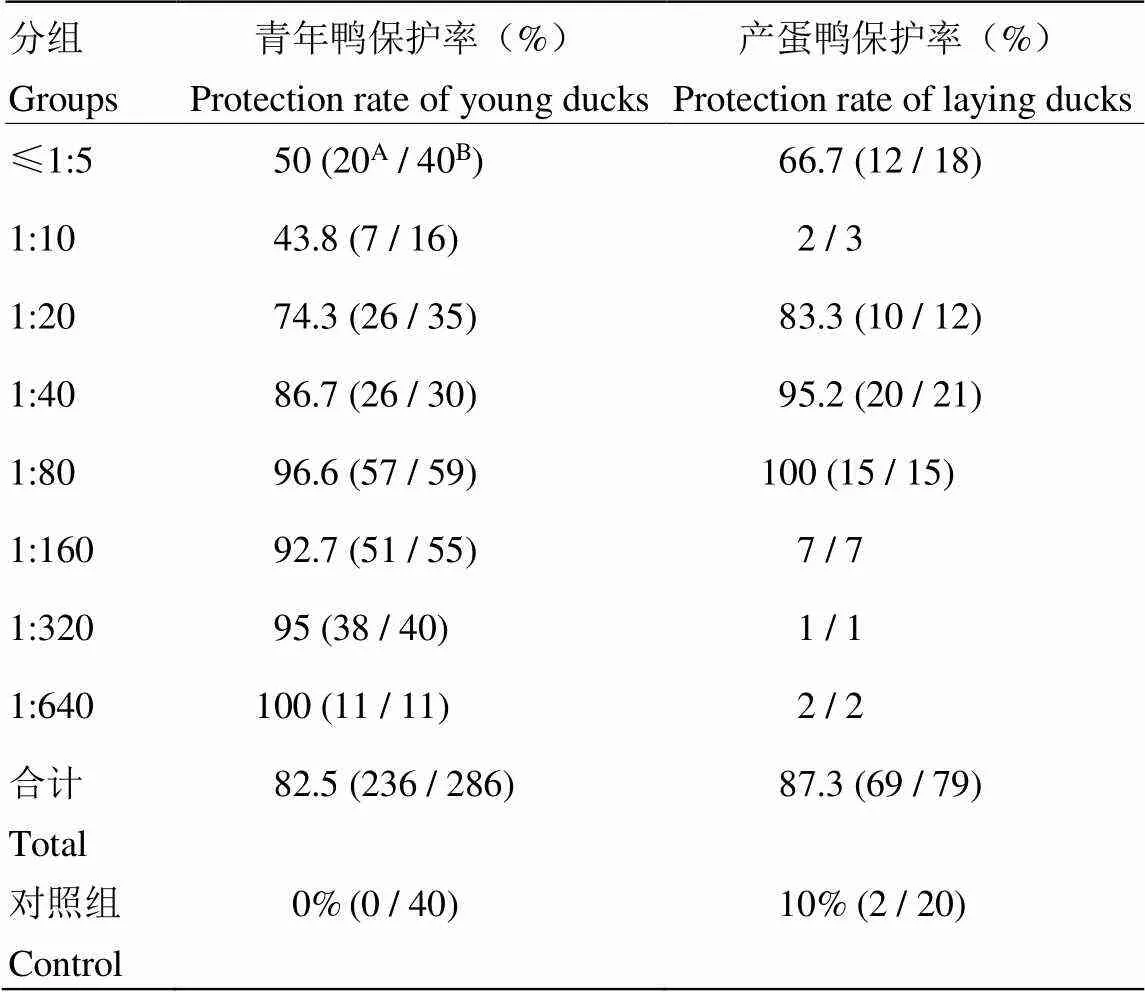
表2 青年鸭、产蛋鸭HI抗体效价及攻毒保护结果
A为免疫保护的只数,B为总只数
A is the number of immunoprotection, B is the total number
3 讨论
在兽用疫苗免疫效力的各种评价方法中,基于免疫学原理的动物免疫攻毒法等动物试验法仍然是最令人信服的评价方法。据统计《中国兽药典( 2010年版)》中收载的80个兽用疫苗(40个活疫苗和40个灭活疫苗)中,用动物进行安全或效力检验的产品为100%。但是由于动物试验法存在动物供应不足(尤其是大动物和特殊要求的动物)、动物标准不完善致使质量无法保证、免疫攻毒试验过于频繁存在生物安全隐患等问题,国家鼓励采用疫苗本动物免疫攻毒效力检验的方法对疫苗进行效力评价[28]。疫苗本动物免疫攻毒效力检验的替代技术是兽用生物制品科技创新的关键技术创新内容之一,目前应用较多的替代方法主要有实验动物替代法、血清学替代法(体内和体外)和疫苗抗原定量法[29-30]。对于灭活疫苗,免疫动物后采集免疫血清测定其中特异性抗体滴度的效力检验方法研究相对较多,对禽流感、新城疫、口蹄疫等多种灭活疫苗的研究证实,动物免疫后的血清抗体效价与攻毒保护具有相关性[14-16, 31]。前期笔者研制成鸭坦布苏病毒HI试验抗原并建立了鸭坦布苏病毒HI抗体检测方法,该方法敏感性和特异性高,操作方便,结果易于判读,可以定量检测抗体效价。这为利用HI方法进行鸭坦布苏病毒病灭活疫苗(HB株)的效力评价奠定了基础。
本研究测定了疫苗免疫青年鸭和产蛋鸭后产生的HI抗体效价,根据抗体效价对免疫鸭分组并进行攻毒。青年鸭HI抗体效价与攻毒保护率之间的Spearman相关系数为0.905(<0.01);免疫后HI抗体低于1:20时攻毒保护率为48.2%;效价1:20时攻毒保护率为74.3%;效价1:40及以上时攻毒保护率为93.8%。产蛋鸭的HI抗体效价与攻毒保护率之间的Spearman相关系数为0.932(<0.01);免疫后HI抗体效价在1:10及以下时攻毒保护率为66.7%;效价1:20时攻毒保护率为83.3%;效价1:40及以上时攻毒保护率达97.8%。试验结果表明,青年鸭和产蛋鸭的HI抗体效价与攻毒保护率之间均有极显著的正相关性。个别HI抗体效价高的试验鸭攻毒后发病,分析可能与鸭个体差异有关。同禽流感和新城疫等疫苗采用HI抗体效价测定方法一样,鸭坦布苏病毒病灭活疫苗效力评价也可以用测定HI抗体效价方法替代本动物免疫攻毒法。初步将HI抗体效价1:20定为鸭坦布苏病毒病灭活疫苗免疫后产生抗体保护的标准。
4 结论
鸭坦布苏病毒病灭活疫苗(HB株)免疫后HI抗体与攻毒保护率之间存在正相关性,HI抗体效价测定法可替代免疫攻毒法用于鸭坦布苏病毒病灭活疫苗的效力评价。
[1] SU J, LI S, HU X, YU X, WANG Y, LIU P, LU X, ZHANG G, HU X, LIU D, LI X, SU W, LU H, MOK N S, WANG P, WANG M, TIAN K, GAO G F. Duck egg-drop syndrome caused by BYD virus, a new Tembusu-related flavivirus., 2011, 6(3): e18106.
[2] CAO Z, ZHANG C, LIU Y, LIU Y, YE W, HAN J, MA G, ZHANG D, XU F, GAO X, TANG Y, SHI S, WAN C, ZHANG C, HE B, YANG M, LU X, HUANG Y, DIAO Y, MA X, ZHANG D. Tembusu virus in ducks, china., 2011, 17(10): 1873-1875.
[3] YAN P, ZHAO Y, ZHANG X, XU D, DAI X, TENG Q, YAN L, ZHOU J, JI X, ZHANG S, LIU G, ZHOU Y, KAWAOKA Y, TONG G, LI Z. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China., 2011, 417(1): 1-8.
[4] 刘建涛, 孙法良, 杨同涛, 崔京腾, 宁明刚. 再谈鸭黄病毒病. 家禽科学, 2017(9): 44-46.
LIU J T, SUN F L, YANG T T, CUI J T, NING M G. Re-discussion on duck flavivirus disease., 2017(9): 44-46. (in Chinese).
[5] 张大丙. 鸭出血性卵巢炎的研究进展. 中国家禽, 2011, 33(14): 37-38.
ZHANG D B. Research progress of duck hemorrhagic ovaritis., 2011, 33(14): 37-38. (in Chinese).
[6] LIN J, LIU Y, WANG X, YANG B, HE P, YANG Z, DUAN H, XIE J, ZOU L, ZHAO J. Efficacy evaluation of an inactivated duck Tembusu virus vaccine., 2015, 59(2): 244-248.
[7] LI G, GAO X, XIAO Y, LIU S, SHAN P, LI X, YING S, ZHANG Y, LEI Y, WU X. Development of a live attenuated vaccine candidate against duck Tembusu viral disease., 2014, 450-451(1): 233-242.
[8] 张欣. 坦布苏病毒SDS-70株弱毒苗的制备及安全性与免疫效力的初步评价[D]. 泰安: 山东农业大学, 2017.
ZHANG X. The preparation, safety and efficacy study of an attenuated live SDS-70 duck Tembusu virus strain[D]. Taian: Shandong Agricultural University, 2017. (in Chinese)
[9] 章丽娇. 鸭坦布苏病毒细胞适应毒免疫原性及致弱分子基础研究[D]. 北京: 中国农业大学, 2017.
ZHANG L J. Immunogenicity and molecular basis for attenuation of BHK-21 cell-adapted duck tembusu virus[D]. Beijing: China Agricultural University, 2017. (in Chinese)
[10] 常超, 姜宇. 鸡新城疫活疫苗血清学效力检验与靶动物免疫攻毒保护结果相关性试验. 饲料博览, 2018(4): 36-37.
CHANG C, JIANG Y. Newcastle disease live vaccine serological efficacy test and the correlation test of the protective results of target animal immune attack., 2018, (4): 36-37. (in Chinese)
[11] 潘杰, 秦涛, 范娟, 刘俊斌, 马若楠, 阴银燕. 血清抗体检测代替攻毒保护法评估小鹅瘟灭活疫苗免疫效果的比较研究. 中国家禽, 2018, 40(16): 53-55.
PAN J, QIN T, FAN J, LIU J B, MA R N, YIN Y Y. A comparative study on the immune efficacy of inactivated gosling plague vaccine evaluated by serum antibody detection and by the challenging test., 2018, 40(16): 53-55. (in Chinese)
[12] 李新生, 彭志领, 李燕, 孟迪, 高文明, 崔保安. 鸡新城疫、传染性支气管炎和禽流感(H9)联合免疫血清学效力与攻毒保护关系. 中国兽医学报, 2014, 34(6): 869-873.
LI X S, PENG Z L, LI Y, MENG D, GAO W M, CUI B A. The relationships of serological efficacy with the attack against newcastle disease virus, infectious bronchitis virus and avian influenza (H9) virus., 2014, 34(6): 869-873. (in Chinese)
[13] 藏玉婷, 张春媛. 猪传染性胃肠炎、猪流行性腹泻二联灭活疫苗血清学效力检验与靶动物免疫攻毒保护相关性研究. 饲料博览, 2018(3): 27-31.
ZANG Y T, ZHANG C Y. Correlation research of the antibody titer and virus attack protection of porcine transmissible gastroenteritis and porcine epidemic diarrhea inactivated vaccine., 2018(3): 27-31. (in Chinese)
[14] 李慧姣, 蒋桃珍, 李启红, 谷红, 吴涛. 鸡新城疫灭活疫苗免疫攻毒试验与血清学(HI)试验的平行关系研究. 中国兽药杂志, 2004(8): 5-8.
LI H J, JIANG T Z, LI Q H, GU H, WU T. Studies on the relationship of challenge against newcastle disease and serology (HI) test., 2004(8): 5-8. (in Chinese)
[15] 王红琳, 汪宏才, 杨峻, 温国元, 罗青平, 罗玲, 艾地云, 张蓉蓉, 张腾飞, 邵华斌. 禽霍乱、新城疫二联灭活疫苗免疫攻毒试验与HI试验的平行关系研究. 中国家禽, 2016, 38(2): 42-43.
WANG H L, WANG H C, YANG J, WEN G Y, LUO Q P, LUO L, AI D Y, ZHANG R R, ZHANG T F, SHAO H B. Parallel relationship between immune challenge test and HI test of avian cholera and Newcastle disease inactivated vaccine., 2016, 38(2): 42-43. (in Chinese)
[16] 白军, 刘淑红, 焦铁军, 王运宏, 黄建斌, 李河林, 马建玲, 赵希斌, 于三科. 鸡新城疫、禽流感(H9亚型)二联油乳剂灭活疫苗免疫效力试验. 动物医学进展, 2013, 34(3): 58-61.
BAI J, LIU S H, JIAO T J, WANG Y H, HUANG J B, LI H L, MA J L, ZHAO X B, YU S K. Immune potency test of combined oil adjuvant inactivated vaccine against Newcastle disease and avian influenza (H9 Subtype)., 2013, 34(3): 58-61. (in Chinese)
[17] 舒跃龙, 王敏, 张烨, 李梓, 郭俊峰, 郭元吉. 一种敏感的H5禽流感病毒血凝抑制试验方法. 公共卫生与预防医学, 2007(2): 9-10.
SHU Y L, WANG M, ZHANG Y, LI Z, GUO J F, GUO Y J. A more sensitive HI method for H5 avian influenza serum test., 2007(2): 9-10. (in Chinese)
[18] 文英. 青海省部分地区鸡新城疫与传染性支气管炎免疫抗体检测与分析[D]. 杨凌: 西北农林科技大学, 2009.
WEN Y. Detection and analysis of chiken serum antibody levels against Newcastle disease and avian infectious bronchitis in partial area of Qinghai Province[D]. Yangling: Northwest A&F University, 2009. (in Chinese)
[19] 中华人民共和国兽药典(三部). 2015版. 北京: 中国农业出版社, 2016.
Veterinary Pharmacopoeia of the People's Republic of China (III). 2015. Beijing: China Agricultural Publishing House, 2016. (in Chinese)
[20] ZHANG W, CHEN S, MAHALINGAM S, WANG M, CHENG A. An updated review of avian-origin Tembusu virus: a newly emerging avian Flavivirus., 2017, 98(10): 2413-2420.
[21] LI X, LI G, TENG Q, YU L, WU X, LI Z. Development of a blocking ELISA for detection of serum neutralizing antibodies against newly emerged duck tembusu virus., 2012, 7(12): 83.
[22] ZHANG L, LI Z, JIN H, HU X, SU J. Development and application of a monoclonal antibody-based blocking ELISA for detection of antibodies to Tembusu virus in multiple poultry species., 2018, 14(1): 201.
[23] FU Y, JI Y, LIU B, DAFALLAH R M, ZHU Q. Development of a solid-phase competition ELISA to detect antibodies against newly emerged Duck Tembusu virus., 2015, 224: 73-76.
[24] WANG Q, WEN Y, YIFAN H, WU Y, CAI Y, XU L, WANG C, LI A, WU B, CHEN J. Isolation and identification of duck tembusu virus strain lH and development of latex-agglutination diagnostic method for rapid detection of antibodies., 2014, 58(4): 616-622.
[25] CASALS J, BROWN L V. Hemagglutination with arthropod-borne viruses., 1954, 99(5): 429-449.
[26] WANG X, YANG Z, WANG X, DUAN H, LIU L, CHENG H, YANG C, HOU L, PAN J, ZHAO J, LIU Y, LIN J. Development of a hemagglutination inhibition assay for duck tembusu virus., 2019(63): 296-301.
[27] 林健, 杨志远, 何平有, 段会娟, 邹立宏, 杨保收, 赵际成, 潘洁, 王小蕾, 刘立新, 刘月焕. 鸭坦布苏病毒病卵巢病变标准的判定. 中国农业科学, 2016, 49(14): 2830-2836.
LIN J, YANG Z Y, HE P Y, DUAN H J, ZOU L H, YANG B S, ZHAO J C, PAN J, WANG X L, LIU L X, LIU Y H. Criterion of ovarian lesions of duck Tembusu virus disease., 2016, 49(14): 2830-2836. (in Chinese)
[28] 陈光华. 实验动物与兽用生物制品检验和研发. 中国比较医学杂志, 2011, 21(10/11): 20-23.
CHEN G H. Experimental animals and quality control and development of veterinary biologicals., 2011(10/11): 20-23. (in Chinese)
[29] 王晓卉, 李翠, 蒋卉, 张秀英, 温芳, 陆连寿, 王在时. 动物试验替代方法在兽用疫苗检验中的应用概况. 中国兽药杂志, 2015, 49(4): 60-64.
WANG X H, LI C, JIANG H, ZHANG X Y, WEN F, LU L S, WANG Z S. Application of alternatives to animal experiments in the evaluation of veterinary vaccine., 2015, 49(4): 60-64. (in Chinese)
[30] 王兴童, 韩凌霞. 兽用疫苗中替代方法的研究进展. 实验动物科学, 2018, 35(1): 67-71.
WANG X T, HAN L X. Advance on non-animal alternative methods in animal vaccines., 2018, 35(1): 67-71. (in Chinese)
[31] 刘玉梅, 魏学峰, 陈九连, 黄凯, 苍枫, 董俊余, 张立华, 孙艳琪, 高换河, 王伟峰, 卢永干. 牛口蹄疫Asia-Ⅰ型灭活疫苗LPB-E抗体滴度与免疫保护相关性研究. 中国兽药杂志, 2007(7): 19-22.
LIU Y M, WEI X F, CHEN J L, HUANG K, CANG F, DONG J Y, ZHANG L H, SUN Y Q, GAO H H, WANG W F, LU Y G. Studies on the correlation between LPB-E antibody titer and immunoprotection rate of inactivated cattle foot-and-mouth disease Asia-Ⅰvaccine., 2007(7): 19-22. (in Chinese)
Correlation Research of the Serological Test (HI) and Challenge Test of Duck Tembusu Virus Inactivated Vaccine
WANG XiaoLei, LIN Jian, YANG ZhiYuan, LIU LiXin, DUAN HuiJuan, CHENG HuiMin, ZHAO JiCheng, PAN Jie, LIU YueHuan
(Institute of Animal Husbandry and Veterinary Medicine, Beijing Academy of Agricultural and ForestrySciences, Beijing 100097)
【】The objective of this paper was to evaluate the correlation of the serological test (HI) and challenge test of duck Tembusu virus inactivated vaccine.【】Three batches of vaccines ( laboratory trial products) were used to immunize the 51-day-old young ducks and 260-day-old laying ducks by intramuscular injection in 0.15, 0.3, 0.5 and 1.0 mL, respectively. Secondary immunization was proceeded in the same doses and route at 14 day after primary immunization. Ducks were regrouped according to the HI titer and challenged with 0.5 mL (100 DID50) DTMUV at day 28 after secondary immunization. Serum samples were collected at 2 days later for virus isolation and laying ducks were dissected at 8 days later to observe the ovarian lesions. All the results were counted to evaluate the immune potency of vaccines. The correlation of HI titer and immune protection rate was analyzed.【】The protection rate of immunized young ducks with HI titer of 1:5 or lower, 1:10, 1:20, 1:40, 1:80, 1:160, 1:320, 1:640 was 50% (20/40), 43.8% (7/16), 74.3% (26/35), 86.7% (26/30), 96.6% (57/59), 92.7% (51/55), 95% (38/40) and 100% (11/11), respectively. The protection rate was 48.2% with HI titer lower than 1:20, while the rate was 74.3% with HI titer of 1:20 and 93.8% with HI titer of 1:40 or greater. In laying ducks, the protection rate of flocks with HI titer of 1:5 or lower, 1:20, 1:40 and 1:80 was 66.7% (12/18), 83.3% (10/12), 95.2% (20/21) and 100% (15/15), respectively. The protected proportion of ducks with HI titer of 1:10, 1:160, 1:320 and 1:640 was 2/3, 7/7, 1/1 and 2/2, respectively. The protection rate was 66.7% with HI titer of 1:10 or below, while the rate was 83.3% with HI titer of 1:20 and 97.8% with HI titer of 1:40 or greater. There were significant positive correlations between the HI titer and the immune protection rate both in young ducks and laying ducks. The Spearman’s correlation coefficient was 0.905 (<0.01) and 0.932 (<0.01), respectively. 【】There were positive correlations between the HI titer and the immune protection rate of duck Tembusu virus inactivated vaccine (strain HB). The HI detection could be used to evaluate the efficacy of duck Tembusu virus inactivated vaccine (strain HB) instead of challenge test. The HI titer of 1:20 could be defined as the criteria of protection for the duck Tembusu virus inactivated vaccine after immunization.
duck Tembusu virus; HI test; antibody titer; challenge; correlation

10.3864/j.issn.0578-1752.2019.23.023
2019-04-17;
2019-08-23
国家重点研发计划项目(2017YFD0500800)、北京市农林科学院青年科研基金(QNJJ201730)
王小蕾,E-mail:wangxl227@126.com。
刘月焕,E-mail:liuyuehuan@sina.com
(责任编辑 林鉴非)
