海湾扇贝促性腺激素释放激素基因克隆及表达分析❋
2020-01-09李婉茹张玲玲张美溦李若佼李仰平郭振义包振民
李婉茹, 张玲玲,2❋❋, 张美溦, 李若佼, 李仰平, 郭振义, 包振民,2
(1.中国海洋大学海洋海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003;2.青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237)
促性腺激素释放激素(GnRH)是哺乳动物下丘脑分泌合成的多肽类激素,是“下丘脑-垂体-性腺”轴的关键信号分子,其主要功能是通过控制垂体下叶释放卵泡刺激素(FSH)和黄体生成素(LH)的释放,调节动物性别分化、性腺发育和生殖过程。Okubo等[1]的研究表明,在大多数脊椎动物中,GnRH有两种形式,即GnRH I(mammalian-GnRH)和GnRH II(chicken GnRH),部分硬骨鱼除了GnRH I和GnRH II,还有GnRH III(salmon GnRH)。其中,GnRH I的作用是刺激促性腺激素释放,从而调节动物生殖繁育,而其他两种GnRH则在外侧下丘脑发挥神经调节作用。
近年来,研究者们陆续发现GnRH并非脊椎动物所特有,在软体动物中也广泛存在[2]。目前研究者们已克隆获得真蛸(Octopusvulgaris)[3]、剑尖枪乌贼(Uroteuthisedulis)[4]、曼氏无针乌贼(Sepiellajaponica)[5]、海兔(Aplysiacalifornica)[6]、帽贝(Lottiagigantea)[7]、耳鲍(Haliotisasinine)[8]、长牡蛎(Crassostreagigas)[9]、菲律宾蛤仔(Ruditapesphilippinarum)[10]等物种的GnRH基因。科学家还通过质谱获得了长牡蛎[11]和虾夷扇贝[12]的GnRH活性肽序列。关于软体动物GnRH的功能已在多个物种中报道:在腹足纲动物海兔中,GnRH可通过调节肌肉收缩控制末梢组织的运动,但其不具有调节生殖的功能[13-14];在同是腹足纲动物的耳鲍中,GnRH则分布在成熟卵巢中,可能参与卵母细胞的发育[15];在头足纲动物真蛸中,GnRH除了参与调节动物的摄食、记忆和运动外[16],还能促进孕酮、睾酮和雌二醇等激素合成,调节卵巢和精巢发育[17];在贻贝(Mytilusedulis)、长牡蛎、虾夷扇贝等双壳类动物中,GnRH能促进性原细胞增殖,加速性腺发育[18-19],而且注射GnRH活性肽还可以使雌性虾夷扇贝发生性转,影响性别分化[20]。以上研究表明,GnRH参与调控软体动物多种生理过程,包括生殖调节。
目前,软体动物GnRH生殖调控机制的研究已取得初步进展。Nuurai等[15]研究发现,耳鲍中GnRH在耳鲍的脑神经节、足神经节和卵巢中均有分布,推测其可能通过自分泌或旁分泌调控卵巢的发育;但在虾夷扇贝中,GnRH主要分布在脏神经节,在性腺中并没有阳性信号,推测主要通过血液转运到精巢,调控精巢发育进程,促进精原细胞增殖[12,19]。因而,在不同种类的软体动物中,GnRH的生殖调节功能有明显差异,而此前对GnRH生殖调节机制的研究也主要集中在雌雄异体生物。
海湾扇贝(Argopectenirradians)为暖水性贝类,原产于美国东海岸,于1980年代初引入中国,现已成为中国扇贝养殖的主要品种之一[21]。海湾扇贝有春、秋两个繁殖季节,以春季质量较好。作为一种雌雄同体的扇贝,海湾扇贝的性别稳定,其性腺由位于腹嵴外周缘的精巢和位于内侧的卵巢组成。但迄今为止,尚缺乏对海湾扇贝性腺发育过程中GnRH功能的系统研究。本研究将以海湾扇贝为研究对象,利用RACE技术克隆其GnRH基因cDNA全长,分析序列结构特征,并跟踪海湾扇贝生殖周期中GnRH基因在脏神经节及脑足神经节中的动态表达变化过程,以期深入理解GnRH在雌雄同体动物生殖中的作用。
1 材料与方法
1.1 海湾扇贝样品的获取
实验用海湾扇贝为2015年春季繁育,于2015年8月—2016年3月,取自山东省青岛市沙子口养殖区,每月取回1次,每次取样约50只。将海湾扇贝置于实验室过滤海水中暂养1天后,挑选15~20只活性良好的扇贝,获取同一个体的脑足神经节(PGCG)及脏神经节(PVG),于液氮中速冻后,保存于-80℃冰箱备用。
1.2 海湾扇贝GnRH基因的克隆
采用传统酚氯仿抽提法提取海湾扇贝神经节总RNA,用1.2%琼脂糖凝胶电泳检测RNA质量,并用NanoDrop2000 (Thermo Scientific) 检测RNA浓度。参考海湾扇贝转录组数据以及NCBI数据库中其他物种GnRH基因的全长序列,设计基因特异引物GSP及相应巢式引物NGSP(见表1)。使用SMARTer®RACE 5’/3’试剂盒(Clontech),合成cDNA的第一链,并进行5’-RACE和3’-RACE 的PCR扩增。PCR产物经QIAquick Gel Extraction Kit 纯化后连接到pMD18T 载体(TaKaRa),转化DH5α感受态细胞,涂平板,37 ℃培养过夜。次日,挑取阳性克隆,经菌落PCR检测后,交由生工生物工程(上海)股份有限公司测序。
1.3 GnRH基因序列特征分析及系统发生树构建
根据得到的海湾扇贝GnRH基因cDNA全长,翻译出蛋白质全长序列。利用SignalP 4.1及Signal-3L软件预测其信号肽,并预测酶切位点(KR或R),酰胺化修饰位点(G)及活性肽。
参照文献[3-5,7-9,22-32],从NCBI下载脊椎动物和无脊椎动物GnRH蛋白序列。利用GeneDoc软件,对不同物种的蛋白进行多序列比对分析;利用MEGAX软件构建系统发生树,建树方法选择NJ邻接法(Neighbor-Joining),遗传距离的计算采用p-distance法,bootstrap值设为1 000。
1.4 反转录与实时荧光定量PCR检测基因表达量
取1.5 μg RNA,加入1 μL Oligo dT(100 μmol/L)后,将体系用水补至12.5 μL。混匀后,65 ℃温育5 min。加入4 μL 5×Buffer、0.5 μL Recombinant RNase Inhibitor (40 U/μL)、2 μL dNTP(10 mmol/L)、1 μL反转录酶(200 U/μL)。混匀后,42 ℃90 min,72 ℃10 min。
根据海湾扇贝GnRH基因序列设计荧光定量PCR引物,内参基因选择EF1a,荧光定量PCR引物见表1。

表1 RACE引物及荥光定量PCR引物列表
实时荧光定量PCR反应体系如下:将cDNA稀释15倍后取2 μL作为模板,加入10 μL SYBR Green I Real-time PCR Master Mix,上、下游引物(2 μmol/L)各4 μL。使用LightCycler480 实时荧光定量PCR 仪(Roche)进行扩增。PCR反应条件为94 ℃ 10 min;94 ℃ 15 s,60 ℃1 min,40个循环;94 ℃ 15 s,1个循环。分析产物的熔解曲线,检验引物特异性,并采用2-ΔΔCt方法计算目的基因的相对表达量。使用SPSS 20.0软件,通过单因素方差分析(one-way ANOVA,Duncan)分析各月份GnRH表达量差异显著性;使用独立样本t检验,分析同一月份两神经节GnRH表达量差异。
2 结果与分析
2.1 海湾扇贝GnRH基因的cDNA全长克隆
海湾扇贝GnRH基因的cDNA序列全长1 335 bp,其中5’ UTR614 bp,3’ UTR415 bp,ORF306 bp,编码101个氨基酸。预测GnRH前体蛋白分子量为11 kDa,等电点为9.06。SignalP预测发现在GnRH前体的5’端存在24个氨基酸的信号肽,结合酶切位点和酰胺化修饰位点分析推测,活性肽紧随信号肽之后,是具有酰胺化修饰的11个氨基酸的短肽(QNFHYSNGWQP-amide)(见图1)。

(图中黄色部分为信号肽,紫色为GnRH活性肽,绿色为酰胺化位点,红色为活性肽的酶切位点。Signal peptide is highlighted in yellow, GnRH-like bioactive peptides in purple, amidation site in green, cleavage sites in red.)
图1 海湾扇贝GnRH全长cDNA序列及编码氨基酸序列
Fig.1 The full-length cDNA and predicted protein sequence of GnRH fromArgopectenirradians
2.2 同源分析和系统发生树构建
将海湾扇贝GnRH活性肽与人、小鼠等物种的活性肽进行序列比对,结果表明脊椎动物与软体动物的GnRH活性肽长度不同,前者为十肽,后者为十一肽和十二肽;但活性肽区域的保守性较高,N端均为Gln(Q),C端均为酰胺化位点Gly(G)。脊椎动物GnRH活性肽更为相似,相似度介于85%~100%;软体动物GnRH活性肽序列更为相似,相似度在60%~100%。海湾扇贝GnRH活性肽与虾夷扇贝一致性最高,为100%;与头足类和硬骨鱼GnRH活性肽的序列一致性分别下降至73%和67%(见表2)。
利用GnRH蛋白全长序列构建系统发生树,结果见图2。所有GnRH蛋白分成两大进化支:一支由脊椎动物GnRH蛋白组成,其中哺乳动物(人,小鼠)、鸟类(鸡,番鸭)和两栖类(爪蟾,牛蛙)聚在一起,硬骨鱼类(斑马鱼,青鳉,虹鳟,樱鳟)GnRH单独聚在一起;另一支由软体动物GnRH蛋白组成,其中海湾扇贝与同为双壳类的虾夷扇贝、长牡蛎GnRH聚在一起,头足类(真蛸,两种乌贼)和腹足类(帽贝,皱纹盘鲍,绿唇鲍)分别聚为单独的小支。
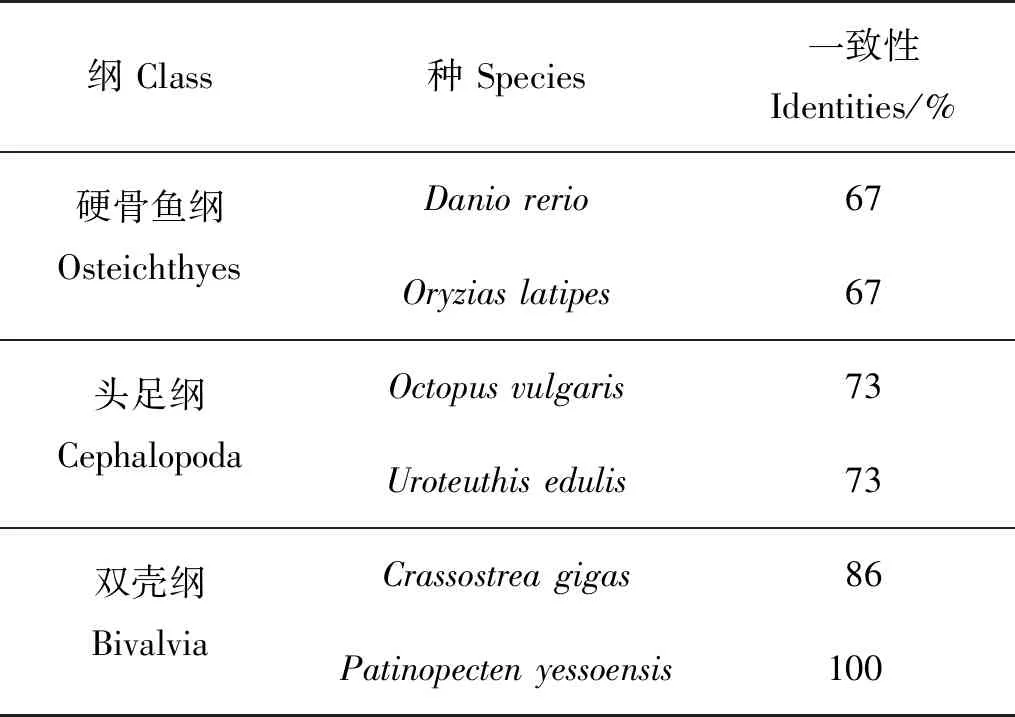
表2 海湾扇贝GnRH活性肽与其他物种GnRH活性肽一致性Table 2 Identities of GnRH-like bioactive peptides of Argopectenirradians with that of other species
2.3 海湾扇贝GnRH在神经节中的动态表达变化
为研究GnRH基因在海湾扇贝生殖调控中的作用,本文利用实时荧光定量PCR跟踪了2015年8月—2016年3月期间,GnRH基因在海湾扇贝脑足神经节(PGCG)及脏神经节(PVG)的表达,结果如图3所示。GnRH基因在PGCG和PVG中均有表达且均呈现先上升后下降的趋势,峰值出现在11月份。在2015年10月—2016年1月期间,PGCG中GnRH的表达量显著高于PVG(P<0.05)。
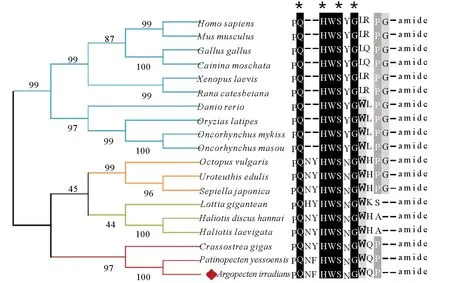
(人HomosapiensNM_000825.3, 小鼠MusmusculusNM_008145.2, 鸡GallusgallusAEZ51861.1, 番鸡CairinamoschataAGW18221.1, 爪蟾XenopuslaevisAAA49728.1, 牛蛙RanacatesbeianaAAL05972.1, 斑马鱼DaniorerioCAC18539.1, 青鳉OryziaslatipesBAB16302.1, 虹鳟OncorhynchusmykissAAD43462.1,樱鳟OncorhynchusmasouAAB63599.1,真蛸OctopusvulgarisBAB86782.1, 蓟尖枪乌贼UroteuthisedulisBAH09303.1, 曼式无针乌贼SepiellajaponicaALS92801.1,帽贝LottiagiganteanFC805607.1,皱纹盘鲍HaliotisdiscushannaiBBH51367.1,绿唇鲍HaliotislaevigataAKR13997.1, 长牡蛎CrassostreagigasHQ712119.1, 虾夷扇贝PatinopectenyessoensisBAH47639.1.)
图2 GnRH氨基酸序列系统进化分析及活性肽序列比对
Fig.2 Phylogenetic tree of GnRH protein and multiple alignments of GnRH-like bioactive peptides

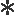
图3 2015年8月—2016年3月GnRH基因在海湾扇贝脑足神经节(PGCG)和脏神经节(PVG)中的表达情况
Fig.3 Relative expression levels ofGnRHin PGCG and PVG ofArgopectenirradiansfrom August 2015 to March 2016
3 讨论
GnRH在脊椎动物中仅具有保守的生殖功能,而在软体动物中GnRH的功能则较为多样化。通过对脊椎动物和软体动物GnRH活性肽的分析,本研究发现两个类群GnRH活性肽在1、4、6、8位具有保守的氨基酸,分别为Gln(Q)、His(H)、Ser(S)和Gly(G),在活性肽N-末端存在焦谷氨酸化修饰(p-Q),在C-末端存在酰胺化修饰(-amide)。而两个类群GnRH活性肽在长度及某些位置的氨基酸存在差异:脊椎动物GnRH活性肽均为十肽,软体动物则在2和3位有2个额外的氨基酸(NY或NF),且脊椎动物和头足类GnRH活性肽在C-末端比双壳类和腹足类的多出一个Gly,导致软体动物的活性肽为十一或十二肽。这些序列差异可能是导致两个类群生物的GnRH功能不同的重要因素。此外,GnRH在脊椎动物和软体动物中的功能差异还可能与垂体的起源有关[33]:脊椎动物保守的生殖功能可能依赖于下丘脑-垂体-性腺(HPG)轴的调控[34],而软体动物尚未进化出垂体,GnRH可能直接作用于靶器官[33],导致其GnRH具有多种功能。
GnRH作为一种神经肽,主要由神经系统产生。在脊椎动物中,GnRH是由下丘脑分泌产生的[35-38];在无脊椎动物双齿围沙蚕(Perinereisaibuhitensis)中,GnRH已被证实是在脑神经节中合成的[39]。双壳类虽然没有脑,但有脑足神经节和脏神经节。本研究中,海湾扇贝GnRH基因在两个神经节中均有表达,这与虾夷扇贝中的研究结果相似[12];而在腹足纲动物皱纹盘鲍(Haliotisdiscushannai)中,GnRH也主要在神经节(脑神经节、足神经节)中表达[32]。此外,海湾扇贝脑足神经节中GnRH的表达量高于脏神经节,但在虾夷扇贝中GnRH活性肽则被认为主要来自脏神经节[12]。导致这种差异的原因可能有两种:其一,GnRH基因对雌雄异体动物和雌雄同体动物的生殖调控存在差异,虾夷扇贝为雌雄异体,海湾扇贝则是雌雄同体;其二,本试验海湾扇贝GnRH表达情况是通过检测其前体mRNA的表达量进行的,而虾夷扇贝GnRH的表达情况则是检测活性肽,不排除脑足神经节中GnRH前体mRNA虽然表达量较高,但由于后续翻译及翻译后加工的效率较差,反而导致其活性肽含量较低。
为了研究海湾扇贝神经节GnRH在性腺发育的作用,本研究分析了2015年8月—2016年3月期间青岛沙子口海区的养殖海湾扇贝GnRH基因的表达情况,逐月获取其神经节和性腺材料,通过对性腺进行石蜡切片确定性腺发育时期。遗憾的是,可能由于当年海区营养、水温等环境问题,在检测的所有样品中性腺均未发育。但结合实验室对养殖虾夷扇贝和海湾扇贝生殖周期研究的经验,海湾扇贝性腺发育略晚于虾夷扇贝。同年9、10月所取临近海区虾夷扇贝处于性腺发育的增殖期,因此推测海湾扇贝性腺发育应在10月之后。由于海湾扇贝GnRH活性肽与虾夷扇贝质谱鉴定的GnRH活性肽序列完全相同,而虾夷扇贝GnRH活性肽可调控精原细胞增殖[34,40],推测海湾扇贝神经节中GnRH在11月份出现的表达高峰,可能跟性腺发育启动有关。
