不同水文情景下洪泽湖、骆马湖有色可溶性有机物生物可利用性特征
2020-01-08张柳青李元鹏周永强张运林
张柳青, 彭 凯, 杨 艳, 石 玉, 李元鹏, 周 蕾, 周永强*, 张运林
1. 中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,江苏 南京 210008 2. 西华师范大学环境科学与工程学院,四川 南充 637000 3. 中国科学院大学,北京 100049
引 言
有色可溶性有机物(chromophoric dissolved organic matter, CDOM)主要包括腐殖酸、富里酸、芳香烃类等物质,是溶解性有机物(dissolved organic matter, DOM)中能够强烈吸收紫外辐射及蓝光波段的那部分有机物,影响水体中污染物的形态特征、迁移转化过程以及初级生产者对光的利用[1]。微生物降解是影响CDOM归趋的重要过程之一,也影响着湖泊富营养化进程,对河流或湖泊的水质优劣起到重要作用[2]。国际上通常规定DOC生物可利用性(biodegradable DOC, BDOC)为CDOM在一定时间段内(通常为28 d)能被微生物降解的程度[5],联合运用EEMs-PARAFAC分析法能够快速、准确地解析出CDOM降解特征。Knapik[3]等对城市河流CDOM的生物降解研究,有助于了解城市河流中有机物质的迁移转化机制以及确定CDOM赋存量,Sleighter[4]等对河流CDOM生物可利用性进行了研究。因此CDOM的生物可利用性的研究也是对认识CDOM在水体环境中作用的前提。洪泽湖和骆马湖是南水北调东线工程重要枢纽湖泊,其水质关系到淮河流域经济带的可持续性发展以及南水北调的水质安全。湖泊CDOM的生物可利用性直接影响湖泊污染物及重金属输移,以及营养盐循环过程和浮游生物生长,因而在很大程度上影响湖泊水质。然而值得指出的是,目前对上述两个湖泊CDOM 生物可利用性研究鲜有报道[6]。本文探讨了不同水文情景下洪泽湖和骆马湖CDOM经过生物降解后组成结构的变化特征及驱动其生物降解作用的潜在机制,以期进一步丰富洪泽湖和骆马湖水环境相关资料,为更好的保护其水环境健康和湖泊生态系统以及制定合理的管理方案提供科学数据。
1 实验部分
1.1 样品采集与生物培养实验
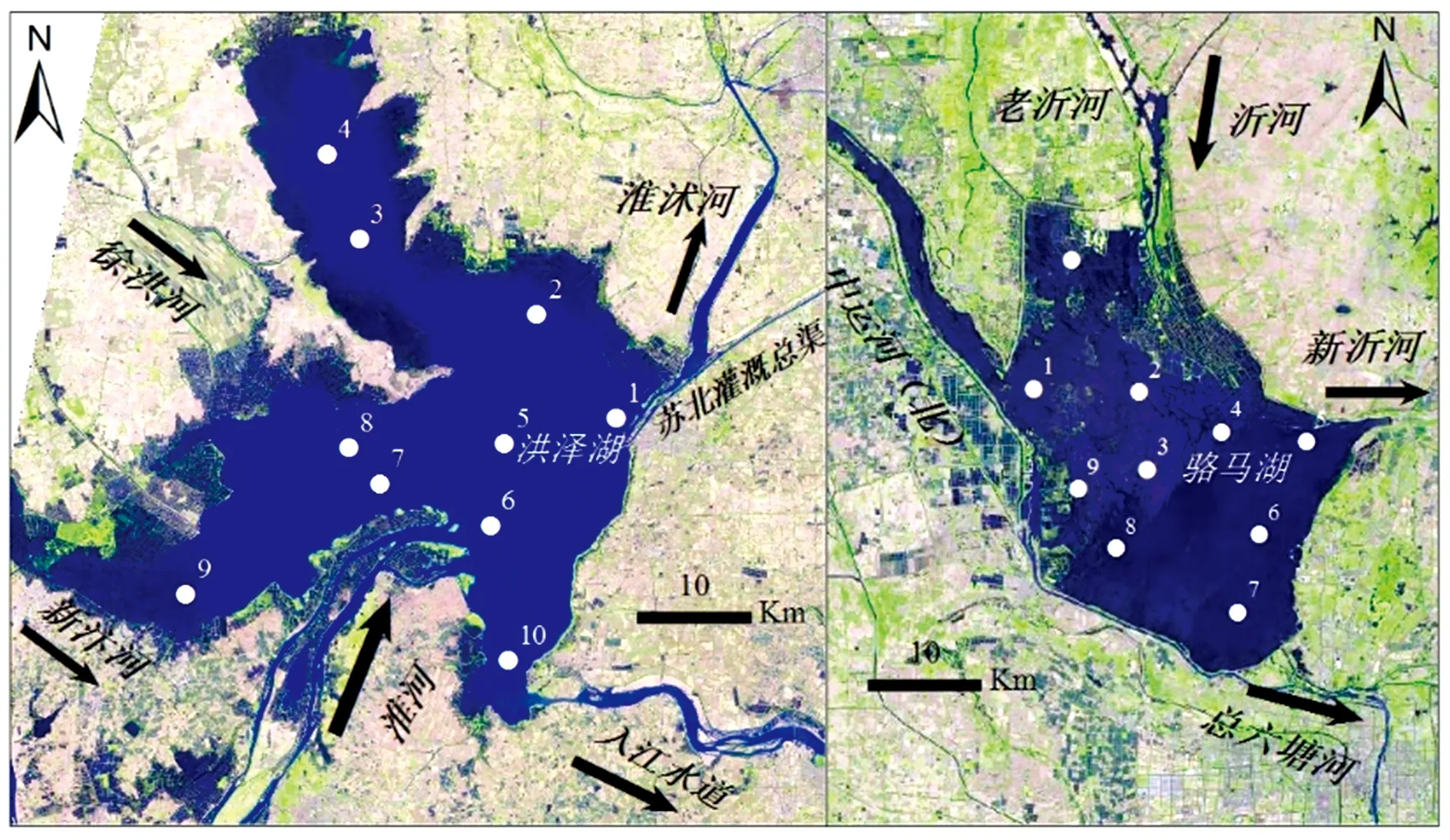
图1 洪泽湖和骆马湖采样点位置
1.2 水文数据
水文数据资料,包括2017年—2018年淮河、沂河两个控制站(分别为蚌埠和临沂)的月均流量和月均来水量以及淮河水系降雨量来自水利部淮河水利委员会(http://www.hrc.gov.cn/)。
1.3 CDOM参数测定
1.3.1 CDOM吸收光谱及DOC的测定
CDOM的吸收光谱采用Shimazdu UV-2550 UV-Vis分光光度计测定。特征吸收系数a(254)用于表征CDOM浓度,比紫外吸光度SUVA254指示水体的腐殖化程度,其值随腐殖化程度的增加而增大,S275~295是由275~295 nm波长范围内吸收系数通过指数函数拟合得到的光谱斜率,其值越大,陆源类腐殖酸输入信号越弱[7]。本研究使用生物培养前与培养后的差值,Δa(254)、ΔSUVA254和ΔS275~295等指标来表征CDOM相对丰度、结构组成的变化特征。DOC浓度利用岛津总有机碳分析仪(TOC-L)在高温环境下(680 ℃)测定,BDOC的计算方法为培养前DOC浓度减去培养后所得差值,将该差值除以初始DOC浓度值再换算成BDOC的百分比。
1.3.2 三维荧光光谱测定及平行因子分析
采用F-7000型荧光光度计(Hitachi公司)测定样品CDOM荧光激发-发射光谱矩阵(excitation-emission matrices, EEMs)。设置激发光谱范围200~450 nm,间隔5 nm; 发射光谱范围250~600 nm,间隔1 nm。首先从测得的三维荧光光谱中扣除超纯水(Milli-Q)空白EEMs以进行水拉曼散射校正,并用当天测定的超纯水EEMs中350 nm下的荧光强度将当天所有EEMs定标为拉曼单位(Raman unit,R.U.)。然后采用MATLAB软件中的drEEM工具包通过切除及插值的办法进行瑞利散射校正,内滤波效应采用每个样品EEMs激发发射波长处相对应的吸光度进行校正[8]。
采用MATLAB R2015b的drEEM工具箱(ver.0.2.0)对178个(培养前后洪泽湖共84个,骆马湖94个)EEMs矩阵进行运算,每个矩阵对应251个发射波长、45个激发波长。数据被剖分成6个随机子集,取3个子集用于建模,另外3个用于模型验证,每个EEMs子集均从3个组分逐步到6个组分检验,最终确定了3个组分模型足够解释> 99%的EEMs信号。本文采用荧光组分的最大荧光强度(Fmax)表征各组分荧光强度[9]。使用生物培养前与培养后各组分Fmax的差值与培养前组分Fmax比值的百分比,即%ΔC1,%ΔC2和%ΔC3来表征各荧光组分的生物可利用性特征。
1.4 数据处理
采用SPSS23.0软件中独立样本t-test和Pearson相关分析对数据进行分析处理,数据统计与图表绘制采用Origin 9.5,采用MATLAB R2015b软件的drEEM工具箱进行平行因子分析建模。
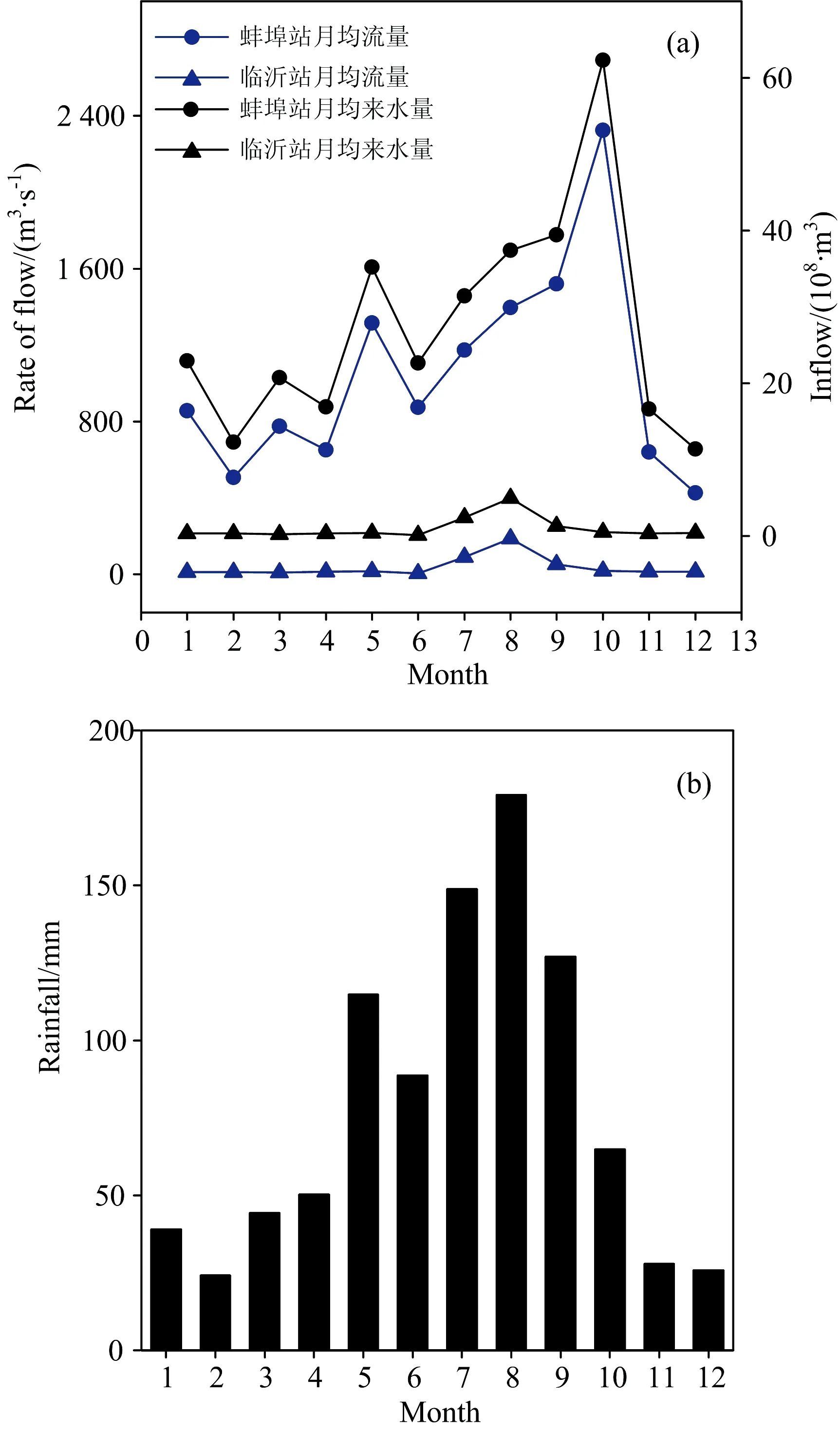
图2 2017年—2018年洪泽湖和骆马湖月均流量、来水量以及淮河水系降雨量
Fig.2MonthlymeanflowrateofHuaiRiveratBengbuandYiRiveratLinyi,andthecorrespondinginflowdischargetothetwolakes(a)in2017—2018,andmonthlymeanrainfallofHuaiRiverwatershed(b)
2 结果与讨论
2.1 水文特征及划分
淮河和沂河分别是洪泽湖、骆马湖的主要入湖河流。淮河水系5月—9月降水量最高(88.7~179.2 mm),1月—4月、10月—12月降水量在24.2~64.9 mm。5月—10月蚌埠站月均流量分别为873.5~2 325.5 m3·s-1,1月—4月、11月—12月较小(425.0~855.5 m3·s-1),而临沂站除7~9(51.35~186.5 m3·s-1)月外,其余时间月均流量较低且无明显波动。两湖泊月均来水量变化规律与月均流量一致。本研究将2017年12月和2018年4月划为枯水期,2018年6月~2018年9月划为丰水期。
2.2 不同水文情景下CDOM生物可利用性特征
生物培养28 d后,不同水文情景下两湖泊DOC和a(254)均低于培养前,且骆马湖丰、枯水期DOC(t-test,p<0.05,p<0.001)和a(254)(t-test,p<0.01,p=0.004)培养后显著降低(见表1)。由图3(a)和(b)可知,两湖泊BDOC和%BDOC在枯水期高于丰水期。枯水期输入的DOC营养限制低且冬季水样中存在较多未被充分分解的有机物质[10]。枯水期洪泽湖%BDOC在湖区分布较一致,因枯水期来水量和降雨量较低,湖泊水体交换缓慢,CDOM生物可利用性在空间上受影响较小[11]。丰水期7月和9月洪泽湖在湖区东南部%BDOC较低,而8月在北部和中部湖区较低[图4(c)—(e)],这可能是夏季光照充足,迁移至出湖区域输出大量降解比较充分的CDOM[12]。骆马湖枯水期%BDOC由北向南逐渐降低,表明入湖区域CDOM生物可利用性较高,且迁移过程会降低CDOM的生物可利用性。骆马湖丰水期7月和8月%BDOC也在入湖区域较高,意味着迁移过程中CDOM不断被降解,与洪泽湖相似[图4(h)—(j)]。
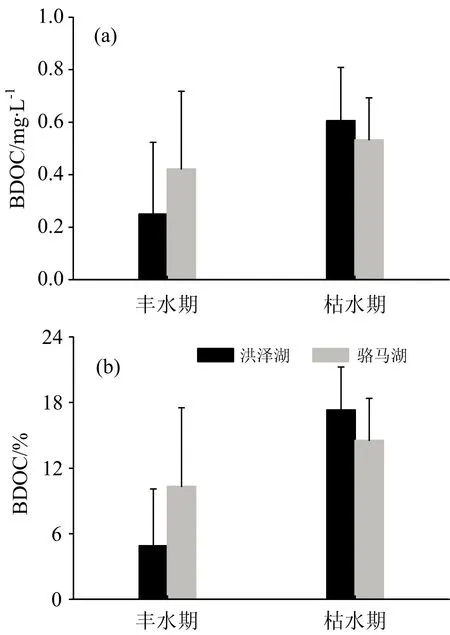
图3 不同水文情景BDOC和%BDOC的变化特征
表1 不同水文情景洪泽湖和骆马湖生物培养28 d前后DOC,a(254),SUVA254和S275~295的显著性水平t检验
Table1Thet-testofthemeanofDOC,a(254),SUVA254,andS275~295pre-andpost-28daysofbio-incubationofLakeHongzeandLakeLuomaindifferenthydrologicalscenarios
2.3 荧光组分变化特征
2.3.1 EEMs-PARAFAC荧光组分鉴别
对培养前后的全部水样荧光数据进行EEMs-PARAFAC分析鉴定出紫外区类腐殖质C1(λEx/λEm=250/420 nm),类色氨酸C2(λEx/λEm=230,285/348 nm)和类酪氨酸C3(λEx/λEm=275/316 nm)3个荧光组分[6, 9](图5)。组分C1来源于陆源输入,还包括微生物作用后或浮游植物的降解产生,类蛋白组分C2和C3普遍存在淡水和海水中,与浮游植物初级生产力、微生物矿化以及人类污染物排放等过程相关[6]。
2.3.2 不同水文情景下荧光组分生物可利用性特征
由图6和表2可知,枯水期骆马湖类酪氨酸荧光强度显著低于培养前(t-test,p<0.001),类腐殖质和类色氨酸显著增多(t-test,p<0.001,p=0.002)。洪泽湖荧光组分变化规律与骆马湖相同,这意味着两湖泊类酪氨酸的活性较高,导致类腐殖质累积。而丰水期洪泽湖两种类蛋白荧光组分和骆马湖类色氨酸荧光强度略微高于培养前,Wilson[14]等也有相同的发现,这与不同季节CDOM来源的差异以及细菌的裂解作用有关。此外,不同水文情景下两湖泊ΔSUVA254为负值,其中枯水期两湖泊SUVA254显著高于培养前(t-test,p<0.001,p=0.003)。除洪泽湖丰水期外,两湖泊ΔS275~295均为正值,且骆马湖丰、枯水期样品S275~295值均显著低于培养前(t-test,p<0.05,p=0.007)(表1)。表明CDOM微生物降解活性变低且腐殖化程度增加,进一步印证微生物作用导致不稳定组分向稳定组分的转化,即类腐殖质的累积[13]。
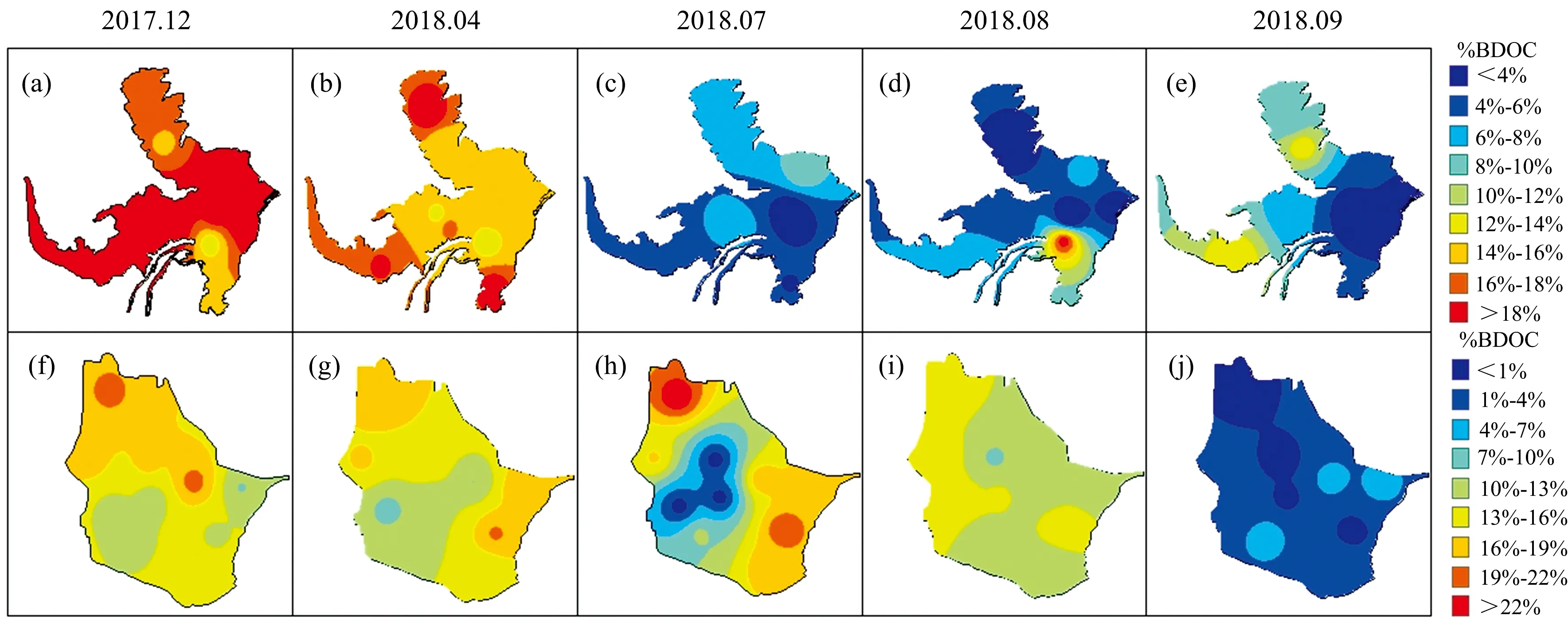
图4 洪泽湖和骆马湖%BDOC时空分布
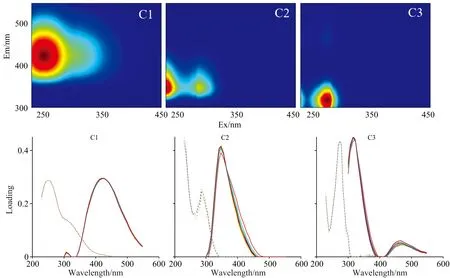
图5 采用对半分析和随机初始化验证PARAFAC模型得到3类荧光组分
2.4 相关性分析
洪泽湖、骆马湖在不同水文情景下BDOC和%BDOC分别与ΔSUVA254显著负相关,BDOC与ΔC3和%ΔC3均显著正相关,%BDOC与ΔC3和%ΔC3也成显著正相关,进一步印证了不同水文情景下两个湖泊微生物对类酪氨酸利用性较强,微生物作用会增加CDOM的腐殖化程度(见图7)。
3 结 论
洪泽湖、骆马湖枯水期CDOM生物可利用性高于丰水期,并且在不同水文情景微生物作用28 d后SUVA254均增大,尤其是枯水期类酪氨酸组分Fmax显著降低和类腐殖质Fmax的增加,表明了两湖泊微生物会优先利用不稳定的类酪氨酸,并转化为类腐殖酸,因而培养后CDOM样品腐殖化程度有所升高。丰水期两湖泊类蛋白组分经生物培养后Fmax有所增加,不同季节CDOM来源存在差异,影响了CDOM生物可利用性。
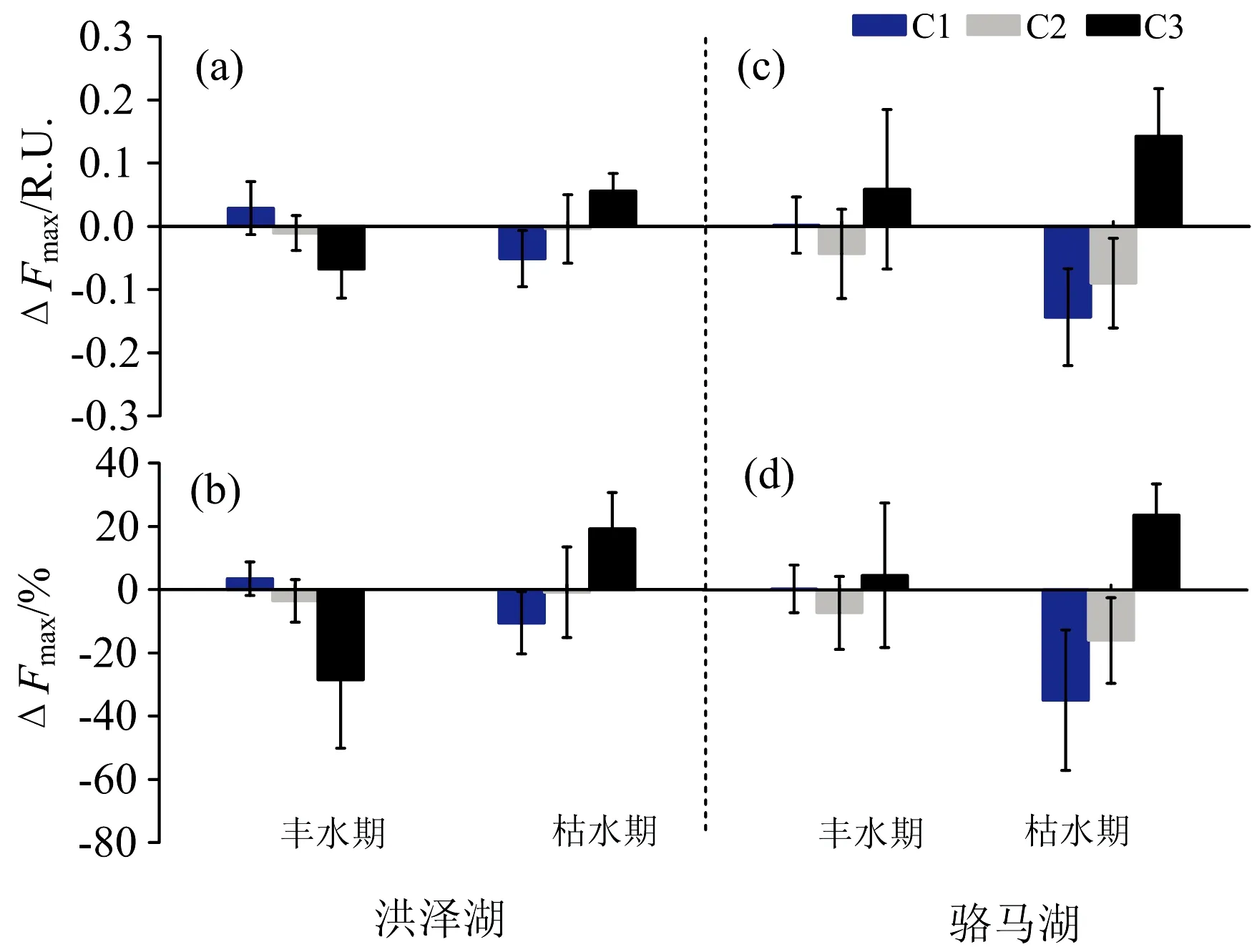
图6 生物培养28 d前后洪泽湖和骆马湖不同水文情景下3种荧光组分的变化
Fig.6VariabilityofthethreefluorescentcomponentsofLakeHongzeandLakeLuomapre-andpost-28daysofbio-incubationindifferenthydrologicalscenarios
致谢: 感谢邹伟、郭锐、邢晓晟、刘宁超及张成英等同志在野外及室内试验过程中给予的帮助。
表2不同水文情景洪泽湖和骆马湖生物培养28 d前后荧光组分t检验
Table2Thet-testbetweenthemeanofthethreefluorescentcomponentspre-andpost-28daysofbio-incubationofLakeHongzeandLakeLuomaindifferenthydrologicalscenarios
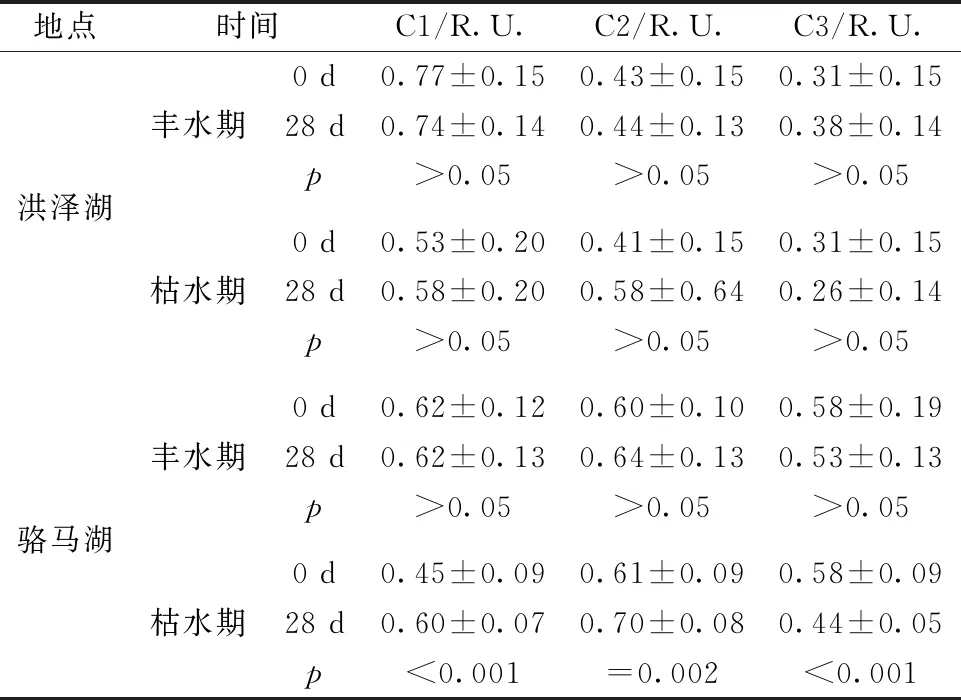
地点时间C1/R.U.C2/R.U.C3/R.U.洪泽湖丰水期枯水期0 d0.77±0.150.43±0.150.31±0.1528 d0.74±0.140.44±0.130.38±0.14p>0.05>0.05>0.050 d0.53±0.200.41±0.150.31±0.1528 d0.58±0.200.58±0.640.26±0.14p>0.05>0.05>0.05骆马湖丰水期枯水期0 d0.62±0.120.60±0.100.58±0.1928 d0.62±0.130.64±0.130.53±0.13p>0.05>0.05>0.050 d0.45±0.090.61±0.090.58±0.0928 d0.60±0.070.70±0.080.44±0.05p<0.001=0.002<0.001
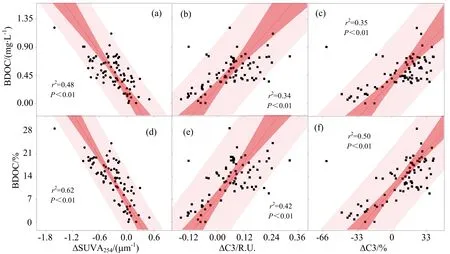
图7 BDOC和%BDOC分别与ΔSUVA254,ΔC3,%ΔC3的相关关系
