釉基质衍生物对人牙周膜干细胞成骨分化的影响
2020-01-08余晓宏刘屿曾莲杨艳玲王洲李卫
余晓宏 刘屿 曾莲 杨艳玲 王洲 李卫
1.云南省第二人民医院口腔内科 昆明 650012;2.昆明医科大学附属口腔医院口腔颌面外科 昆明 650031
牙周炎等牙周组织疾病造成牙周支持组织的破坏,牙周附着的丧失,最终导致牙齿的松动、脱落。牙周炎治疗的最终目的不但要控制炎症和阻止病变的进一步发展,而且还要形成新的牙槽骨和牙骨质[1]。牙周膜干细胞分化是骨组织再生和修复的关键,因此研究牙周膜干细胞成骨分化的分子机制对于临床上治疗牙周组织疾病具有重要作用。
人牙周膜包围干细胞亚群,其负责维持和再生牙周组织结构和功能。这些细胞表现出多能性,可以分化为成骨细胞、成纤维细胞和牙齿成牙骨质细胞,以及形成牙骨质和牙周膜样组织,因此通常被称为牙周膜干细胞,大量的动物研究[2]提供了可靠的证据支持牙周膜干细胞可用于牙周组织再生的设想。因此牙周组织再生治疗的一个关键因素为促干细胞定向诱导分化,目前虽已证实骨形态发生蛋白(bone morphogenetic protein,BMP)、转化生长因子、血小板衍生因子、雌激素等具有明确的骨向诱导作用。但对于牙周组织的修复治疗仍需积极寻求更多的高效药物。
由猪胎儿的牙齿材料[3]制备的釉基质衍生物(enamel matrix derivative)由疏水性蛋白质的混合物组成,其中牙釉蛋白含量超过90%。在牙周骨内缺损的治疗中,釉基质衍生物被证明可以支持骨缺损的再生[4]。有研究[5-6]已经特别报道了釉基质衍生物可以在体外刺激成骨细胞和成牙骨质细胞的增殖和分化,并促进体内牙骨质和牙周组织的再生。在体外,釉基质衍生物能促进CD4+T细胞凋亡,抑制肿瘤坏死因子诱导的MC3T3-E1成骨细胞的凋亡[7]。另有研究[8]表明,将釉基质衍生物放入猴牙周缺损模型中,观察到几乎完全的无细胞牙骨质修复,胶原组织紧密地结合于新生的牙槽骨。虽然研究已经发现了釉基质衍生物有促进牙周膜成纤维细胞增殖及牙槽骨修复的作用,但其中的调控作用机制还很不明确,其对牙周膜干细胞的作用还有待进一步研究。人牙周膜干细胞成骨分化受到多种信号转导通路的调节,如Wnt通路、Smad蛋白通路、p38有丝分裂原活性蛋白激酶(mitogen-activated protein kinase,MAPK)通路、Notch等[9]。Wnt信号通路已被证明在间充质干细胞增殖、分化、凋亡等过程均产生调控作用[10-11],而Wnt信号通路是否参与调控釉基质衍生物促进人牙周膜干细胞成骨向分化尚无报道。因此本实验旨在探讨Wnt信号通路在釉基质衍生物促进人牙周膜干细胞成骨分化过程中是否起作用,从而进一步阐明釉基质衍生物促进人牙周膜干细胞成骨分化的作用机制。
1 材料和方法
1.1 主要试剂和仪器
釉基质衍生物(Straumann公司,瑞士),DDK1(Sigma公司,美国),Dulbecco’s改良Eagle’s培养基(Dulbecco’s modified Eagle’s medium,DMEM)(Gibco公司,美国)、0.25%胰蛋白酶(Gibco公司,美国)、青链霉素(Gibco公司,美国);胎牛血清(Gibco公司,美国);Ⅰ型胶原,骨钙素,β-连环蛋白,RunX2,CaMKⅡ及NLK引物合成(上海生工生物工程有限公司),Trizol提取试剂(Invitrogen公司,美国);Super TaqMan OneStep RT-qPCR Kit(北京康为世纪生物科技有限公司);CCK-8检测试剂盒(北京索莱宝科技有限公司); β-连环蛋白抗体(Abcam公司,英国)、RunX2抗体(Santa Cruz Biochemistry公司,美国),CaMKⅡ(Abcam公司,英国)、NLK抗体(Abcam公司,英国),对应二抗(北京康为世纪生物科技有限公司);STRO-1(Abcam公司,英国)、CD146流式抗体(Abcam公司,英国);Masson Trichrome染色试剂盒(北京索莱宝科技有限公司)、Von Kosa’s染液(北京索莱宝科技有限公司);CO2细胞培养箱(FORMA 3131;Thermo公司,美国),倒置相差显微镜(TS100;Nikon公司,日本),多功能酶标仪(FC;Thermo公司,美国),超低温冰箱-80 ℃(L93-12L;Thermo公司,美国),低温高速离心机(GS-15R;Beckman公司,美国),其余细胞培养耗材(Corning公司,美国),实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)仪(ABI-7500;ABI公司,美国),低温离心机(CF-16RX;日立公司,日本),流式细胞仪(CyFlow Space,Partec GmbH公司,德国)。
1.2 实验方法
1.2.1 人牙周膜干细胞体外培养和鉴定 取因正畸而拔除的健康前磨牙,患者年龄11~14岁。用尖刀刮取牙根部的牙周膜组织,将组织剪成1 mm3碎块。在超净工作台内用磷酸盐缓冲液(phosphate buffered saline,PBS)和不含胎牛血清的α-基础Eagle’s 培养基(α-minimum Eagle’s medium,α-MEM)各清洗标本2次,将标本接种于T25培养瓶中,加入适量含有10%胎牛血清、1%双抗的DMEM,置于CO2培养箱中,37 ℃、5% CO2、饱和湿度条件下培养。待细胞从组织块边缘爬出并生长汇合达80%时,用0.25%胰蛋白酶消化后扩大培养。
选取生长状况良好的第3代细胞,收集细胞后制备成单细胞悬浮液。向流式管中加入50 μL细胞悬浮液,使每管细胞数目约为106,向管中分别加入50 μL稀释后的STRO-1、CD146单克隆抗体,并轻轻混匀,4 ℃避光孵育30 min;然后用洗涤缓冲液洗涤细胞2次。每管加入250 μL缓冲液重悬细胞后用流式细胞仪检测。
1.2.2 CCK-8检测釉基质衍生物对人牙周膜干细胞增殖的影响 收集对数生长期的细胞,用完全培养基重悬,将细胞接种于96孔板中,使每孔细胞数目为1×103,培养基体积为200 μL,调零孔只加入200 μL培养基。将细胞置于37 ℃、5% CO2培养箱培养24 h,按实验分组更换相应培养液,使釉基质衍生物的终浓度为10、20、50、100 mg·L-1,空白对照组不处理,分别于6 h、12 h、1 d、2 d、3 d、5 d和7 d后取出1块板。向每个孔加入10 μL CCK-8溶液。将培养板在培养箱内孵育2 h,用酶标仪测定450 nm波长处的吸光度(A)值,并计算细胞活力:
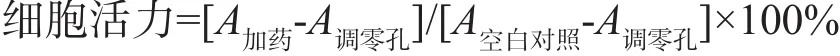
1.2.3 人牙周膜干细胞胶原合成及矿化结节形成检测 取第3代人牙周膜干细胞,以5×104mL-1接种1 mL至24孔板,培养24 h后,每组3孔重复,对照组换成含10%胎牛血清、1%双抗的DMEM,实验组在相同的培养液中加入不同质量浓度的釉基质衍生物(20、50或100 mg·L-1),空白对照组不做处理,放入37 ℃、5% CO2培养箱中培养2、4周后进行以下检测。
Trichrome染色检测胶原合成情况:按试剂说明书进行,细胞用体积分数10%甲醛固定后,加入Bouin’s溶液56 ℃ 1 h,放入魏格特铁苏木精染液10 min,清洗后,放入比布列西酸性品红液10~15 min,再放入苯胺蓝溶液10 min,清洗后放入1%乙酸5 min,脱水后显微镜观察。
茜素红染色法检测矿化结节形成情况:接种等量人牙周膜干细胞至24孔爬片,待细胞融合度达80%时,分别换液为含20、50、100 mg·L-1釉基质衍生物的DMEM,空白对照组换等体积不含釉基质衍生物的培养基,继续培养2、4周后,用茜素红染色法将矿化结节染成红色。将固定后的细胞爬片用PBS洗涤后,浸入5%硝酸银水溶液中10 min,日光下放置暴晒30 min,蒸馏水洗涤,乙醇系列脱水,二甲苯透明,显微镜观察。
1.2.4 qRT-PCR检测成骨分化标志物mRNA水平收集生长状况良好的第3代细胞,用Trizol法提取细胞总RNA,qRT-PCR检测成骨分化相关因子Ⅰ型胶原(collagen Ⅰ)、骨钙素(osteocalcin)、RunX2 mRNA水平的表达情况。引物序列见表1。PCR程序如下:95 ℃ 5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃10 min。

表1 qRT-PCR的引物序列Tab 1 Primer sequence for qRT-PCR
1.2.5 Western blot、qRT-PCR检测DDK1对人牙周膜干细胞成骨分化的影响 选取第3代人牙周膜干细胞,以5×104mL-1接种1 mL至6孔板,每孔加入含10%胎牛血清的DMEM 2 mL,待细胞融合度达80%时,分别换液为含20、50、100 mg·L-1釉基质衍生物的DMEM和含0.05 mg·mL-1DKK1的DMEM,空白对照组换等体积DMEM,共5组,每组6孔重复。培养7 d后,其中3孔提取总RNA,经qRT-PCR检测β-连环蛋白、RunX2、CaMKⅡ及NLK在mRNA水平的表达情况;另外3孔提取总蛋白质,经Western blot检测β-连环蛋白、RunX2、CaMKⅡ及NLK在蛋白质水平的表达情况。
1.3 统计分析
用SPSS 13.0统计学软件进行统计分析,每个体外实验至少进行3次。实验数据均以均数±标准差表示;采用单因素方差分析检验差异显著性,用LSD-t检验比较两组间差异。P<0.05表示差异有统计学意义。
2 结果
2.1 人牙周膜干细胞流式鉴定
采用组织块消化培养的原代细胞,5~10 d可见组织块周围明显有原代细胞爬出(图1A),进一步通过有限稀释克隆法得到纯化的人牙周膜干细胞。纯化后的人牙周膜干细胞形态丰满,呈长梭形,细胞核聚集在中心,细胞呈反射状、旋涡状生长,2周左右即可达80%汇合(图1B);流式细胞检测结果显示第3代人牙周膜干细胞阳性表达间充质细胞表面标记物CD146(阳性)、STRO-1(阳性),证实所取得细胞为间充质来源(图2)。
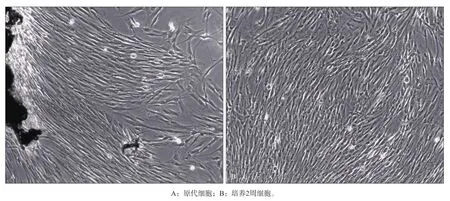
图1 人牙周膜干细胞形态特征Fig 1 Morphological characteristics of human periodontal ligament stem cells

图2 流式细胞仪检测人牙周膜干细胞表面抗原的表达Fig 2 Flow cytometry detection of surface antigens of human periodonatal ligament stem cells
2.2 釉基质衍生物对人牙周膜干细胞活力的影响
CCK8检测不同浓度(10、20、50、100 mg·L-1)釉基质衍生物对人牙周膜干细胞活力的影响,结果显示(图3),与空白对照组相比,在20 mg·L-1以上釉基质衍生物均明显促进人牙周膜干细胞的活力,并呈现剂量和时间依赖性,在作用3 d后效果最明显(P<0.05)。
2.3 釉基质衍生物对人牙周膜干细胞成骨相关基因表达的影响
以釉基质衍生物(0、20、50、100 mg·L-1)分别培养牙周膜干细胞2、4周后,以qRT-PCR检测成骨相关因子Ⅰ型胶原、骨钙素、RunX2的mRNA表达水平。结果显示,随时间的延长,釉基质衍生物促进牙周膜干细胞成骨相关因子Ⅰ型 胶原、骨钙素、RunX2表达(P<0.05)(图4)。
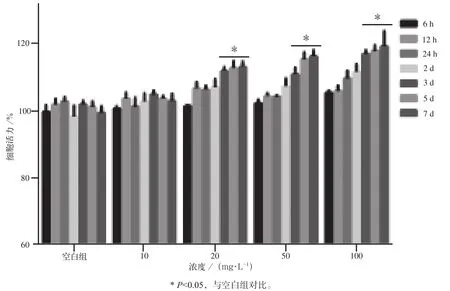
图3 釉基质衍生物对牙周膜干细胞活力的影响Fig 3 Effects of enamel matrix derivatives on proliferation of periodontal ligament stem cells
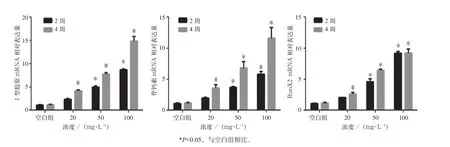
图4 qRT-PCR检测牙周膜干细胞成骨相关基因表达Fig 4 Expression of osteogensis-related genes of periodontal ligament stem cells detected by qRT-PCR
2.4 釉基质衍生物对人牙周膜干细胞胶原合成及矿化能力的影响
以不同浓度的釉基质衍生物(0、20、50、100 mg·L-1)作用牙周膜干细胞2、4周后,检测牙周膜干细胞生成胶原情况以及矿化结节形成情况;Trichrome染色结果显示(图5A~H),随着釉基质衍生物的浓度越高,牙周膜干细胞合成胶原量显著增多(P<0.05),且呈剂量、时间效应关系,说明釉基质衍生物能够促进牙周膜干细胞胶原的合成能力;茜素红染色结果显示(图5I~P),随着釉基质衍生物的浓度越高,牙周膜干细胞矿化结节形成量越多(P<0.05),并且呈剂量、时间效应关系,说明釉基质衍生物能够促进牙周膜干细胞矿化结节形成的能力。
2.5 Wnt信号通路在不同浓度釉基质衍生物作用下对人牙周膜干细胞成骨分化的影响
使用釉基质衍生物(20、50、100 mg·L-1)或0.05 mg·L-1DDK1分别培养牙周膜干细胞7 d后,以qRT-PCR和Western blot检测β-连环蛋白、RunX2、CaMKⅡ及NLK的表达。结果显示,在mRNA水平(图6A~D),釉基质衍生物促进牙周膜干细胞RunX2、CaMKⅡ及NLK的表达,而降低β-连环蛋白表达,并且呈现出一定剂量依赖效应(P<0.05);在蛋白质水平(图6E)与mRNA表达一致,而当人牙周膜干细胞经DDK1处理后,釉基质衍生物的效果被明显抑制。
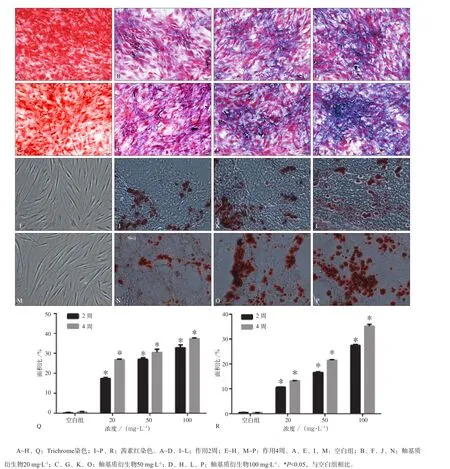
图5 Trichrome和茜素红染色检测牙周膜干细胞胶原合成和矿化能力Fig 5 Collagen synthesis and mineralization nodule formation of periodontal ligament stem cells detected by Trichrome staining and alizarin red staining
3 讨论
目前针对牙周组织疾病治疗的难点和重点都在于如何有效提升牙槽骨再生的水平。 Seo等[10]于2004年首次从人第三磨牙中分离出牙周膜干细胞,在一定的培养条件下,牙周膜干细胞能够分化为成牙骨质细胞、脂肪细胞和胶原形成细胞。牙槽骨再生需要细胞同时具备较强的矿化能力和胶原合成能力,牙周膜干细胞移植可以是牙槽骨再生的有效方法[11]。
Wnt信号通路分为经典的Wnt/β-连环蛋白信号通路和非经典的Wnt/CaMKⅡ/NLK信号通路。目前在干细胞参与成骨分化的过程中研究较多的为Wnt/β-连环蛋白信号通路,但是对Wnt/β-连环蛋白信号通路在人牙周膜干细胞的成骨分化过程中的作用尚有争议[12-13],有分析称Wnt/β-连环蛋白信号通路对人牙周膜干细胞成骨分化的抑制或促进作用可能与细胞生长微环境、生长状态和所受刺激等因素有关。
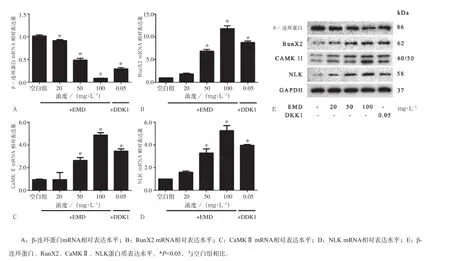
图6 qRT-PCR和Western blot检测牙周膜干细胞β-连环蛋白、RunX2、CaMKⅡ及NLK的表达Fig 6 Expression of β-catenin, RunX2, CaMKⅡ and NLK in periodontal ligament stem cells detected by qRT-PCR and Western blot
牙釉质基质蛋白是牙齿发育期间产生的以牙釉蛋白衍生蛋白为主的异质混合物。热处理形式的牙釉质基质蛋白具有调节人牙周膜细胞的间充质和非间充质分化途径的能力[14],但由于从人牙胚不易获得牙釉质基质蛋白,临床上常用的釉基质衍生物是由猪牙胚中提取得到的釉基质蛋白纯化获得。牙釉质基质蛋白相对容易获得,因此对于釉基质衍生物调节牙周膜干细胞的成骨分化将有助于进一步理解其发挥临床疗效的作用机制,对于釉基质衍生物的广泛临床应用显得意义重大,同时能够为牙周组织缺损的诊疗提供一定参考。
本实验分离出牙周膜干细胞,并提供流式细胞仪鉴定,证明了牙周膜干细胞的干细胞特性。在给予浓度梯度的釉基质衍生物刺激后,细胞增殖能力得到显著提高,同时细胞胶原形成和矿化能力以及成骨细胞相关基因表达也被明显增强,提示釉基质衍生物能够促进牙周膜干细胞的增殖,还能够明显促进其成骨分化,其结论与王爽等[15]的发现一致;另外,在浓度梯度釉基质衍生物作用的同时施加DKK-1,结果显示牙周膜干细胞成骨分化能力被明显抑制,表明抑制Wnt信号通路可抑制釉基质衍生物促进牙周膜干细胞成骨分化的能力,进一步表明釉基质衍生物促进牙周膜干细胞分化的作用可能是通过对经典的Wnt/β-连环蛋白信号通路的激活,从而使糖原合成酶激酶(glycogen synthetase kinase,GSK)-3β大量被磷酸化,促进β-连环蛋白在细胞内聚集,并转移至细胞核内与转录因子/淋巴增强因子结合,同时促进下游一系列靶基因的表达,调控了牙周膜干细胞的增殖与分化过程。另一方面,本研究还发现釉基质衍生物能促进CaMKⅡ、NLK表达,且其表达也与牙周膜干细胞成骨分化程度呈正相关,DDK-1作用后,CaMKⅡ、NLK表达被明显抑制。提示,釉基质衍生物对牙周膜干细胞成骨分化的促进作用也可能涉及非经典的Wnt/CaMKⅡ/NLK信号通路。因此,本研究将有助于进一步明确釉基质衍生物促牙周膜干细胞分化的相关机制,对釉基质衍生物应用于临床治疗牙槽骨再生将能够提供一定理论参考。但由于釉基质衍生物包含多种蛋白质,具体是哪些蛋白质或者哪种蛋白质的某一肽段发挥作用还需要进一步研究。
