保护液结合暂养工艺对花鲈无水活运效果的影响
2020-01-08张玉晗
张玉晗,谢 晶
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海冷链装备性能与节能评价专业技术服务平台,食品科学与工程国家级实验教学示范中心(上海海洋大学),上海 201306)
花鲈(Lateolabrax maculatus)属鱼纲(Pisces)、鲈形目(Perciforms)、鮨科(Serranidae)、常鲈亚科(Oligorinae)、花鲈属(Lateolabrax),因其具有生长快、抗病强、营养丰富、味道鲜美特点,成为我国主要的养殖海水鱼品种之一。花鲈捕捞后可以通过低温诱导休眠的方式进行无水保活,花鲈生态冰温零点温度(临界温度)为4 ℃,经低温无水保活运输后,恢复常温的鱼体可回到正常状态并存活一段时间。
VC既是一种具广泛生理功能的营养素,又是一种具免疫作用的免疫调节因子,有明显的抗感染作用,但许多硬骨鱼类自身缺少合成VC的酶,必须通过饲料或食物获得[1-2]。研究表明,花鲈幼鱼、大黄鱼血清溶菌酶活力随着VC添加量的增加而升高[2-3]。姜(Zingiber officinale)性味辛、微温,药用其根茎,具有调节机体免疫功能的作用[4]。李晓璐等[5]将生姜液运用在脆肉鲩的活体运输实验中,有效地提高了其24 h运输的存活率。溶菌酶是一种低分子质量、不耐热的碱性蛋白,作为机体非特异免疫因子之一,其参与了机体的多种免疫反应,在机体正常防御功能和非特异免疫中具有保持机体生理平衡的重要作用[6-7]。研究表明溶菌酶的应用能极大延长海产品或水产品的保鲜期,可为贮藏、运输等带来诸多方便[8]。山梨糖醇分子可提高鱼体表保水性,低温下蛋白酶变性程度低,起到抗冻效果[9]。本实验尝试在花鲈暂养、运输过程中加入保护液,然后进行模拟无水活运,考察采用保护液的保活新工艺对花鲈血液生化指标、鳃组织Na+/K+-ATPase活性、血清溶菌酶活性、免疫球蛋白M(immunoglobulin M,IgM)水平等鱼体非特异性免疫能力指标的影响,将保护液包装新工艺与传统湿木屑包装工艺运输后鱼体情况做对比,为升级无水活运包装工艺提供参考。
1 材料与方法
1.1 材料与试剂
花鲈鱼购自上海芦潮港水产品市场。挑选体质健康、无外伤、鳞片完整、大小基本一致(长40 cm)的活花鲈鱼作为实验材料。实验用水:由经颗粒活性炭过滤后曝气的自来水和海盐配制而成,实验开始前的1 d配制,连续曝气24 h后用于实验。所制得水的性质:水温22~23 ℃、盐度16‰~17‰、溶解氧4~6 mg/L、pH 7.5~8.5[10]。
溶菌酶、纯度98%山梨糖醇(14.7 kDa) 上海生工生物工程有限公司。
1.2 仪器与设备
LX-100VTR模拟运输振动台 上海鲁轩仪器设备厂;SH-1000Lab-全波长酶标仪 北京宏昌信科技有限公司;5810R高速冷冻离心机 上海艾测电子科技有限公司;BS-200全自动生化分析仪 深圳迈瑞生物医疗电子股份有限公司;乳酸测定试剂盒、ATP酶试剂盒、溶菌酶测试盒、IgM测试盒 南京建成生物工程研究所。
1.3 方法
1.3.1 花鲈鱼的暂养
采用周期饥饿驯化花鲈[11],喂食1 d饥饿3 d,两周期;喂食早晚各一次,投喂鱼体质量10%饲料;暂养水中加入VC(25、30 mg/L)[12],CK组暂养水中不加VC,暂养密度1 尾/50 L;禁食暂养时间12 h;先暂养后冷驯化,冷水机按照3 ℃/h降温速率将暂养箱中水温从22~23 ℃降至临界生态温度4 ℃;此时,鱼体呼吸频率(24±3)次/min,呼吸不规律,鱼体失去平衡、鱼腹朝上,裂鳃,刺激反应迟钝。
1.3.2 配制保护液G
保护液G包括:溶菌酶0.08%~0.10%(质量分数,下同)、山梨糖醇0.2%~0.4%、生姜液0.6%~1%,盐度为16‰~17‰,pH 7.5~8.5,剩余为水。
姜液制备[5]:取栽种4 个月嫩姜洗净、沥干,此时的姜纤维细、味道微辣,不含较多姜辣素,姜辣素对花鲈的刺激小;带皮用榨汁机榨汁(每千克原料加入约150 mL蒸馏水进行混合榨汁),并用200 目纱布过滤,收集姜汁,隔水加热至沸腾,装入带盖容器,放至常温,盖上盖子冷却至4 ℃,备用。
1.3.3 鱼的处理与运输
将暂养箱中触摸应激反应十分微弱的鱼捞出,将鱼分为6 个实验组和CK组,具体见表1,每组样品30 条,实验总数为210 条。CK组不添加保护液暂养12 h,降温休眠后捞出,直接装入带有湿木屑(木屑事先放入4 ℃、盐度16‰~17‰、pH 7.5~8.5的水中浸湿)的泡沫箱中。实验组放入保护液G中浸渍2~3 s后,按1 条/箱放于泡沫箱内,注意用保护液涂抹鱼身各部位(包括鱼鳃)。然后将两组鱼装入塑料袋内(1 箱/袋),充入氧气(氧浓度监测仪)80%、扎紧袋口[13],放入振动台上的大保温箱内,保持4 ℃运输温度。
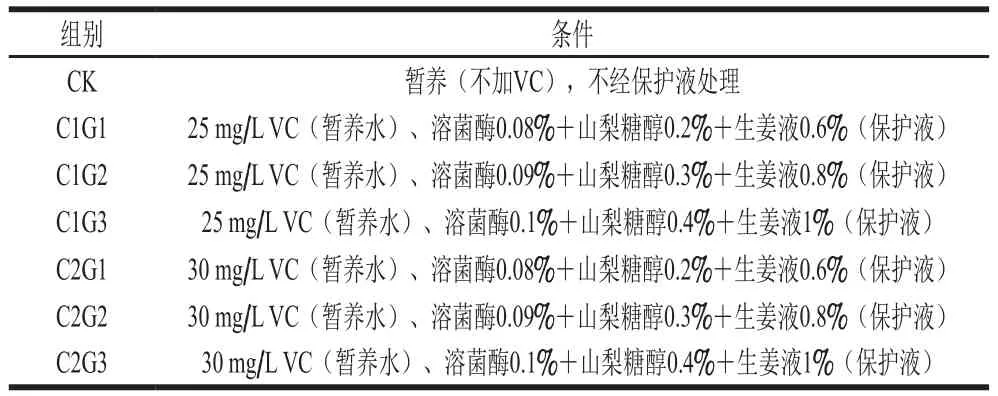
表1 暂养结合不同浓度保护液实验组Table 1 Combinations of temporary culture and protective solutions
在振动台上进行模拟运输实验,运输过程:B级路面1 h(80 km/h)→A级路面5 h(100 km/h)→B级路面2 h(80 km/h)[14-15]。模拟运输结束后,打开包装,取出鱼,放入养殖水中,以5 ℃/h升温速率将水温升至22~23 ℃唤醒(由预实验确定),观察唤醒过程中鱼的反应并记录唤醒结束后死亡率。
花鲈鱼生理指标检测时间点为:运输开始0 h(暂养结束,未涂保护液)和运输1、2 h和8 h(运输结束时)及唤醒后。每个测试点随机选取5 条鱼进行指标测试。
1.3.4 样品处理
木棒敲击花鲈致死,称质量并量体长,采用1 mL一次性医用注射器(预先用1 g/100 mL肝素钠溶液润洗)尾部静脉取血,采取血样在4 ℃冰箱放置2 h后,4 ℃、10 000 r/min离心5 min制备血清,血清移入-80 ℃保存备用。
鱼采血后,取两侧第二鳃弓的鳃丝,用生理盐水洗净吸干水分,用生理盐水配成10 mg/mL组织均浆,4 ℃、3 000 r/min离心10 min,取上清液-80 ℃保存备用。
1.3.5 血液生化指标的测定
总蛋白、白蛋白、尿素、肌酐、尿酸、血糖质量浓度采用全自动生化分析仪测定,单位均为g/L。乳酸浓度采用乳酸测定试剂盒测定,单位为nmol/L。
1.3.6 组织指标测定
鳃Na+/K+-ATPase活力采用ATP酶试剂盒定,单位为U/mg。
1.3.7 血液非特异性免疫能力指标测定
血清溶菌酶、IgM质量浓度分别采用溶菌酶测试盒、IgM测试盒测定。
1.4 数据处理与分析
应用SPSS 19.0软件对实验数据进行统计分析,结果以 ±s表示,显著性分析采用Duncan多重比较法,P<0.05表示显著性差异。
2 结果与分析
2.1 不同处理对花鲈无水活运过程中血液生化指标的影响
2.1.1 不同处理对花鲈无水活运过程中血清总蛋白、白蛋白质量浓度的影响
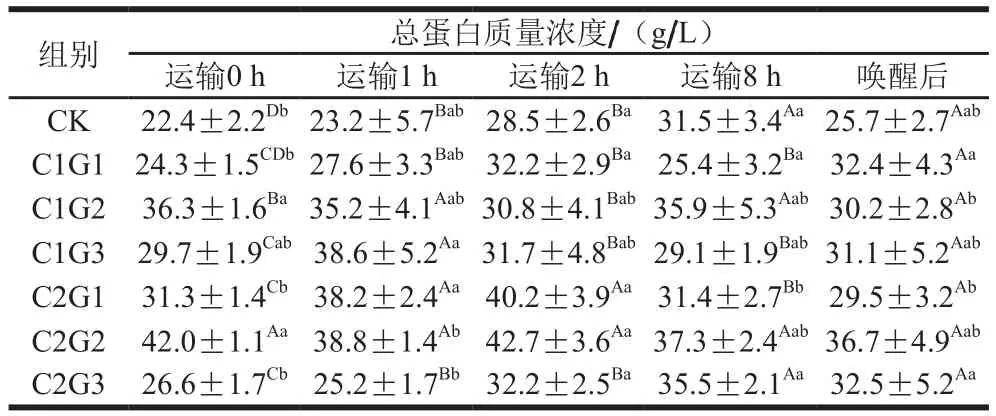
表2 不同处理对花鲈无水活运过程中血清中总蛋白质量浓度的影响Table 2 Effects of different treatments on serum total protein concentration during waterless transportation of Lateolabrax maculatus

表3 不同处理对花鲈无水活运过程中血清中白蛋白质量浓度的影响Table 3 Effects of different treatments on serum albumin concentration during waterless transportation of Lateolabrax maculatus
在生态冰温无水保活过程中,花鲈血清中的总蛋白、白蛋白质量浓度能准确反映机体蛋白质的吸收与代谢,以及肝功能的代谢情况。白蛋白由肝脏合成,在血液中起着载体的作用,与血液中大部分水分、胆红素、尿酸、钙等结合而进行运送,与代谢、营养关系密切,当长期处于不良状态时,白蛋白含量会显著下降[16]。由表2、3可知,运输0 h,CK组花鲈血清中的总蛋白和白蛋白质量浓度显著低于各保护液处理组(P<0.05),这说明暂养水中加入VC有助于提高花鲈肝功能,降低鱼类的应激反应,其中30 mg/L添加量效果明显。唤醒后与保活过程中相比,半数以上保护液使用组花鲈血清中的总蛋白和白蛋白质量浓度没有显著性差异(P<0.05),表明包装运输前对鱼身涂抹保护液可维持花鲈鱼体代谢稳定。C2G2保护液使用组花鲈在保活运输过程中血清中的总蛋白和白蛋白质量浓度保持稳定,且高于其他保护液处理组。唤醒后,花鲈由于处于无水、缺氧状态,总蛋白和白蛋白质量浓度都显著下降(P<0.05)。与保活运输8 h后相比,鱼体与唤醒后(水中复苏后)总蛋白和白蛋白质量浓度变化不显著(P<0.05),表明运输结束后,鱼体肝功能不能在短时间内恢复正常。
2.1.2 不同处理对花鲈无水活运过程中血清尿素、肌酐、尿酸质量浓度的影响

表4 不同处理对花鲈无水活运过程中血清尿素质量浓度的影响Table 4 Effects of different treatments on serum urea concentration during waterless transportation of Lateolabrax maculatus

表5 不同处理对花鲈无水活运过程中血清肌酐质量浓度的影响Table 5 Effects of different treatments on serum creatinine concentration during waterless transportation of Lateolabrax maculatus

表6 不同处理对花鲈无水活运过程中血清尿酸质量浓度的影响Table 6 Effects of different treatments on serum uric acid concentration during waterless transportation of Lateolabrax maculatus
尿素、肌酐、尿酸水平是反映肾功能代谢情况的重要指标,尿素是氮化合物代谢的产物,也是维持血液渗透压的主要成分[17]。由表4可看出,CK组血液中尿素水平偏高,使用保护液之后各使用组的尿素水平显著下降(P<0.05)。肌酐水平是肾脏机能的一个重要指标,肾脏机能发生障碍时,血液中肌酐含量会升高。由表5可知,除CK、C1G1、C1G2组外,花鲈无水活运过程中肌酐水平随运输时间延长而下降,唤醒后有所回升,保活过程中各组肌酐水平有所差异,C2G2保护液使用组肌酐水平未见明显上升。肾功能减退时尿酸质量浓度会升高,表6显示CK组尿酸水平在保活运输过程中显著升高(P<0.05),添加保护液后尿酸水平上升速率减缓,唤醒后回落,C2G2组尿酸水平变化不明显,说明在保活运输中鳃、肾功能部分受到抑制。CK组血清尿素、肌酐、尿酸水平持续递增,运输8 h时出现最高值,表明随运输时间延长代谢废物在血液中有积累,长时间的无水环境造成花鲈体内代谢废物无法及时排出,这是花鲈不能长时间无水运输的重要因素之一。使用保护液后,运输过程也会导致3 个指标数值有所上升,其中8 h较高,唤醒后有所下调,表明花鲈在低温无水条件下保活代谢废物会在体内累积,并在唤醒后得到改善,但还不能确定鱼体是否因此受到不可逆损伤[18]。使用保护液可有效降低花鲈鳃、肾功能损伤,综合比较下C2G3组保活效果最好,保护液在花鲈体表形成一层保护膜的同时也有利于鱼体将代谢废物排出,保护液起到促进鱼体与外界物质交换作用。
2.1.3 不同处理对花鲈无水活运过程中血清中血糖、乳酸水平的影响

表7 不同处理对花鲈无水活运过程中血清血糖质量浓度的影响Table 7 Effects of different treatments on serum glucose concentration during waterless transportation of Lateolabrax maculatus

表8 不同处理对花鲈无水活运过程中血清乳酸浓度的影响Table 8 Effects of different treatments on the concentration of lactate in serum during the waterless transport of Lateolabrax maculatus
血糖是鱼体生理活动所需能量的来源之一。从表7中可看出,CK组血糖质量浓度在整个保活运输0~2 h上升可能是因为应激反应;除C2G1、C2G3组外,各处理组运输8 h后唤醒过程中血糖质量浓度下降可能是能量消耗造成的,徐中平[19]发现低温处理后的星斑川鲽血糖浓度显著升高。运输0 h时,CK组与各保护液使用组相比血糖质量浓度差异不显著(P>0.05),这表明暂养过程中添加VC对花鲈血糖水平影响不大。使用保护液后,运输1 h与0 h相比,血糖水平降低,运输时间延长血糖水平还是会出现因积累显示较高水平,使用保护液已经很大程度降低了花鲈运输应激。
乳酸是葡萄糖在无氧条件下发生酵解提供能量时的产物,肌肉产生的乳酸大部分会进入血液,而乳酸浓度增加会对血液中血红蛋白运输氧的能力产生影响,导致血液最大氧结合量减少。从表8可以看出,各处理组血清中乳酸浓度在运输2 h内显著上升(P<0.05),血液中血糖浓度上升进而造成了肌肉乳酸浓度上升,导致鱼体供氧量减少。此结果与戴志远等[20]研究的紫贻贝无水保活过程中乳酸浓度变化一致,这可能也是限制保活时间进一步延长的重要因素之一。与CK组相比,各保活液处理组在运输8 h时乳酸积聚量减少。运输0 h,CK组与各保护液使用组相比乳酸浓度差异不显著(P>0.05),说明暂养过程中VC添加量对花鲈血清中乳酸浓度的影响也不明显。
2.2 不同处理对花鲈无水活运过程中鳃组织指标的影响
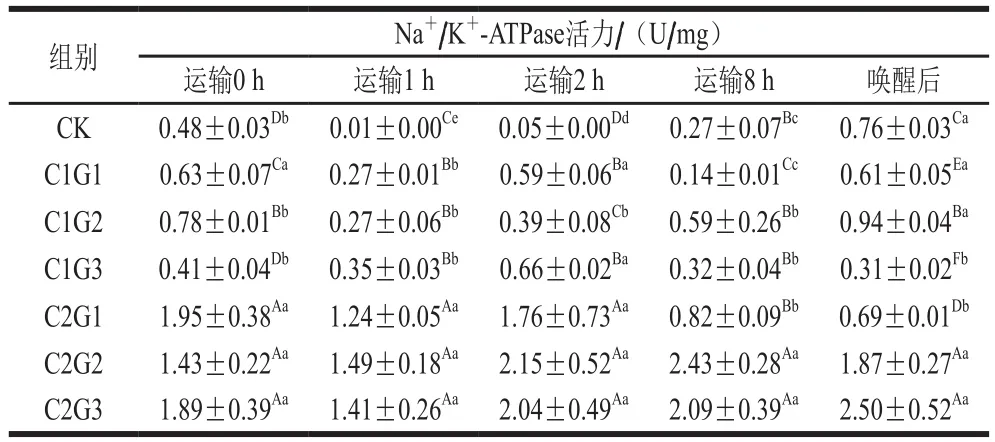
表9 不同处理组对花鲈无水活运过程中鳃组织Na+ /K+-ATPase活力的影响Table 9 Effects of different treatments on gill NKA activity during waterless transportation of Lateolabrax maculatus
Na+/K+-ATPase的主要生物学意义在于其为逆浓度差和电位差转运物质,即一旦膜上的离子通道开放,Na+、K+会迅速顺浓度差跨膜扩散[21-22]。由表9可知,运输0 h,暂养水中加入VC显著提高了鳃组织细胞中的Na+/K+-ATPase活力(P<0.05),且随VC添加量增加而增加,可能是因为VC提高了花鲈的抗氧化酶活性,减少了花鲈低温条件下的氧化应激。孔祥会等[23]低温驯化锯缘青蟹并研究发现其抗氧化防护与ATPase活性有关系。运输过程中,使用保护液维持了鱼鳃丝细胞内Na+/K+-ATPase的活性[24],完成正常的离子转运。C2G2组鳃Na+/K+-ATPase活力最强,因而可以更好地维持细胞内外离子水平的稳定性,使鳃细胞得以保持正常生理功能。
2.3 保活过程中花鲈非特异性免疫指标的分析
2.3.1 不同处理对花鲈无水活运过程中血清中溶菌酶水平的影响
溶菌酶是生物体内非特异性免疫防御体系中具有广谱抗菌作用的碱性酶,具有抗菌、消炎、抗病毒等作用[25]。溶菌酶广泛分布于鱼体的黏液、血清和某些淋巴组织中,是鱼类非特异性免疫系统的重要组成部分[26]。生态冰温无水活运过程中花鲈持续处于低温环境下。不同学者在对罗非鱼进行低温驯化研究中认为在低温环境下非特异性免疫占有主导地位[27-29]。由表10可知,CK组血清中溶菌酶质量浓度明显较低,说明在暂养水中添加VC可以明显提高花鲈血清中溶菌酶活力,但降温处理还是造成了所有处理组过低的溶菌酶活力,保护液使用组血清溶菌酶质量浓度随运输时间的延长不再下降,反而明显升高。一方面可能是因为保护液中加入了溶菌酶,一定程度上补足了环境因素造成的溶菌酶消耗;另一方面可能是因为保护液中添加了生姜液,生姜可激活单核细胞的分泌功能,使溶菌酶大量释放,促使溶菌酶质量浓度增高。研究表明生姜液可使小鼠血清溶菌酶活性显著增高,但不同剂量引起溶菌酶活性变化的程度有所不同[30]。运输8 h时C2G2组溶菌酶活力最高,为CK组7.68 倍,运输8 h唤醒后,花鲈血清中溶菌酶质量浓度维持较高水平,这可能是由于水温的升高提升了溶菌酶活力。
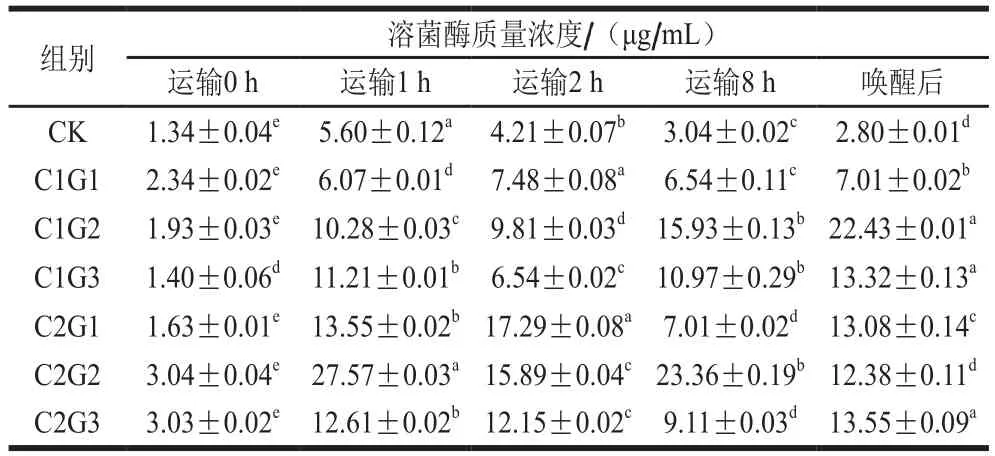
表10 不同处理组对花鲈无水活运过程中血清溶菌酶质量浓度的影响Table 10 Effects of different treatments on serum lysozyme concentration during waterless transportation of Lateolabrax maculatus
2.3.2 不同处理对花鲈无水活运过程中血清中IgM水平的影响
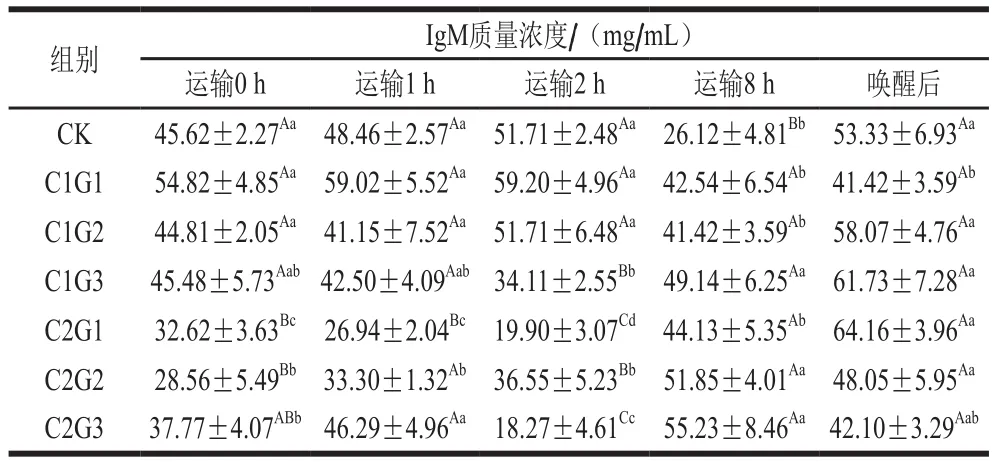
表11 不同处理组对花鲈无水活运过程中血清IgM质量浓度的影响Table 11 Effects of different treatments on serum IgM concentration during waterless transportation of Lateolabrax maculatus
IgM是硬骨鱼体内一种重要免疫球蛋白,因此IgM质量浓度通常被认定为是评价鱼体免疫应答反应的重要指标[31]。由表11可见,温度对鱼类免疫系统的影响非常复杂,有学者认为低温可以减慢代谢循环因而抑制或延迟抗体的释放[29]。花鲈低温无水活运过程全程处于低温环境,可能导致了IgM质量浓度降低。侯亚义等[32]报道了虹鳟血浆中IgM的浓度是温度依赖型的,即高温时它们的浓度升高,反之浓度降低。运输0 h(暂养结束未涂抹保护液),IgM质量浓度随暂养水中VC添加量的升高而降低,VC可增强鱼体免疫应答耐受性。使用保护液一定程度上可增强花鲈细胞免疫功能和机体抗感染能力。
2.4 经不同处理的花鲈无水活运结束后的死亡率
将生态冰温无水活运后的花鲈放入4 ℃水中以5 ℃/h速率升温至22~23 ℃唤醒,可以观察到鱼尾摆动幅度越来越大,鱼鳃开始不规律地开闭,呼吸频率越来越大,逐渐接近正常水平,鱼体恢复正常的游动。

表12 不同处理对花鲈无水活运结束后死亡率的影响Table 12 Effect of different treatments on mortality after waterless transportation of Lateolabrax maculatus
如表12所示,花鲈常温水中唤醒后8 h各组均出现死鱼现象,且随着时间的延长,花鲈死亡率不断升高。这是因为花鲈经过降温、包装、运输、唤醒过程中的应激,体内能量不足,免疫系统紊乱。暂养水中加入VC可以增强花鲈免疫机能,又具有抗感染作用。保护液中的生姜、溶菌酶、山梨糖醇具有保持机体生理平衡、抗应激、抗冻的作用。研究加入保护液后花鲈死亡率呈下降趋势,且剂量越高效果越明显。唤醒结束后1 d死亡率数据表明,运输期间使用保护液能延长花鲈运输后存活时间,为商业销售提供时间保障。
3 结 论
花鲈通过低温诱导休眠的方式进行无水保活,禁食暂养12 h后冷驯化至临界冰温4 ℃,包装后振动台模拟无水保活时间可达到8 h,以5 ℃/h速率升水温至22~23 ℃唤醒后鱼体可回到正常状态并存活一段时间。现有的包装运输技术花鲈唤醒1 d之内的死亡率高,并没有为保活运输后的销售争取时间。本实验研究以保护液包装取代现的湿木屑包装,可节省更多运输空间,提高花鲈无水活运效果,花鲈无水活运后死亡率降低了1%~5%,延长了销售期,可获得更高的经济效益。
研究结果表明,无水保活花鲈鱼暂养水中加入30 mg/L VC,暂养12 h,冷驯化后包装前浸入G2(溶菌酶0.09%+山梨糖醇0.3%+生姜液0.08%)保护液中涂抹,取出后独立包装进行无水活运效果最好。保护液中的生姜可使花鲈血清溶菌酶质量浓度显著增高,保护液中不同生姜剂量可引起溶菌酶活性变化的程度不同。暂养和运输过程中加入保护液可增强花鲈肝、肾功能及能量代谢,维持鳃组织正常离子运转,一定程度上可增强花鲈细胞免疫功能和机体抗感染能力。
