外源p-香豆酸处理对采后桃果实苯丙烷代谢和抗氧化能力的影响
2020-01-08李姚瑶曹毛毛王小璐苏金龙
李姚瑶,曹毛毛,王小璐,苏金龙,高 慧
(西北大学食品科学与工程学院,陕西 西安 710069)
桃(Prunus persica L.)果实清脆爽口,细腻甘甜,富含氨基酸、维生素和酚酸等多种营养物质,是有益于人体健康的果中佳品[1]。然而,桃果实皮薄多汁,且成熟于炎热潮湿的夏季,采后极易遭受机械损伤和微生物侵染,导致桃果实失水萎蔫、软化腐烂,极大地降低了桃果实的食用品质[2]。低温贮藏是延缓果蔬衰老和保持果蔬品质的有效手段。但桃属典型的冷敏性果实,低温贮藏过程中易受到低温胁迫,并表现出果肉褐变、风味丧失及无法正常后熟等冷害症状[1]。针对这一问题,研究人员进行了桃果实冷害发生和发展机理的相关研究,并通过采取物理(如紫外照射、气调包装等)、化学(如钙处理、1-甲基环丙烯熏蒸)等采后处理措施增强桃果实的耐冷性[3]。
p-香豆酸(p-coumaric acid,p-CA)是一种广泛存在于果蔬中的肉桂酸衍生物,也是苯丙烷代谢途径的核心物质[4-5]。有研究表明,p-CA可以通过发生氧化交联反应参与木质素合成,进而维持细胞膜脂系统的完整性[6];还可以通过提供质子氢清除活性氧来抑制脂质过氧化作用[7]。近年来,p-CA作为新型褐变抑制剂,已被用于采后园艺作物的贮藏保鲜[8]。Hu Yonghua等[9]发现10 μmol/L p-CA浸泡双孢蘑菇(Agaricus bisporus),在延期缓褐变发生的同时,还能延长蘑菇的货架期;这主要归因于p-CA对蘑菇酪氨酸酶活力的抑制作用。但有关p-CA对冷敏果实耐冷性影响的相关报道较少。本研究从苯丙烷代谢和抗氧化能力两方面研究了0.5 mmol/L p-CA对采后桃果实耐冷性影响,以期为冷敏果实采后低温贮藏保鲜提供新的方法和理论依据。
1 材料与方法
1.1 材料与试剂
试材为商业成熟度‘沙红'桃果实,采摘于西安市城郊果园,并于采摘当日运回实验室。散去田间热后,挑选大小均一、果皮色泽一致,且无可见缺陷的桃果实用于本次实验。
莽草酸、烟酰胺腺嘌呤二核苷酸基磷酸(nicotinamide adenine dinucleotide phosphate,NADP+)、p-CA、腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)、辅酶A(coenzyme A,CoA)、反式肉桂酸 上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、没食子酸 美国Sigma公司;L-苯丙氨酸 美国Amresco公司;其余试剂为国产分析纯。
1.2 仪器与设备
超低温冷冻箱 中科美菱低温科技股份有限公司;TCL-20Br高速冷冻离心机 上海安亭科学仪器厂;UPTC10L超纯水机 优普仪器有限公司;DIONEX UltiMate-3000高效液相色谱仪 美国Thermo Fisher公司;722G型可见分光光度计 上海仪器分析有限公司。
1.3 方法
1.3.1 材料处理
将桃果实随机分为3 组,分别用0(蒸馏水,对照)、0.5、1.0 mmol/L p-CA溶液常温浸泡10 min,摊开晾干后,放入低密度聚乙烯保鲜袋中,于4 ℃、相对湿度85%~90%低温库中贮藏28 d。每隔7 d进行取样,测定其冷害指数和丙二醛(malondialdehyde,MDA)含量,得到最优浓度,并收集果肉组织于-80 ℃冻藏,测定最优浓度组其他各项指标。每组处理均设3 个重复。
1.3.2 冷害指数的测定
冷害指数的测定参照Wang Lijun等[10]的方法,并略作修改。将桃果实沿缝合线剖开,观察果实切面的褐变面积,将其分为0~4级:0级,褐变面积=0;1级,褐变面积<25%;2级,25%≤褐变面积<50%;3级,50%≤褐变面积<75%;4级,褐变面积≥75%。冷害指数按式(1)进行计算。

1.3.3 MDA含量的测定
MDA含量的测定参照Dhindsa等[11]的方法。称取2 g桃果肉,加入6 mL、体积分数10%三氯乙酸溶液(含质量分数6%巴比妥酸)研磨后,加热煮沸10 min,迅速冷却、离心。在450、532、600 nm波长处测定上清液吸光度。结果以鲜质量计,MDA含量表示为μmol/g。
1.3.4 酚类物质代谢相关酶活力测定
对于苯丙氨酸脱氨酶(phenylalanine ammonia lyase,PAL)、莽草酸脱氢酶(shikimate dehydrogenase,SKDH)、肉桂酸-4-羟化酶(cinnamate-4-hydroxylase,C4H)、4-香豆酸辅酶A连接酶(4-coumarate: coenzyme A ligase,4CL)、多酚氧化酶(polyphenol oxidase,PPO)和过氧化氢酶(peroxidase,POD),参照Gao Hui等[12]的方法提取粗酶液并测定其活力。定义反应体系在290 nm波长处每秒吸光度升高0.01为1 个PAL活力单位(U);反应体系在340 nm波长处每秒吸光度升高0.01为1 个SKDH、C4H活力单位(U);反应体系在333 nm波长处每秒吸光度升高0.01定义为1 个4CL活力单位(U);其中反应体系在420 nm波长处每秒吸光度升高0.01定义为1 个PPO活力单位(U);反应体系在470 nm波长处每秒吸光度升高0.01为1 个POD活力单位(U)。以上酶活力单位均为U/g,结果以鲜质量计。
1.3.5 内源p-CA含量的测定
内源p-CA的提取:称取6 g桃果肉,加入35 mL甲醇匀浆后,超声30 min,离心,收集上清液,残渣重复提取2 次。将合并上清液旋转蒸发浓缩至10 mL左右,以色谱纯甲醇定容至25 mL,经0.22 μm有机系滤膜过滤,收集滤液备用。
测定条件:流动相:A为甲醇,D为体积分数0.1%甲酸;洗脱梯度:0~5 min,85%~78% D;5~10 min,78%~70% D;10~15 min,70%~64% D;15~16 min,64%~85% D;流速1 mL/min,柱温30 ℃,波长308 nm,进样量10 μL,时长16 min。检测器:UltiMate-3000二极管阵列检测器,色谱柱:ZORBAX SB-C18色谱柱(4.6 mm×150 mm,5 μm)。以外标法测定内源p-CA含量,单位为μg/g,结果以鲜质量计。
1.3.6 总酚含量的测定
参照Hinneburg等[13]的方法测定。称取2 g桃果肉于6 mL 80%甲醇匀浆,离心后,收集上清液作为总酚粗提液。取0.5 mL上清液,依次加入1 mL福林-酚试剂、3 mL 1 mmol/L Na2CO3溶液,混匀后,以蒸馏水定容至10 mL,避光反应1 h,760 nm波长处测定吸光度。以没食子酸作标准曲线,计算总酚含量。结果以鲜质量计,总酚含量表示为mg/g。
1.3.7 DPPH自由基、羟自由基、O2-·清除率测定
以总酚粗提液进行测定。参照Odriozola-Serrano等[14]的方法测定DPPH自由基清除率。取0.2 mL上清液,加入2.8 mL 0.15 mmol/L DPPH甲醇溶液,避光反应30 min。于517 nm波长处测定吸光度。
参照Zhuang Hong等[15]的方法测定羟自由基清除率。取0.5 mL 9 mmol/L FeSO4溶液、0.5 mL 9 mmol/L水杨酸-乙醇溶液、0.5 mL上清液、5.4 mL蒸馏水和0.1 mL 8.8 mmol/L H2O2混合摇匀后,37 ℃水浴30 min。于510 nm波长处测定吸光度。
参照陈旭丹等[16]的方法测定O2-·清除率。取2.7 mL 50 mmol/L Tris-HCl(pH 8.3)和0.2 mL上清液,25 ℃水浴20 min,加入0.1 mL 1.5 mmol/L连苯三酚。于320 nm波长处测定吸光度。
DPPH自由基、羟自由基、O2-·清除率均按式(2)进行计算。

式中:A0为以甲醇代替总酚粗提液吸光度;A1为含总酚粗提液样品吸光度。
1.4 数据处理与分析
以上指标测定均取3 个平行样,重复测定3 次。采用SPSS 19.0软件进行数据分析,采用单因素方差分析进行显著性差异分析,P<0.05为差异显著。采用Origin 8.5软件绘图。
2 结果与分析
2.1 p-CA处理对桃果实冷害指数和MDA含量的影响
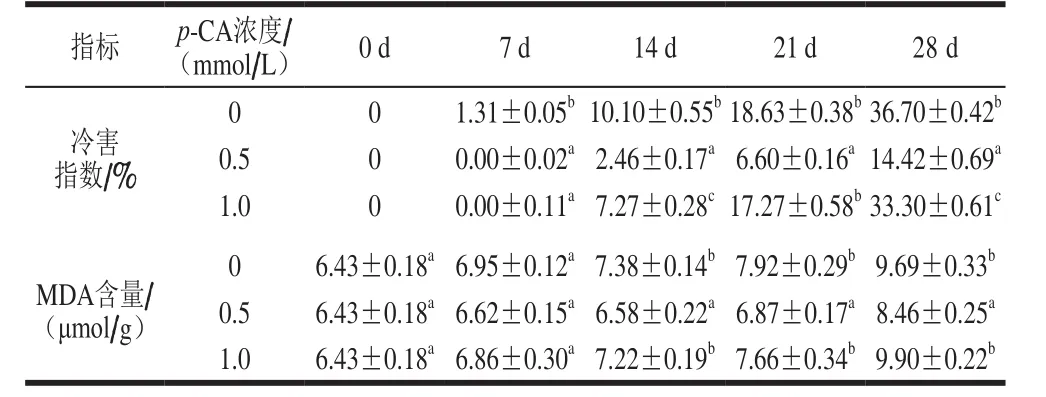
表1 p-CA处理对桃果实冷害指数和MDA含量的影响Table 1 Effect of p-CA treatment on CI index and MDA content in peach fruit
如表1所示,对照桃果实贮藏期间,其冷害指数随贮藏时间的延长逐渐增加。与对照处理(0 mmol/L p-CA)相比,0.5 mmol/L p-CA处理可显著抑制桃果实冷害的发生(P<0.05);而相较于0.5 mmol/L p-CA处理,1.0 mmol/L p-CA处理则促进了桃果实冷害指数的增加。贮藏第28天时,0.5 mmol/L p-CA处理桃果实的冷害指数较对照果实降低60.71%。MDA是细胞膜脂过氧化终产物,其含量可反映桃果实冷害发生的严重程度。对照桃果实MDA含量随贮藏时间的延长亦呈缓慢上升趋势变化,0.5 mmol/L p-CA处理显著抑制了桃果实MDA含量的增加(P<0.05),而1.0 mmol/L p-CA处理则与0.5 mmol/Lp-CA处理相比,促进了桃果实MDA的累积。贮藏结束时,0.5 mmol/L p-CA处理桃果实的MDA含量较对照桃果实降低12.69%。因此,选定0.5 mmol/L p-CA用于后续实验。
2.2 p-CA处理对桃果实酚类物质合成相关酶活力的影响
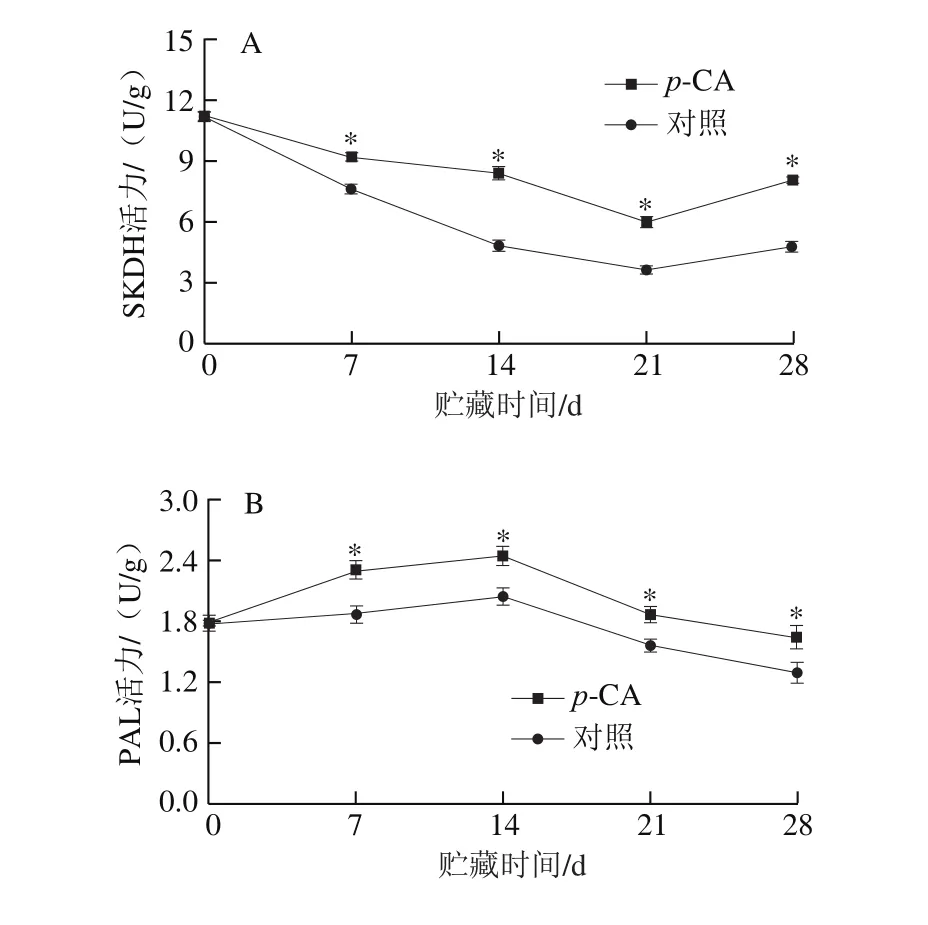

图1 p-CA处理对桃果实酚类物质合成相关酶活力的影响Fig. 1 Effect of p-CA treatment on the activities of phenolic synthesis enzymes in peach fruit
SKDH是催化莽草酸生成L-苯丙氨酸的关键酶。如图1A所示,对照桃果实的SKDH活力在贮藏的前21 d逐渐降低,随后上升。贮藏第21天时,对照桃果实的SKDH活力较采收当天降低67.85%。p-CA处理显著提高了桃果实的SKDH活力(P<0.05),贮藏末期时,p-CA处理桃果实的SKDH活力为对照桃果实的1.67 倍。
PAL、C4H、4CL是苯丙烷代谢途径的3 个关键酶。如图1B所示,对照和p-CA处理桃果实的PAL活力变化趋势相似,贮藏前14 d缓慢上升随后逐渐下降,并于贮藏第14天达到峰值,其中p-CA处理桃果实的PAL活力为对照桃果实的1.20 倍。且整个贮藏期内,p-CA处理桃果实的PAL活力始终显著高于对照桃果实(P<0.05)。
如图1C、D所示,p-CA处理显著提高了桃果实的C4H和4CL活力(P<0.05)。p-CA处理桃果实的C4H和4CL活力在贮藏第21天均出现峰值,其活力分别为对照桃果实的1.45 倍和1.22 倍。整个贮藏期内,p-CA处理桃果实的C4H和4CL活力始终高于对照桃果实。
2.3 p-CA处理对桃果实酚类物质氧化相关酶活力的影响
PPO和POD是苯丙烷代谢途径末端的两个氧化酶,可氧化果蔬中酚类化合物形成褐色物质。如图2A所示,整个贮藏期内,对照和p-CA处理桃果实的PPO活力呈下降、升高波动趋势变化,并于贮藏第14天出现峰值,此时对照桃果实的PPO活力较p-CA处理桃果实高16.67%。如图2B所示,对照桃果实的POD活力呈先升高再降低再升高趋势变化。贮藏结束时,对照桃果实的POD活力是p-CA处理桃果实的1.26 倍。P-CA处理显著抑制了桃果实的PPO和POD活力(P<0.05)。

图2 p-CA处理对桃果实酚类物质氧化相关酶活力的影响Fig. 2 Effect of p-CA treatment on phenolic oxidase activity in peach fruit
2.4 p-CA处理对桃果实中内源p-CA和总酚含量的影响

图3 p-CA处理对桃果实中内源p-CA(A)和总酚(B)含量的影响Fig. 3 Effect of p-CA treatment on endogenous p-CA (A) and total phenolic (B) contents of peach fruit
p-CA是植物苯丙烷代谢途径的核心物质。如图3A所示,对照桃果实的内源p-CA含量呈先上升后下降趋势变化。p-CA处理显著增加了桃果实的内源p-CA含量(P<0.05),贮藏第14天时,p-CA处理桃果实的内源p-CA含量是果实贮藏第0天的14.47 倍。如图3B所示,对照桃果实的总酚含量随贮藏时间延长逐渐降低,贮藏结束时,对照桃果实的总酚含量比果实贮藏第0天低37.65%。p-CA处理显著诱导了桃果实总酚含量的增加(P<0.05)。贮藏前14 d,p-CA处理桃果实总酚含量缓慢增加并于第14天达到峰值,此时总酚含量为对照桃果实的1.64 倍,随后总酚含量逐渐下降直至贮藏结束。整个贮藏期内,p-CA处理桃果实的总酚含量始终高于对照桃果实。
2.5 p-CA处理对桃果实DPPH自由基、羟自由基、清除率的影响
如图4所示,在贮藏的前14 d,对照桃果实的DPPH自由基、羟自由基、O2-·清除率逐渐下降,之后趋于稳定;相关性分析显示,对照桃果实中总酚含量与DPPH自由基、羟自由基清除率呈显著正相关关系,其相关系数分别为0.989 5和0.991 7;对照果实中总酚含量和O2-·清除率呈一定正相关关系(r=0.592 9)。p-CA处理显著提高了桃果实对3 种自由基的清除率(P<0.05),且p-CA处理桃果实中内源p-CA含量与DPPH自由基、羟自由基和O2-·清除率呈显著正相关关系,其相关系数r分别为0.913 5、0.968 3和0.878 6;p-CA处理桃果实中总酚含量与3 种自由基的清除率呈一定正相关关系。

图4 p-CA处理对桃果实DPPH自由基(A)、羟自由基(B)、(C)清除率的影响Fig. 4 Effect of p-CA treatment on scavenging capacity against DPPH (A),hydroxyl (B) and superoxide anion (C) radical in peach fruit
3 讨 论
桃果实是典型的冷敏性果实,采后不适宜低温贮藏且极易遭受低温伤害,尤以2.2~7.6 ℃时更为严重,并表现出果肉褐变、失去果实原有风味和更易遭受微生物侵袭等冷害症状,这严重影响了其市场价值[1]。本研究发现,p-CA是一种广泛存在于果蔬中的小分子酚酸,其外源处理可显著抑制桃果实冷害指数的增加,大大提高了桃果实的耐冷性(表1)。与p-CA相似,小分子酚酸(如水杨酸)已被证实可有效缓解低温胁迫对桃果实造成的损伤,延缓冷害的发生[17]。
低温胁迫下,果蔬组织的胞内活性氧代谢失衡,这使得自由基大量累积。累积的自由基可引发和或加剧膜脂过氧化,进而造成细胞膜脂系统的损伤[18]。MDA含量的高低可衡量细胞膜脂过氧化程度。本研究中,p-CA处理能显著抑制桃果实MDA含量的增加(表1)。这表明p-CA处理可有效提高桃果实对低温诱导氧化胁迫的抵御能力,抑制膜脂过氧化导致的细胞膜损伤。这与草酸、水杨酸等外源处理桃果实的研究结果[19-20]一致。
有研究表明,酚类物质在植物抵御低温胁迫过程中发挥着重要作用[21]。这基于酚类物质可提供质子氢清除活性氧,或通过分解过氧化物,减轻植物氧化损伤程度,维持细胞的正常结构和功能[22]。苯丙烷代谢途径是酚类物质的生物合成途径,SKDH、PAL、C4H和4CL是此途径中主要的合成代谢相关酶[23-24]。其中,SKDH催化莽草酸生成L-苯丙氨酸[23],之后L-苯丙氨酸在苯丙烷代谢关键限速酶PAL的作用下被转化为肉桂酸[25]。C4H则催化肉桂酸发生羟化反应生成p-CA,4CL作用于此途径的最后一步反应[21]。SKDH、PAL、C4H和4CL活力的高低与果实中酚类物质的含量直接相关[26]。经外源水杨酸处理的葡萄果实,其PAL、C4H和4CL活力显著升高,且水杨酸处理还诱导了PAL、C4H和4CL 3 种酶mRNA的累积[27],进而诱导了酚类物质的合成。本研究中,p-CA处理激活了SKDH、PAL、C4H和4CL活力(图1),且p-CA处理果实含有较高的总酚含量(图3B)。因此,推测p-CA处理可能通过诱导酚类物质合成酶相关基因的表达,促进总酚的累积。其中所涉及的具体机制将在后续的研究中进一步明确。PPO和POD可协同催化酚类物质氧化形成醌,醌再进一步聚合成棕色聚合物,致使果蔬褐变。在桃果实上,较高的PPO和POD活力已被证实与冷害导致的果肉褐变直接相关。本研究中,在整个贮藏过程中,与对照果实相比,p-CA处理果实的PPO和POD活力被显著抑制(图2),这使得酚类底物的氧化消耗减少(图3B),减轻了桃果实果肉褐变的冷害症状。本研究结果与Luo Zisheng等[28]的结果一致,该研究认为外源水杨酸处理通过调控PPO和POD活力显著减轻李果实果肉褐变,延缓冷害的发生。p-CA与酪氨酸结构相似,此二者可竞争PPO的活性位点[8],这可能是p-CA处理抑制桃果实PPO活力的机理。此外,p-CA处理还显著增加了桃果实的内源p-CA含量(图3A),这与Yang Zhenfeng等[29]的研究结果一致,即基于渗入,外源水杨酸处理可显著提高桃果实的内源水杨酸含量。
酚类物质是果蔬组织内一类重要的非酶抗氧化剂。卢娟芳等[30]认为,桃果实中酚类物质含量的高低与其抗氧化活性直接相关。本研究中,p-CA处理果实含有较高的内源p-CA和总酚含量,且内源p-CA含量均与DPPH自由基、羟自由基、O2-·清除率呈显著正相关。这表明p-CA处理可通过提高自由基清除能力,提高桃果实对低温冷害的抵御能力。
