荆半夏组织培养条件的优化
2019-12-30骆淑媛宋薇樊康华邓丽娟
骆淑媛 宋薇 樊康华 邓丽娟


摘要:以荆半夏的叶片、叶柄及块茎为材料,实验研究了不同激素浓度对半夏组织培养的影响。实验结果表明;在MS+2.0mg/L6-BA+0.5mg/LNAA诱导培养基中,叶片最易诱导形成愈伤组织,愈伤组织诱导率达100%;块茎次之,愈伤组织诱导率为90%;叶柄愈伤组织诱导率最低,为70肠,且容易出现褐化现象。而由叶片所形成的愈伤组织接种到MS+1.0mg/L6-BA+1.0mg/ NAA分化培养基中,出芽率最高,达100%,且试管苗长势旺盛;半夏最佳生根培养基为MS+0.2mg/L6-BA+0.3mg/LNAA。此研究有助于建立一套完整的荆半夏组织培养技术体系,为湖北地区特色经济药用植物荆丰夏的开发利用提供技术支持。
关键词:半夏;组织培养;愈伤组织
中图分类号:S567.23+9 文献标识码:A 文章编号:1674-9944(2019)22-0195-03
1 引言
半夏是天南星科半夏属,多年生草本药用植物,广泛分布于全国各地,具有抗癌、抗心律不齐等功效[1,2]。然而由于过度采挖及盲目引种,野生半夏的自然资源几近枯竭,品质和数量亦有所降低[3]。而通过组织培技术获得的半夏具有生长速度快、半夏品质高等特点,因此采用组织培养方式进行半夏的大规模生产已逐渐成为目前发展的趋势[4]。本研究取材自野生的荆半夏,就其组培过程中外植体的选择、培养基的激素配比等方面对荆半夏的快速繁殖的影响展开研究,为荆半夏种植资源选育、保存及开发利用提供参考。
2 材料与方法
2.1 材料
野生荆半夏。
2.2 方法
2.2.1 培养材料的消毒
将块茎洗净,削皮,叶片和叶柄不削皮,自来水冲洗5min后,用蒸馏水冲洗3次,然后用75%酒精浸泡30s,无菌水冲洗1次,最后用0.1%升汞溶液消毒8min后,用无菌水冲洗7次备用。
2.2.2 外植体的接种及诱导培养
将消毒好的半夏块茎于培养皿中切成约5mm×5mm的薄片;叶片切成约5mm×5mm大小;叶柄切成约5mm小段。然后将不同来源的外植体分别接种到MS+2.0mg/1.6-BA+0.5mg/ 1,NAA培养基中进行诱导培养,每组外植体分别接种20管,于26℃培养,光照周期12h/d,光照强度2000~3000lux。
2.2.3 分化培养
将愈伤组织切成约5mm×5mm小块,分别接种到4种不同激素配比的分化培养基中进行分化培养,每种培养基分别接种20管。
2.2.4 生根培养
将无根组培苗接种到4种不同激素配比的培养基上,进行生根培养,每种培养基分别接种20管。
3 结果与分析
3.1 半夏不同外植体的愈伤组织的诱导培养
将半夏的块茎、叶片和叶柄进行消毒处理后,分别接种到MS+2.0mg/L6-BA+0.5mg/LNAA诱导培养基中培养。7d后,外植体的切口处膨大;25 d后,3种外植体均诱导产生了黄绿色的愈伤组织(图1)。其中,叶片愈伤组织诱导率最高,達100%;块茎愈伤组织诱导率为90%;叶柄愈伤组织诱导率最低,为70%(表1),并且部分叶柄在诱导培养过程中出现褐化情况,褐化率为20%。因此,在MS+2.0mg/L6-BA+0.5mg/L NAA诱导培养基中,半夏叶片最易诱导形成愈伤组织,其次是块茎。
3.2 半夏叶片愈伤组织的分化培养
将叶片诱导所形成的愈伤组织分别接种到4种不同激素配比的分化培养基中进行分化培养。15d后,叶片愈伤组织分化率均达到90%以上。其中,在1号培养基中,发芽率为95%,但平均出芽数最高,达2.11个;而在4号培养基中,发芽率最高,达到100%,平均出芽数为1.92个,与最高出芽数差异不大,而且其分化形成的试管苗长势最为旺盛(表2)。综上所述,半夏叶片最佳分化培养基为MS+1.0mg/L6-BA+1.0mg/LNAA。
3.3 半夏组培苗的生根培养
挑选生长旺盛的组培苗,接种到4种不同激素配比的生根培养基中进行生根培养。15d后统计发现,单独使用0.3mg/L NAA分化培养基时,生根率为80%,但长出的根相对较短、较细;在0.3mg/LNAA基础上加人了0.2mg/L 6-BA时,生根高达100%,而且此时平均根长也达到最高,为2.73cm(表3)。但是当进一步提高NAA浓度时,生根率和根长反而有所下降(表3)。这表明半夏组培苗的最佳生根培养基为MS+0.2mg/L6-BA+0.3mg/L NAA;而且在生根培养过程中,NAA的浓度对植物的生根影响很大,尤其在低浓度时,在促进根的生长上起主导作用。
4 讨论
在组织培养过程中,由于外植体本身所具有的特性因子,会很大程度上决定其培养结果,因此,选择合适的外植体十分重要[5]。在半夏的组织培养过程中,一般会选用叶片、叶柄、块茎、茎尖以及珠芽等作为外植体[6~8],但关于最佳外植体的筛选,目前的研究结果存在一定的差异。吴能表等[9]研究发现,将产于重庆的三叶半夏的块茎、叶片和叶柄接种于MS+1.5mg/LKT+2.0mg/L 2,4-D+1.0mg/L IAA中诱导培养,均形成白色愈伤组织,其中叶柄的诱导形成愈伤组织的效率最高,达100%;叶片次之,为85%;块茎最低,愈伤组织诱导率仅为50%。喻娜等[10]发现,以MS+0.2mg/L 2,4-D+1.0mg/L KT诱导培养产于四川的野生旱半夏的叶片,其愈伤诱导率达98.3%;而采用MS+0.2mg/L2,4-D+0.5mg/L KT诱导叶柄,其愈伤诱导率达91.8%,叶片更利于愈伤组织诱导。而在本研究中,野生荆半夏的块茎、叶片和叶柄在MS+2.0mg/L 6-BA+0.5mg/L NAA培养基中均能诱导形成黄绿色愈伤组织,其中叶片的愈伤组织诱导率最高,达100%,与喻娜等研究结果基本一致。这表明,半夏品系及植物生长调节物质对愈伤组织的形成有较大的影响。
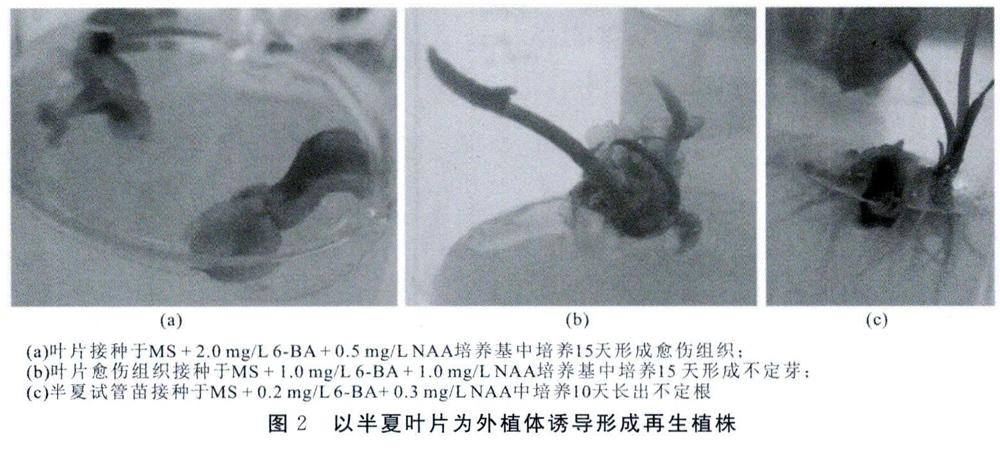
植物生长调节物质是影响植物细胞分裂、愈伤组织诱导、再生植株形成的重要因素,因此生长激素和细胞分裂素浓度配比是决定组培成功的关键[11,12]。在半夏快繁技术中,一般多采用KT、2,4-D、IAA、IBA和GA3等多种植物生长调节物质。在本研究中,我们尝试采用NAA代替2,4—D,并配合6—BA使用,结果发现将由叶片诱导所形成的的愈伤组织接种于MS+1.0mg/L6-BA+1.0mg/LNAA培养基中,出芽率可达100%,而将试管苗接种于生根培养基MS+0.2mg/L6-BA+0.3mg/LNAA中进行生根培养,生根率也可高达100%。这表明,在半夏组织培养过程中,6-BA和NAA配比使用,也能达到较好的组培效果,长出健壮的半夏试管苗(图2)。但是,在此条件下培育的荆半夏,其药理活性成分和含量能否与野生荆半夏一致,则有待进一步研究。
参考文献:
[1]杨玉珍,王西雨,胡如善,等.半夏的組织培养与快繁实验[J].山东农业科学,2010(1):10-11.
[2]李玉先,刘晓东,朱照静.夏药理作用的研究述要[J].辽宁中医学院学报,2004,6(6):459~460.
[3]潘平,李伟平,熊明星,等.我国半夏产业现状及可持续发展策略[J].中国药房,2013,24(31):2881~2884.
[4]林先明,张军,谢玲玲,等.半夏新品种鄂半夏2号的选育[J].湖北农业科学,2010,49(11):2836~2838.
[5]王艺霖,屈文国,李昆志.旱半夏组织培养技术的优化研究[J].江西农业学报.2012,24(3):26~29.
[6]李先良,李居宁,张喜才,等.荆半夏胚性愈伤组织的诱导[J].江苏农业科学,2017,45(3):28~30.
[7]靳松,陈泽斌,李育川,等.半夏组培快繁体系的建立[J].时珍国医国药,2017,28(7):1759~1761.
[8]李会,张庚,孟义江,等.掌叶半夏微茎尖培养脱毒和快繁体系的建立[J].作物杂志,2016(3):51~57.
[9]吴能表,曹瑞霞,吴思靖,等.半夏再生体系的建立[J].西南大学学报(自然科学版),2018,40(9):1~5.
[10]喻娜,张晓峰,李华清,等.旱半夏不同外植体的愈伤组织诱导CJ7,分子植物育种,2018,16(17):5757~5764.
[11]罗光明.半夏的组织培养和植株再生[J].中药研究与科技,2000.2(4):13~14.
[12]杨春.生长素和细胞分裂素在马铃薯愈伤组织分化中的作用[J].山西农业科学,2008,36(7):40~42.
收稿日期:2019-10-22
基金项目:湖北省大学生创新创业训练计划项目(编号:201811798012)
作者简介:骆淑媛(1972-),女,实验师,研究方向为生物技术。
通讯作者:邓丽娟(1974-),女,副教授,博士,研究方向为生物化学与分子生物学。
